核素药物在肿瘤细胞治疗中的应用研究进展
2023-02-22江艳君李晓阳洪浩
江艳君,李晓阳,洪浩
(南京大学医学院 南京大学医药生物技术国家重点实验室 南京大学化学和生物医药创新研究院,江苏 南京 210093)
核素是指具有一定核电荷数和质量数,并且具有同一能态的原子核或原子。同位素由于质子数相同而中子数不同,导致彼此具有不同的结构方式,从而表现出不同的核性质。相对于稳定核素,放射性核素的原子核不稳定,经衰变能自发地放出α射线、β射线等辐射,从而可通过对这些放射源进行捕获检测和利用其产生的能量来实现其应用价值。高度可变的肿瘤微环境使得肿瘤细胞不仅能通过能量代谢的重编程来促进增殖,还能通过主动逃逸免疫细胞的监视和清除作用来维持其发展和转移[1]。放射性核素药物通过释放不同类型的射线对肿瘤部位进行显像或直接杀伤,根据不同肿瘤的特点可以设计和开发不同的核医学诊疗新方法。
对于诊断型核素药物而言,根据肿瘤的发生、发展阶段选择诸如化疗、靶向药物、抗体药物、细胞治疗等多种不同的方式对其进行杀伤清除后,可以通过核医学显像诊断对肿瘤细胞进行定位追踪与治疗效果评价。对于治疗型核素药物来说,不仅可以利用核素释放出的高能射线对肿瘤细胞进行辐射治疗,即传统的放射疗法,还可通过放射性核素偶联药物(radionuclide drug conjugates,RDC),即将核素通过连接臂(linker)与配体(ligand),如单抗、多肽或小分子等偶联在一起,利用配体的靶向作用将核素精准递送到肿瘤内部,在对肿瘤进行高剂量杀伤的同时降低对正常组织的辐射,从而减少副作用。也可将治疗型核素换成诊断型核素,从而实现其诊断功能,用于肿瘤的扫描、成像和诊断。本文就核素在肿瘤诊疗及与细胞疗法的协同诊疗等方面,结合近年来放射性核素的临床前研究与临床试验进行详细介绍,为核素药物的研究及临床转化提供发展方向。
1 诊断型核素在肿瘤细胞治疗中的应用
针对肿瘤组织和特定细胞的核素影像主要通过正电子发射计算机断层显像(positron emission tomography,PET)/电子计算机X射线断层扫描技术(computed tomography,CT)和单光子发射断层扫描成像(single-photon emission computed tomography,SPECT)/CT两大类检测设备进行检测。在肿瘤的细胞治疗领域,诊断型核素主要通过配体的靶向性进行体内药物代谢动力学追踪,根据患者体内特定靶点的分布对患者进行分选,确定其是否适合细胞疗法;或通过成像对细胞治疗前后的效果进行评价。下面将通过近年来的研究进展与临床应用对代表性诊断类核素在细胞治疗中的药物代谢追踪与治疗效果评价等方面进行详细介绍。
1.1 诊断型代表性核素
放射性核素需要具有一定的稳定性和半衰期,以便于仪器灵敏地监测定位;为满足临床要求,其在体内循环时间和人体可接受的辐射能量也有严格标准;此外,还要满足实际应用的大规模生产问题。
1.1.1 可用于肿瘤诊断的代表性核素穿透力强、定量极佳、检测灵敏度可高达皮摩尔的PET/ CT在医学影像领域具有举足轻重的地位。用于临床PET/CT的诊断核素主要包括碳-11(11C)、氟-18(18F)、镓-68(68Ga)、铜-64(64Cu)、锆-89(89Zr)几类,在肿瘤细胞治疗追踪和治疗效果评价方面发挥关键作用。18F由于具有低粒子运动能量、高β正电子衰减比例、易制备、放射标记产率高等多种优势,可通过与配体偶联得到各类用于靶向肿瘤细胞的诊断制剂,成为PET成像中近乎完美的诊断核素,因而得到了广泛的研究与应用。用18F标记诊断型核素药物的靶向配体主要为一些具有生物学活性的小分子及其类似物,如葡萄糖类似物、核苷酸类似物、雌激素类似物、胆碱等,也包括针对肿瘤缺氧环境设计的各类小分子探针。应用最为广泛的18-氟代脱氧葡萄糖(18F-flurodeoxyglucose,18F-FDG)为PET影像试剂的明星分子,可通过葡萄糖转运蛋白(glucose transporter,GLUT)转运并在己糖激酶磷酸化后被细胞捕获,能够类似糖类参与人体代谢,准确反映体内组织器官的葡萄糖代谢水平并将正常组织与肿瘤组织区别开来,不仅能在肿瘤诊断方面发挥其显著优势,同样能够评估化疗药物疗效。18F-FDG通过PET/CT与Cerenkov发光成像结合指导肿瘤的手术切除,能够明显识别和检测黑色素瘤动物模型的淋巴结转移灶来选择性切除荷瘤淋巴结[2],并在子宫癌和子宫内膜癌的淋巴结转移[3]和乳腺癌患者的辅助手术切除等临床试验中得到应用[4]。由于前列腺癌中胆碱激酶呈过表达状态已得到证实[5],脑部肿瘤中胆碱代谢亦呈异常[6]。18-氟代胆碱(18F-choline)能够临床诊断胆碱代谢异常疾病,还可为临床治疗决策提供上述大量有效信息[7]。近年来,利用乏氧诊断探针18-氟代氟米异硝唑(18F-FMISO)来高精度分辨肿瘤区域的乏氧情况,对非小细胞肺癌[8]、头颈癌[9]、原发性中枢神经系统淋巴瘤都起到了良好的诊断效果[10],并有助于引导手术治疗。此外,核苷酸类似物18-氟代胸苷(18F-fluorothymidine,18F-FLT)、雌激素类似物18F-氟雌二醇(18F-fluoroestradiol,18F-FES)用于三阴性乳腺癌(triple negative breast cancer,TNBC)治疗效果的检测[11]、浸润性小叶癌转移灶检测和药效衡量[12]都具有显著优势。由于正常脑皮质放射性摄取过强,极易掩盖肿瘤,导致诸如18F-FDG等标准PET/CT显像无法准确定位,而基于11C的氨基酸类显像剂如11C-蛋氨酸(11C-MET)极易穿透血脑屏障进入脑组织,能反映氨基酸的转运、吸收利用及氨基酸在恶性肿瘤中的代谢活性,从而更好地显示脑部肿瘤,对于低级别胶质瘤患者的个性化治疗决策[13]、原发性中枢神经系统淋巴瘤治疗效果评估等方面均体现其良好的应用价值[14]。
1.1.2 可用于PET/CT的核素68Ga为PET/CT中一种常用的核素,半衰期较短,与配体通过配位作用螯合进入RDC后,不仅具有良好的体内稳定性,其衍生的一系列核医学诊断试剂对特定肿瘤的原发或转移灶还具有检测效果更灵敏的特点,在对微小、难鉴别肿瘤的鉴定上起到了重要的作用。研究表明,68Ga标记的成纤维激活蛋白抑制剂-04(68Ga-FAPI)对胃肠道恶性肿瘤的原发灶和转移灶的PET/CT诊断效果显著优于18F-FDG[15];对18F-FDG轻度摄取的实体瘤的诊断、分期评判均表现突出,并可用于评价转移性疾病患者的放射性核素治疗效果[16]。此外,68Ga标记的前列腺特异性膜抗原配体(prostate specific membrane antigen,PSMA),例如,68Ga-PSMA-11对于糖代谢低的前列腺癌的检测已成为PET/CT前列腺癌诊断的金标准[17]。研究显示,临床通过68Ga-PSMA PET/CT结合吲哚菁绿(indocyanine green,ICG)引导的根治性淋巴结清扫术(salvage lymph node dissection,sLND)能够有效去除根治性前列腺癌切除术后的淋巴结复发[18]。此外,其他一些用于诊断的核素如64Cu、89Zr与功能化配体结合的核医学制剂近年来在肿瘤细胞治疗过程中的PET/CT成像检测上同样发挥着显著优势。利用64Cu标记的铜(Ⅱ)-二乙酰基-双(N4-甲基氨基硫脲)[64Cu(Ⅱ)-diacetyl-bis(N4-methylthiosemicarbazone),64Cu-ATSM]对于细胞抗氧化能力的检测能力进行肿瘤缺氧灶成像,不仅可以对碳离子放射治疗效果进行有效评估[19],还可以作为治疗剂有效增强贝伐单抗诱导的结肠癌异种移植模型中血管减少和缺氧的抗肿瘤治疗[20]。利用放射性金属螯合剂将89Zr偶联靶向人表皮生长因子受 体 2(human epidermal growth factor receptor 2,HER2)的单克隆抗体(mAb),在多模式影像引导肿瘤切除手术中得到了广泛应用[21-22]。89-锆标记的西妥昔单抗([89Zr]Zr-cetuximab)可以检测达沙替尼在表皮生长因子受体(epidermal growth factor receptor,EGFR)过表达的TNBC细胞中的分布[23],从而对药物治疗效果检测提供一定的参考依据。
尽管PET/CT具有诸多优势,但仍存在费用较高、空间精度较差等问题。鉴于此,尽管SPECT/CT的分辨率和灵敏度不及PET/CT,但由于成本较低且功能多样,在肿瘤的临床诊断上仍具有重要地位。用于诊断的SPECT/CT核素主要包括锝-99m(99mTc)、碘-123(123I)、铟-111(111In)等,不仅能够准确定位肿瘤病灶并据此进行癌症进展分期和预后分析,也可对肿瘤细胞治疗追踪诊断和治疗效果进行评价。
1.1.3 可用于SPECT/CT的核素111In作为一种应用较早的SPECT/CT示踪剂,其标记的博来霉素复合物(111In-BLMC)用于区分高级别和低级别胶质瘤已得到了广泛应用[24]。最近研究表明,新开发的利用二乙烯三胺五乙酸(diethylenetriaminepentaacetic acid,DTPA)标记的111In结合靶向乳腺癌中过表达的黏蛋白1(mucoprotein,MUC1)抗原的PR81(111In-DTPA-PR81)能够用于MUC1阳性乳腺癌的放射免疫闪烁成像(radioimmunoscintigraphy,RIS)[25],此外,通过将靶向C-C趋化因子受体4(C-C chemokine receptor 4,CCR4)的莫格利珠单抗(mogamulizumab)利用DTPA标记111In后,能够反映成人T细胞白血病(adult T-cell leukemia,ATL)/淋巴瘤临床前模型药物治疗后的效果并确定体内CCR4阳性细胞的分布情况[26]。目前,临床则更倾向于使用99mTc作为SPECT/CT常用的显像示踪剂,其核制剂锝[99mTc]亚甲基二磷酸盐(99mTc-MDP)对于癌症治疗后骨转移病变检测的诊断效果得到了临床的一致认可[27]。由于成纤维细胞活化蛋白(fibroblast activation protein,FAP)在绝大多数上皮源性恶性肿瘤的基质成纤维细胞中高表达,99mTc标记的FAP抑制剂(FAP inhibitor,FAPI)99mTc-FAPI-34可以作为比PET/CT成本更低的示踪剂,诊断肿瘤患者转移情况,并可通过标记治疗性核素铼-188(188Re)发挥治疗效果[28]。在临床诊断上,由于去甲肾上腺素的类似物间碘苄基胍(metaiodoenzylguanidine,MIBG)已被证明是神经内分泌和神经嵴肿瘤的一种有价值的显像剂,123I标记的MIBG已广泛用于神经母细胞瘤和嗜铬细胞瘤的成像,可利用神经母细胞瘤细胞具有积累碘[123I]硫酸苄胍(123I-MIBG)的独特能力用于肿瘤的闪烁显像[29],不仅能够诊断其骨骼病变的分期和定位,同时可基于对123I-MIBG扫描的扩展评分和手术部位摄取的半定量结果,从而评估神经母细胞瘤的治疗效果和预后[30-31],已成为继美国 FDA批准的131I-MIBG后能够更好评估治疗反应和预测生存率的有力工具[32]。截至2021年,非官方统计的可用于 肿瘤细胞治疗的诊断类代表性核素如表1所示。
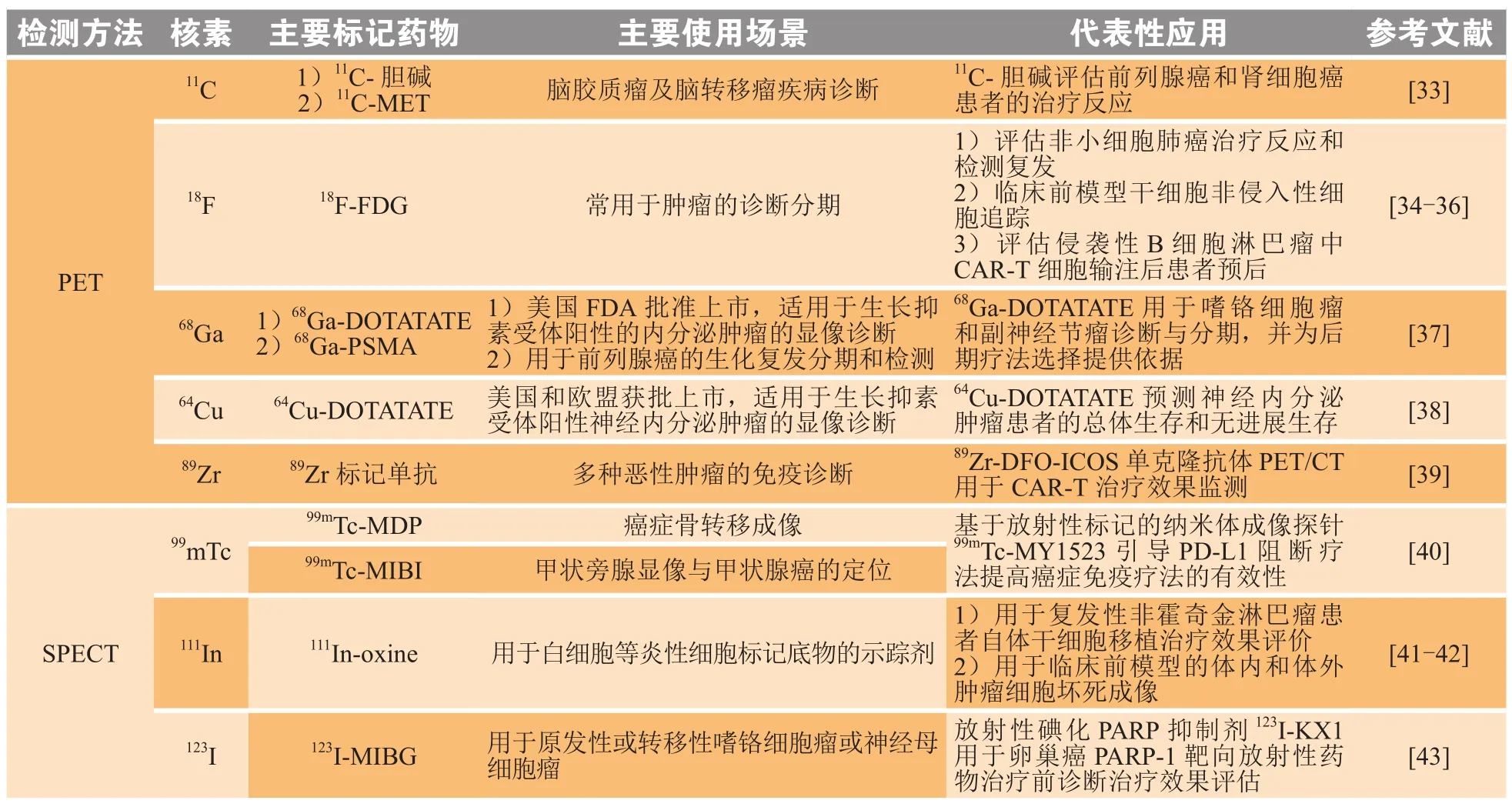
表1 可用于肿瘤诊断的代表性核素Table 1 Representative nuclides for cancer diagnosis
1.2 诊断型核素在肿瘤细胞治疗追踪中的应用
通过各类临床诊断方式对细胞进行体内成像和跟踪,监测标记的治疗性细胞和免疫细胞在肿瘤微环境中的分布和迁移,能够提高细胞疗法的准确性,并为细胞治疗的疗效和安全性提供有用的信息[44-45]。例如,监测CAR-T或肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TIL)的空间分布可用于监测细胞运输到患者体内目标部位的效率,从而对细胞治疗效果进行评估[46]。同时,利用PET影像进行细胞追踪还能够解决因为细胞增殖导致的放射信号稀释的问题[47]。下面对一些常用核素在肿瘤细胞治疗追踪中的应用进行详细介绍。
1.2.1 18F-FDG用于细胞治疗追踪18F-FDG是肿瘤学中使用最广泛的临床PET示踪剂,鉴于其在许多器官中的高背景水平摄取,已被用于癌症、炎症和梗死患者的短期细胞递送治疗示踪[48-49]。18F-FDG也被用于在临床前模型中对工程化细胞、即标记表达肿瘤相关ErbB2(HER2/neu)抗原特异性嵌合抗原受体的自然杀伤细胞[NK-92-scFv(FRP5)-zeta]的检测,与亲代NK-92细胞相比,能够观察到HER2/neu阳性肿瘤中NK-92-scFv(FRP5)-zeta细胞在2 h达到最高摄取,灵敏度显著高于放射自显影和组织病理水平检测[50]。此外,一项研究将18F-FDG标记的巨噬细胞活化杀伤细胞(macrophage activated killer cells,MAK)注射到上皮性卵巢癌腹膜复发患者中,从而在细胞免疫治疗的早期进行跟踪研究,在第一时间为免疫细胞治疗敏感型患者提供了疗效可视化[51]。
1.2.2 金属核素-oxine用于细胞治疗追踪用于常规临床应用的细胞追踪方法需要采用标记可靠和在细胞内停留时间更长的长半衰期示踪剂。89Zr已成为用于直接细胞标记的有前景的PET放射性同位素,并且已在基于抗体的免疫PET成像中使用多年[52]。类似于SPECT成像中使用的111In-oxine,89Zr可用于合成中性和亲脂性复合物89Zr-oxine,其中离子载体oxine作为配体与89Zr结合,通过被动运输方式进入细胞,并作为亚稳态复合物解离,将放射性物质沉积在细胞内[53],能够在保持细胞活力和功能的前提下对CAR-T细胞标记成像[54]。89Zr可以与核蛋白和细胞质蛋白结合产生生物惰性,由于其在细胞内的残留特性,非常适合纵向细胞成像[55]。由于89Zr半衰期较长,89Zr-oxine能够在注射后对标记的细胞进行至少7 d的成像追踪。研究表明,89Zr-oxine标记的T细胞的体外检测下限约为1×103个数量级的细胞,而对于细胞放射比活度的要求可低至15(kBq·10-6),目前已有研究者计划将这种细胞追踪方法推广到PET/CT和PET/MRI的临床应用当中[56]。近年来对89Zr-oxine细胞标记和成像的临床前研究总结如表2所示。
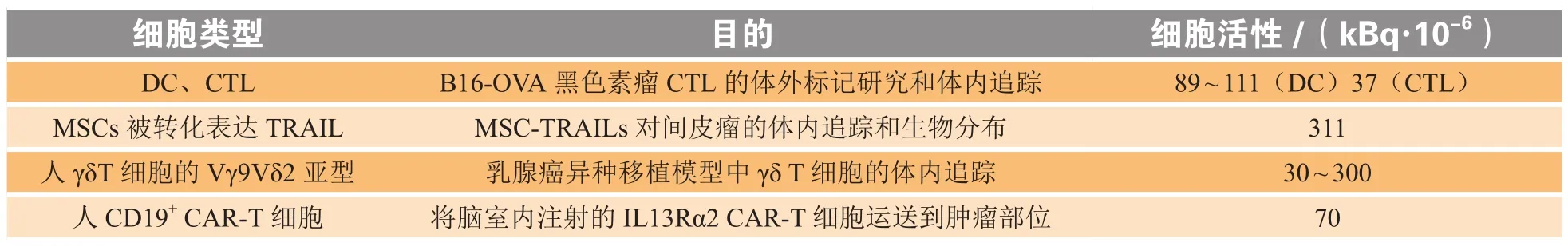
表2 89Zr-oxine细胞标记和成像的临床前研究Table 2 Preclinical labelling and imaging studies of cells labelled with 89Zr-oxine
1.2.3 核素偶联抗体及其衍生物用于细胞治疗追踪迄今为止,抗体及其衍生物仍然是效率最高的靶向分子,基于抗体核素诊断试剂的免疫正电子发射断层扫描(immunoPET)结合了mAb的靶向特异性和PET技术的固有敏感性,不仅能够对肿瘤细胞精确定位,还可以对药物疗效进行综合评估。例如,靶向PSMA阳性前列腺癌的抗体J591能够同多种放射性核素结合,用于辅助前列腺肿瘤诊断和治疗,并在最近的Ⅰ/Ⅱ期临床试验中进行了测试,为前列腺癌患者的个性化医疗指明了方向[57]。但抗体作为核素诊断试剂存在一系列问题,例如PD-L1抗体开发的免疫PET成像虽然在多种癌症诊断中得到了应用[58],但检测过程难免会因为PD-L1抗体在脾脏等人体其他部位也有广泛分布而影响诊断效果。同时,普通抗体在体内的半衰期长,会与免疫细胞发生相互作用,从而产生脱靶效应。尽管可以通过化学修饰的方式得到一定解决,但为了获得更佳的信噪比并减轻病人的辐射,通常会选择采用预负载的方法将未标记的抗体首先注射到患者体内后,再进行免疫PET成像[59],或采用预靶向的方法提高检测灵敏度[60]。近年来,随着抗体工程研究的不断深入,具有对靶点亲和力高、穿透力好、代谢速度快、标记方式多样并可对肿瘤类型精细分选的纳米抗体应运而生,极大程度上弥补了传统抗体的缺陷[61]。例如,利用99mTc标记的抗PD-L1单域抗体能够对非小细胞肺癌免疫治疗安全性进行精准评估[62]。
基于抗体及其衍生物的特点和优势,现已开发出一系列利于肿瘤细胞靶向追踪的抗体类核医学制剂用于免疫成像。通过放射性标记的抗体在细胞给药后的不同时间点单次或重复注射,可以对CAR-T细胞进行持久性的纵向和连续评估。迄今为止,用于研究T细胞免疫反应并进行持续追踪的靶分子主要包括:T细胞分化抗原簇(例如CD3、CD4、CD7和/或CD8)[63-69]和T细胞表面活化标志物,例如肿瘤坏死因子受体超家族成员4(tumor necrosis factor receptor super family mumber 4,Tnfrsf4,也称OX40)、组织相容性抗原-DR(human leukocyte antigen DR,HLA-DR)和ICOS[70-72],其中,以ICOS为检测靶点进行免疫PET/CT,能够监测CD19特异性CAR-T细胞活化、扩增和归巢,结果表明,与对照组(未处理组与未工程化T细胞处理组)相比,以示踪剂量施用ICOS靶向抗体在CAR-T细胞治疗小鼠的特定含骨髓骨骼部位可检测到更强的信号,且不会干扰CAR-T细胞的持久性和功能,不仅对肿瘤细胞的作用效果进行准确评估,还可进行长期、多器官的细胞追踪[39]。
1.2.4 核素标记的纳米诊断系统介导的细胞治疗追踪基于免疫疗法开发的核素标记的纳米诊断系统,能够在治疗过程中辅助诊断的同时最大程度上减少对其他正常部位的潜在伤害。核素标记的纳米载体平台不仅可以提高诊疗安全性、特异性和敏感性,还能实现对细胞之间相互作用的定位追踪,已成为具有广阔应用前景的药物递送策略[73]。其中,通过纳米材料的表面修饰制得的多功能放射性标记纳米材料,已被确证具有良好的生物相容性和靶向性[74]。
现已开发多种针对细胞治疗的纳米诊断系统,并在临床前阶段进行了研究。例如以重组高密度脂蛋白(reconstituted high-density lipoprotein,rHDL)为纳米载体,负载89Zr标记的肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)显像剂,进行巨噬细胞的定量PET/CT,对于TAM的无创监测和靶向治疗有重要的价值[75]。另外,由于单一成像手段存在局限性,多模态纳米材料成像探针的设计开发可以提供更加详细且互补的诊断信息,为准确识别和定位异常部位提供依据。研究表明,采用89Zr标记的PET/CT和近红外荧光(near-infrared fluorescence,NIRF)双模态介孔二氧化硅纳米探针,对临床前卵巢腹膜癌模型过继转移免疫细胞进行追踪监测,成功实现了长期细胞跟踪、治疗效果评价与组织分布评估[76]。
1.2.5 18F-FHBG用于细胞治疗追踪单纯疱疹病毒-胸苷激酶(herpes simplex virus thymidine kinase,HSV-TK)是一种能够磷酸化胸苷或非天然核苷的病毒核苷激酶,可作为PET成像中可靠的报告基因。当9-(4-氟[18F]-3-(羟甲基)丁基)鸟嘌呤[9-(4-(18)F-fluoro-3-[hydroxymethyl]butyl)guanine,18F-FHBG]进入体内后,细胞表面的核苷转运蛋白能使探针进入细胞内,当HSV-TK存在时,18F-FHBG可被磷酸化,以防止外流并允许其在细胞内积累,从而进行靶细胞的显像诊断,不仅在肿瘤细胞的显像诊断中得到广泛应用,还可用于肿瘤细胞免疫治疗的细胞追踪[77]。
目前,细胞因子诱导的杀伤细胞(cytokine induced killer cell,CIK)过继转移疗法已被用于多种肿瘤免疫治疗策略中。研究表明,对临床前动物模型的过继CIK细胞转移治疗中,可通过18F-FHBG进行PET/CT成像,有效监测细胞治疗的疗效[78]。然而对获得性免疫疗法的抗性可能限制对这种治疗的反应,因此需要通过对过继转移的免疫效应细胞进行包括细胞定位、归巢、肿瘤靶向,保留和免疫细胞与肿瘤细胞的结合等纵向评估来选择对治疗效果敏感的患者并对免疫治疗进行优化,同时根据一些有价值的早期指标对治疗的反应进行预测和评估[79]。
1.3 诊断型核素对肿瘤细胞治疗效果评价的应用
通过设计放射性示踪剂,以靶向与癌症相关的特定生物过程(例如,癌症代谢、血流、增殖和肿瘤受体表达或配体结合),PET/CT可以检测癌症扩散、表征癌症表型并评估其对治疗的反应。PET/CT能够通过测量代谢性肿瘤体积在治疗前后的变化来反映细胞治疗效果[80]。在该成像技术中,利用高灵敏度的核医学制剂对多种诊断参数进行测量,使得诊断类核素药物在预测患者预后和评估治疗反应等方面得到广泛应用[81]。
1.3.1 18F-FDG用于细胞治疗效果的评价18F-FDG主要通过基于以下几个诊断参数进行定量分析来对细胞治疗效果进行评价。首先,标准摄取值(standard uptake value,SUV)被定义为组织放射性浓度与按体质量(或瘦体质量)标准化的注射剂量的比率,是用来量化代谢活动最常用的参数,治疗前后测量的SUV之间的差异可用于预测早期肿瘤反应[82]。最大SUV(SUVmax)是肿瘤内SUV的最大值,由于测量简单且可独立于观察者,因此SUVmax是临床实践中常用的参数[83],但由于SUVmax对图像噪声很敏感,会受到患者个体差异和成像参数的影响,同时因为该值仅来自一个肿瘤位点,并不能代表整个肿瘤代谢负荷。峰值SUV(SUVpeak)是肿瘤中一个小的、固定大小的感兴趣区域(region of interest,ROI)内的平均值,可以成为替代SUVmax的更好方案,然而,SUVpeak对ROI的大小和形状很敏感,目前尚未建立测量SUVpeak的标准[84]。相比较SUV,代谢肿瘤体积(metabolic tumor volume,MTV)与总病灶糖酵解(total lesion glycolysis,TLG)在多种恶性肿瘤中具有预后价值,与组织病理学反应的相关性更好[85]。MTV是指具有高代谢的肿瘤体积大小,是衡量代谢活跃的肿瘤体积(局部和总肿瘤负荷)的重要参数。TLG定义为平均SUV和MTV的乘积,能够同时反映平均全肿瘤代谢活性和肿瘤体积两个参数。目前,上述诊断参数已广泛用于多种类型恶性肿瘤的分期和治疗反应监测。临床分析结果表明,晚期非小细胞肺癌(nonsmall-cell carcinoma,NSCLC)患者接受化学免疫疗法后,通过SUVmax、MTV、TLG这3项PET/CT参数与临床结果结合评估,可以显著预测患者治疗反应、无进展生存期(progression-free survival,PFS)与总生存期(overall Survival,OS)[86]。同时,最近的临床数据分析表明,PET诊断参数对于食管癌[87]、小儿淋巴母细胞瘤[88]、恶性胸膜间皮瘤[89]等的预后价值评估也具有显著意义,但仍需与其他生物标志物结合或与更多的临床样本数据关联进行综合评估。
鉴于PET的系列功能参数能够作为各种淋巴瘤亚型潜在的生物标志物,采用18F-FDG进行PET/CT成像对细胞治疗的效果进行评价已经在临床水平得到了应用。通过PET/CT能够观察到接受CAR-T治疗1个月后的非霍奇金淋巴瘤(non-Hodgkin,s lymphoma,NHL)患者在肿瘤转移灶的消失,而PET/CT的一系列代谢参数与接受CAR-T细胞治疗的复发/难治性NHL患者的OS、PFS和不良反应(如细胞因子释放综合征)之间关系密切[90](见图1A)。对于接受同种异体干细胞移植(allogeneic stem cell transplantation,allo-SCT)的淋巴母细胞瘤(lymphoblastic lymphoma,LBL) 患 者,18F-FDG的PET/CT的代谢参数结果能作为评估PFS的有力指标,为患者后续治疗方案的选择提供重要证据[91];此外,对于侵袭性B淋巴细胞瘤患者,接受CAR-T细胞治疗后1个月(M1)的肿瘤动力学参数表明,SUVmax可以充分区分不同患者的预后,表明18F-FDG的PET/CT代谢参数对于预测接受CAR-T治疗后PFS和OS的预后价值具有重要意义[92]。64Cu-DOTA-曲妥珠单抗对细胞治疗诱导的靶点变化评价显示, HER2的体内评价可证实HER2表达量在局部病灶的变化[93](见图1B)。
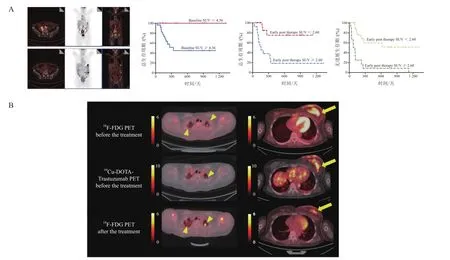
图1 诊断类核素对肿瘤细胞治疗效果评价应用实例Figure 1 Practical evaluation of diagnostic nuclides used for cancer cell therapy
2 治疗型核素在肿瘤细胞治疗方面的应用
肿瘤细胞的治疗手段需要根据肿瘤发生、发展阶段来选择,利用核素衰变释放出射线和粒子束来治疗肿瘤的传统放射治疗已成为大多数恶性肿瘤患者不可缺少的重要治疗手段,核素药物具有精确制导、灵敏诊断、杀伤效果极佳等优势,作为肿瘤诊疗中的有效工具,近年来得到了广泛的发展和应用。
RDC作为治疗型核素药物中最具有应用前景的一种,通过配体(如设计的各类小分子、多肽、抗体)与放射性核素的交联,利用针对特定肿瘤细胞表面不同靶点(如各类受体、抗原、转运蛋白和细胞表面分子标记)的配体的靶向性发挥作用。治疗用核素药物具有便于药物运输的体内滞留时间,且不伤及正常细胞。根据核素的辐射能量、辐射距离与半衰期的不同可以选择不同类型的治疗型核素用于不同肿瘤的治疗。可与细胞疗法联用杀伤肿瘤细胞的治疗类核素如表3所示。

表3 可用于肿瘤细胞治疗的治疗类核素Table 3 Therapeutic nuclides for cancer cell therapy
2.1 放疗型核素及其衍生药物
放射治疗通过采用放射线照射造成DNA损伤使肿瘤细胞坏死凋亡,可以分为外照射放疗(external beam radiation therapy,EBRT)和选择性内放疗(selective internal radiation therapy,SIRT)两种方式。EBRT是指通过放疗仪器在体外发出射线,透过皮肤对体内的肿瘤进行照射;而SIRT作为一种短距离放射治疗方式,通过放入体内的放射源发出射线达到治疗肿瘤目的,具有给药剂量高、作用部位更精确、照射时间短、周围正常组织剂量低等特点,可以对诸如肝细胞癌等多种癌症具有良好的治疗效果[99]。SIRT方式治疗肿瘤主要包括靶向治疗(如放射免疫治疗、受体介导放射性核素治疗)、介入治疗(如放射性治胶体腔内疗、放射性粒子植入治疗)和敷贴治疗(如放射性敷贴器病变皮肤表面、局部治疗)3种策略,放射性核素靶向治疗作为公认的未来最具潜力、效果最好的核素肿瘤治疗手段之一,能够彻底弥补传统EBRT中在靶向性和治疗效果上存在的局限性。
放射性核素受体靶向治疗是一种利用放射性核素标记的特异配体,通过配体与肿瘤细胞变异分化过程而增强表达的某些受体的特异性结合,使大量放射性核素浓聚于肿瘤部位的内照射治疗方法。通过对癌细胞表面相应受体进行肿瘤细胞靶向,并利用PET/CT确定癌细胞的治疗后反应。治疗方法包括内照射治疗和硼中子俘获治疗(boron neutron capture therapy,BNCT),需要权衡肿瘤辐射的效率以及治疗成本采用适合不同癌症类型的治疗手段。
2.1.1 镥-177及其衍生核素药物177Lu是一种β核素,与其他放射性核素相比具有更高的射程和能量,同时它发射的γ射线也有助于监测肿瘤反应,专门用于肽受体放射性核素治疗(peptide receptor radionuclide therapy,PRRT)。药物分子包含一种作为转运部分的蛋白质分子,可以识别位于癌细胞表面的靶向受体并与之结合。放射性成分附着在这种蛋白质载体上,从而将核素靶向递送至肿瘤细胞而发挥其杀伤作用。用于临床的两大类核素药物——177Lu-PSMA-617和177Lu-DOTATATE(商品名Lutathera®)分别针对晚期前列腺癌和神经内分泌肿瘤,与传统癌症治疗相比具有更好的安全性和有效性,不仅可以最大限度地减少患者的住院时间,对患者耐受性良好,仅影响病理灶而不影响健康组织;同时药物的活性成分会影响不同位置的癌细胞,这不仅可以对抗原发性肿瘤,还可以对其转移灶具有靶向清除效果。目前,针对177Lu的研究呈爆发式增长,但仍主要针对晚期前列腺癌和神经内分泌肿瘤患者的治疗。
用于治疗晚期前列腺癌的药物通过177Lu与靶向前列腺癌细胞表面PSMA的配体偶联进行放射性配体疗法(radioligand therapy,RLT)[100],可有效摧毁肿瘤本身和转移灶[101],帮助缓解转移性前列腺癌的疼痛和其他临床表现。对于其他治疗手段效果均不佳的转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC),利用DOTA偶联177Lu与PSMA-617已被证明是一种有效的治疗手段[102]。通过68Ga提供的基于SUV阈值PET/CT的影像学信息,能够为177Lu-PSMA-617的治疗效果提供直接依据,从而实现肿瘤细胞的配对诊疗[103]。此外,由于PSMA在多种类型癌症的新生血管系统中也存在着不同程度的表达[104],因此,177Lu-PSMA-617对于前列腺癌之外其他类型的对放射治疗敏感的实体肿瘤的新生血管组织同样具有一定的靶向杀伤能力[105]。临床报道表明,177Lu-PSMA-617的RLT可减轻腮腺转移性腺样囊性癌患者疼痛[106],减少胶质母细胞瘤患者肿瘤体积[107],而甲状腺癌患者表现出持续7个月的部分缓解[108],这些患者均有较好的耐受性,不良反应几乎不存在或较轻,进一步证实了该药物的治疗效果。
神经内分泌肿瘤(neuroendocrine tumor,NET)生长缓慢,恶性程度较低,因此即使在晚期才被诊断,患者也可具有较长的生存期。镥氧奥曲肽(Lutathera)是全球首个被美国FDA批准的PRRT类药物,用于生长抑素受体阳性的胃肠胰腺神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms,GEP-NETs)的治疗[109]。由于 NET 表面高表达生长抑素受体(somatostatin receptor,SSTR),Lutathera通过SSTR类似物DOTATATE螯合具有治疗作用的177Lu(177Lu-DOTATATE),对于SSTR-2阳性的胃肠胰腺神经内分泌肿瘤具有较好的治疗效果[110]。临床试验表明,在生长抑素类似物(somatostatin analog,SSA)治疗后病情恶化而只能接受PRRT作为一线治疗的患者中,177Lu-DOTATATE能为他们争取更长的PFS[111];在直肠神经内分泌肿瘤患者接受177Lu-DOTATATE治疗后,还可通过68Ga-DOTATATE的PET/CT评估其疗效[112]。
近年来177Lu治疗药物的生产制备和临床试验研究较多,欧美等发达国家占主导。基于177Lu广阔的发展前景和应用价值,研发其衍生的靶向性和杀伤效果更强的肿瘤治疗药物值得进一步深入探索。
2.1.2 面向未来的新一代治疗型核素锕-225常用的治疗型核素主要通过β型核素发射的β射线进行放射性治疗,而α型核素产生的α射线在固体组织中具更大的线性能量传递和更短的射程,能够在肿瘤内部或转移的边界沉积能量。与β射线不同,α射线可不仅仅依赖自由基的产生来造成DNA损伤;相反,沉积的能量足以直接导致DNA双链断裂。因此,使用靶向α-粒子疗法(targeted alpha-particle therapy,TAT)能够潜在地规避由于自由基清除机制导致的辐射抵抗,使得TAT用于治疗实体瘤的研究与开发得到了广泛研究。
225Ac是一种α型核素,被称为体内α粒子发生器[113],在TAT中得到广泛应用。225Ac半衰期长达9.9 d,可在肿瘤部位长时间积累,并能够在其衰变链中发射4个α粒子,从而产生更大的辐射剂量。以FAP为靶点,采用225Ac标记FAPI的RDC225Ac-FAPI-04在人胰腺癌异种移植模型中进行靶向α治疗效果显著,有望用于表达FAP的胰腺癌的临床治疗[114]。另外,将225Ac包裹在重组高密度脂蛋白(reconstituted high-density lipoprotein,rHDL)纳米颗粒中来制备靶向递送系统,能够利用rHDL特异性识别在特定类型癌细胞中过度表达的清道夫受体B型I(scavenger receptor B type I,SR-BI),用于SR-BI受体肿瘤的治疗[115]。临床研究表明,使用225Ac-PSMA-617治疗转移性去势抵抗性前列腺癌效果显著[116-117],225Ac-DOTATATE的靶向α治疗对于β射线难治性转移性胸腺NET具有出色的治疗效果[118];在225Ac标记的林妥珠单抗(225Ac-lintuzumab)治疗急性髓性白血病(acute myelogenous leukemia,AML)的过程中,循环原始细胞的消除或骨髓原始细胞的减少证实了225Ac与细胞疗法的协同杀伤作用[119]。
然而,尽管针对更多肿瘤类型的TAT在最近的临床试验中取得了可喜的成果,但225Ac核素药物的开发仍然面临着许多挑战[120]。首先,225Ac的供应有限,目前全球产能每年仅63 GBq(1.7 Ci),每年仅可治疗不到1 000名患者;其次,在生产过程中需要足够的化学纯化工艺将225Ac与其同时产生的同位素进行分离;此外,225Ac需要高放射性标记产率和适当药效学的稳定靶向系统,但225Ac在衰变反冲后会随衰变链的延伸发生化学性质变化[121],导致靶点位置保留225Ac的子代同位素变得复杂。使得靶点保留225Ac的子代同位素变得复杂。因此,不仅需要在药物制备方面优化螯合物的设计,还需要建造或使现有设施能够批量生产225Ac等同位素来增加产量,以推进临床开发中化合物的现有临床试验进程。
2.2 新兴核素偶联药物的配对诊疗
治疗诊断学是一个新兴领域,通过将诊断和特异性靶向治疗相结合,实现对患者的精准医疗[122]。通常采用标记有两种不同放射性核素的相同配体的RDC进行治疗诊断,一种放射性核素用于成像,另一种用于治疗,利用配体的靶向性的介导从而实现配对诊疗。核素药物生产的难点除对核素种类的选择之外,在交联剂的设计方面需要考虑其与核素或其他治疗类药物配位的效率,并根据其本身负载成分考虑其是否需要裂解发挥作用及是否会影响配体与肿瘤靶点的相互作用,也需要考虑其在体内的稳定性与肿瘤特异性释放的药代动力学[123],而特定配体的选择对于核素药物的配对诊疗则起到了至关重要的作用,其中PSMA和SSTR2靶向的配对诊疗在前文中已提及,下面将针对近年来新兴配体的RDC的配对诊疗进行介绍。
2.2.1 抗体类核素偶联药物抗体偶联药物(antibody-drug conjugate,ADC)是近年来研究较多的癌症治疗药物之一,已成为一类具有广阔前景的生物制剂,利用不同类型的抗体与肿瘤细胞特定位点特异性结合发挥细胞毒性药物的杀伤作用,从而实现对癌细胞的精准高效清除。目前,FDA已批准了11种ADC专利[124],另外大批研究成熟的ADC已被投入到临床试验当中[125]。抗体类RDC作为ADC的一个分支,利用抗体的特异性识别功能,将具有治疗作用的放射性核素靶向至体内特定肿瘤部位,进行放射免疫治疗(radioimmunotherapy,RIT)的同时评估体内的肿瘤异质性,能够最大限度减少对健康组织的辐射暴露,实现对肿瘤细胞的配对诊疗[126]。目前,已有两种抗体类RDC(Zevalin®和Bexxar®)被FDA批准用于治疗复发性难治性NHL。
在ADC的放射治疗领域中,通过将抗体标记的核素由诊断类替换成治疗性核素的容易性使得对恶性肿瘤的成像后治疗得到了广泛发展和应用。一项临床前研究表明,靶向游离前列腺特异性抗原(KLK3)的人源化mAb(hu5A10)在前列腺癌中具有一定的治疗潜力,用89Zr标记的hu5A10能够用于疾病诊断;用225Ac标记的hu5A10的表现优于90Y的治疗效果,具有在前列腺癌配对诊疗和临床转化上的应用价值[127]。
尽管放射免疫治疗表现出了对血液系统恶性肿瘤的有效性,但由于实体瘤肿瘤血管形成不良,其具有药物递送的局限性和一定的放射抗性,抗体类RDC对实体瘤的诊断治疗仍具有很大的挑战[128]。因此,需要进一步设计开发对肿瘤组织渗透效果更佳的抗体类RDC的递送平台并发挥其诊断治疗的优势,同时对已有的核素偶联抗体类药物平台的临床转化进行进一步评估。
2.2.2 核素纳米材料近几十年来,纳米材料在医学领域得到了广泛的应用[129],在肿瘤诊断和治疗方面已成为研究热点。纳米材料通过其在血管内的增强通透性和滞留效应(enhanced permeability and retention effect,EPR)特异性富集在肿瘤区域,然后在肿瘤细胞中被吞噬后降解,提高药物递送效率[130]。使用纳米平台能够将治疗性同位素选择性递送到肿瘤中,明显提高生物利用度并使其对正常组织的毒性最小化[131];同时,与游离放射性同位素相比,基于纳米粒子的放射性同位素递送可以将多个放射性同位素同时加载到一个粒子内[132],为协同治疗与配对诊疗提供强有力的递送平台。目前已开发出多种用于核素配对诊疗的纳米材料,其中,用于转移性黑色素瘤成像的124I标记的量子点纳米颗粒已开展临床试验[133]。
尽管功能化纳米平台已显示出巨大的潜力,能够改善放射性同位素的生物利用度和肿瘤靶向性,但大多数研究仍处于早期阶段,还有许多未解决的问题,例如纳米材料可能的毒性和体内的代谢问题仍然需要进一步研究[134]。同时,治疗性放射性同位素在用于癌症治疗时,纳米载体对特定疾病亚型的内在放射毒性、生物安全性、可用性与组装能力应当被充分检查[135]。
2.3 放射性核素偶联药物与过继细胞免疫疗法结合应用
免疫治疗能持久清除残留在体内的少量的、播散的肿瘤细胞,提高机体因放、化疗而受损的免疫功能。大量临床实践表明,免疫治疗在多种肿瘤治疗中展示了其良好的应用前景,可以提高治疗效果,改善肿瘤患者的生活状态。其中,过继细胞免疫疗法(adoptive cellular immunotherapy,ACT)是免疫治疗的一种,一般通过对肿瘤患者体内的免疫细胞进行扩增培养或基因改造,增加免疫细胞的靶向杀伤功能,再将其回输到患者体内以增强其抗癌能力,从而杀灭血液或组织中的癌细胞。目前,对于ACT的研发和临床应用主要通过已明确的靶点和机制探索来进行。由于核素药物具有灵敏诊断、靶向杀伤等优于常规治疗方法的显著优势,能够与常规三大肿瘤疗法联合应用显示出互补的优势,RDC与ACT联合对肿瘤细胞的协同治疗具有极为广阔的发展前景和临床转化价值(见图2)。
图2 核素偶联药物与过继细胞免疫疗法结合应用示意图Figure 2 Schematic diagram of combined application of ACT with RDC
2.3.1 放射性核素偶联药物与自体干细胞移植疗法协同治疗自体干细胞移植疗法(autologous hematopoietic stem cell transplantation,ASCT)是一种在肿瘤患者经过高剂量化疗达到完全缓解后,应用患者自身的造血干细胞进行移植的一种肿瘤细胞治疗手段,对于血液和淋巴性肿瘤,如原发性中枢神经系统淋巴瘤[136]、多发性骨髓瘤[137]等都具有较好的治疗效果。但由于肿瘤细胞容易对化疗药物产生耐药性,导致该疗法仍存在预后不良等风险因素。核素药物的靶向放射治疗不仅可以避免全身照射对于局部组织病灶放射剂量的毒性限制[138],同时通过向疾病部位提供治疗剂量的辐射,最大限度地减少毒性,从而改善患者预后。临床研究表明,用碘-131(131I)标记的CD45靶向抗体-放射性核素偶联物在复发或难治性淋巴瘤患者中得到了良好疗效和长期缓解[139]。鉴于CD45靶向治疗的优越性,用钇-90(90Y)抗CD45免疫治疗也可以安全地与卡莫司汀+依托泊苷+阿糖胞苷+美法仑(carmustine +etoposide + cytarabine + melphalan,BEAM)化疗联合治疗,不仅不良反应可控,且在短期和长期治疗下均反映出有效的治疗效果[140-141]。
综上,尽管放射性核素的剂量控制和偶联药物的制备仍存在其固有挑战,但作为一种辅助手段,或作为ASCT的协同免疫疗法值得进一步与目前可用的各类新型药物结合,发挥对肿瘤细胞更好的靶向清除效果。
2.3.2 放射性核素偶联药物与CAR-T协同治疗CAR-T细胞免疫疗法是近年来发展迅速的过继性免疫疗法。它是一种新型的治疗方法,通过基因工程的手段使T细胞在其表面表达特定的CAR,然后将这些T细胞回输给肿瘤患者以杀死相应的肿瘤细胞。但与血液系统恶性肿瘤的疗效相比,CAR-T细胞免疫治疗对实体瘤的总体疗效并不显著。这归因于实体瘤的复杂生物学特性,使得CAR-T细胞的浸润、存活和持久性在实体瘤中面临众多挑战。血管和基质屏障、实体瘤的缺氧和高代谢、肿瘤微环境免疫抑制以及大量异质肿瘤细胞都与癌症进展和免疫逃逸密切相关[142]。
CAR-T细胞与RDC结合的可行性和有效性已在临床前研究和临床试验中得到证实。例如,RDC可诱导肿瘤血管功能正常化,通过增加肿瘤中趋化因子,如趋化因子配体9(CXC chemokine ligand 9,CXCL9)、CXCL10、CXCL11、CXCL16 的表达[143],增加T细胞活化相关的细胞因子如γ干扰素(interferon-γ,IFN-γ)水平使得CAR-T细胞浸润增加[144],或通过诱导免疫原性细胞死亡(immunogenic cell death,ICD)使得损伤相关分子模式(damage associated molecular patterns,DAMPs)蛋白释放,从而激活肿瘤靶向免疫反应[145]。研究认为,可以通过开发更具有亲和力靶向的配体平台,分别研发具有更加精准定位杀伤效果的RDC并进行CAR-T细胞的重定向,从而最大程度发挥二者优势,实现“1+1>2”的治疗效果[146]。
目前,CAR-T细胞免疫治疗和靶向放射性核素治疗的数学模型在多发性骨髓瘤临床前模型中已经设计完成[147],尽管基于CAR-T疗法的核素偶联药物仍在开发当中,但相信随着免疫肿瘤学的不断进步,这种协同治疗方法在未来几年会攻克更多的瓶颈并取得重大突破。
3 结语与展望
核素药物的研究在全球高速发展,截至2022年10月,全球已有超100种放射性药物获批上市,预计2030年全球核医学市场将达到240亿美元,治疗性核素药物占比将达到60%。其中美国放射性药物竞争格局相对分散,新药注册上市申请/仿制药注册上市申请(NDA/ANDA)文号分散于多个企业,截至2022年4月,美国FDA共批准52款放射性药物,其中放射性诊断药物约占全球放射性药品市场规模的90%,治疗用RDC的研发阶段尚集中在临床前研发和临床试验阶段。而中国放射性药物研制进展缓慢,临床使用的药物大部分为国外仿制药,国内从事放射性药物研制的企业整体面临技术性不强、产业规模不大的局面,每万人开展核医学检查数量仅为19人,仅为全球平均水平的30%左右。
PET/CT诊断作为临床上用以诊断和指导治疗肿瘤的最佳手段之一,是目前唯一用于细胞代谢、靶点显像的诊断技术,由此开发的诊断类核医学制剂为肿瘤细胞的定位追踪和对各类治疗手段的疗效可视化评估提供了工具。同时,核素偶联药物衍生的肿瘤细胞配对诊疗平台具有巨大的临床应用价值,为精准医学的实现提供了技术保障,但鉴于核素类药物物化性质、储存时间和生产储存设施的特殊性,以及需要具备专业资质的医师进行操作,其在临床转化过程中仍存在诸多挑战。
2021年6月国家原子能机构联合科技部、公安部、生态环境部、交通运输部、国家卫生健康委、国家医疗保障局、国家药品监督管理局等7部门正式发布我国首个针对核技术在医疗卫生应用领域发布的纲领性文件《医用同位素中长期发展规划(2021—2035年)》,充分肯定了核医学在重大疾病早期诊断、微小病灶的精准清除以及合理诊疗方面具有独特的作用,为我国的核医学下一阶段发展指明了方向。
在RDC等核医学制剂的研发过程中不仅需要在满足临床需求的基础上改进配体靶向性和核素的杀伤特异性,提高肿瘤诊断和治疗的精准率,同时需要结合自身的优势同细胞治疗协同应用,在实体瘤治疗上攻克难关,为我国更多难治性、复发性肿瘤患者提供福音。
