自然杀伤细胞免疫疗法的创新策略及研究进展
2023-02-22张华杜为邱录贵张宇
张华,杜为,邱录贵,张宇, 8 *
(1.协和干细胞基因工程有限公司,天津 300384;2.南开大学医学院,天津 300071;3.天津市血液细胞治疗技术企业重点实验室,天津 300384;4.国家干细胞工程产品产业化基地,天津 300384;5.天津市脐带血造血干细胞库,天津 300384;6.中国医学科学院北京协和医学院血液学研究所 血液病医院,天津 300020;7.实验血液学国家重点实验室,天津 300020;8.中源协和细胞基因工程股份有限公司,天津 300384)
近年来,迅速发展的新型肿瘤免疫疗法改变了临床肿瘤治疗的传统模式。在免疫治疗领域,单克隆抗体和工程化免疫细胞的研发和应用取得了重大进展。虽然用于血液恶性肿瘤自体治疗的靶向肿瘤抗原的嵌合抗原受体T细胞(chimeric antigen receptor T-cell,CAR-T)已取得显著效果,但CAR-T细胞治疗仍然面临许多挑战,包括高成本、长时间的制造过程,副作用和自体应用相关的问题。因此,人们逐渐将焦点转向基于自然杀伤(natural killer,NK)细胞的免疫疗法。NK细胞于20世纪70年代被发现,是一群不需要预先致敏即可产生细胞毒性和分泌细胞因子的先天淋巴细胞亚群,能够介导体内抗病毒和抗肿瘤反应。不同于T细胞和B细胞通过抗原受体识别“非我”抗原产生适应性免疫,NK细胞依赖于细胞表面的激活性和抑制性受体信号的整合,识别和攻击丢失或下调主要组织相容性复合体Ⅰ(major histocompatibility complex class I,MHC-Ⅰ)表达的肿瘤细胞,称为“缺失自我”识别机制[1]。重要的是,NK细胞可以通过多种机制杀伤靶细胞。另外,NK细胞还可以通过人免疫球蛋白G Fc段受体ⅢA(IgG Fc region receptorⅢA,FcγRⅢA,又称CD16)介导抗体依赖的细胞毒性(antibody-dependent cellular cytotoxicity,ADCC)效应[2]。在安全性方面,与T细胞不同,NK细胞表面缺乏T细胞受体(T cell receptors,TCRs),不会引起移植物抗宿主病(graft-versus-host disease,GVHD)[3]。这一特点使得NK细胞疗法不但可以自体输注,而且可以实现异体过继转移治疗。此外,NK细胞治疗产品的细胞来源也丰富多样,包括外周血(peripheral blood,PB)、脐带血、NK-92细胞系、胎盘和干细胞等。目前,这些体外活化和扩增的NK细胞治疗的安全性和临床有效性已在多个临床研究中得到证明[4]。NK细胞为一个有吸引力的免疫治疗产品,针对血液瘤或实体瘤的多个临床试验正在进行中[5]。随着NK细胞一系列体外扩增和基因修饰平台的成熟,NK细胞有望成为一种“货架型”的细胞治疗产品,可以提前大量制备、存储并按需用于多个患者。
虽然以NK细胞为基础的癌症免疫疗法具有诸多优势,但NK细胞的临床应用仍然面临一系列挑战。首先,尽管NK细胞临床安全性已得到充分验证,但临床治疗效果仍然有限。其次,输注后的NK细胞在体内存活时间短、持久性差也进一步限制了它的疗效。因此,目前的研究主要集中在增强NK细胞抗肿瘤活性的治疗策略。本文总结了NK细胞生物学知识、NK细胞来源以及体外制备情况,旨在为提高NK细胞疗效的过继治疗策略提供参考。
1 NK细胞生物学
1.1 NK细胞的定义、发育分化及体内分布
NK细胞是Ⅰ型先天淋巴细胞(group 1 innate lymphoid cells,ILC1s)的主要亚群,与Ⅱ型先天淋巴细胞(group 2 innate lymphoid cells,ILC2s)B细胞和Ⅲ型先天淋巴细胞(group 3 innate lymphoid cells,ILC3s)T细胞来自于同一淋巴祖细胞。NK细胞是一群不需要预先致敏就可以攻击病毒感染的和恶性转化的细胞,并分泌细胞因子干扰素γ(interferon gamma,IFN-γ)和肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)等。
人NK细胞起源于骨髓中的造血干细胞(hematopoietic stem cells,HSCs),首先由CD34+HSC分化为普通淋巴祖细胞(common lymphoid progenitors,CLPs),进一步分化为NK前体细胞(NK cell precursors,NKPs)[6]。NKPs上 CD122 的表达决定着NK细胞谱系的形成。CD56的出现标志着NKPs向NK细胞分化的完成。根据CD56的表达水平,NK细胞又可以分为CD56bright期和CD56dim期两个时期。CD56brightNK细胞是不完全成熟的,在获得CD16的表达后可以分化成CD56dimNK细胞[7]。虽然两个亚群都会产生细胞因子,但CD56dim亚群具有更强的细胞溶解活性[8]。在NK细胞发育成熟过程中,白细胞介素(interleukin,IL)-7、干细胞因子(stem cell factor,SCF)和FMS样酪氨酸激酶3配体(FMS-like tyrosine kinase 3 ligand,FLT3L)是HSCs产生CD122+NKP的关键因子,而IL-5对于NK细胞谱系的形成和CD122+NKPs分化为成熟NK细胞至关重要[9]。此外,NK细胞的发育也受一系列的转录因子的调节。转录因子E4启动子结合蛋白4(E4 promoter-binding protein 4,E4BP4)、胸腺细胞选择相关HMG盒蛋白(thymocyte selection-associated HMG box,TOX) 和 DNA 结合抑制剂 2(inhibitor of DNA binding 2,ID2)在NK细胞谱系中是必需的,而T细胞表达的T盒(T-box expressed in T cells,T-bet)、脱中胚蛋白(eomesodermin,Eomes)和锌指E盒结合同源盒2(zinc finger E-box-binding homeobox 2,ZEB2)为NK细胞成熟所必需[9]。
PB中NK细胞占淋巴细胞的5% ~ 15%,主要包含CD56brightCD16-和CD56dimCD16+两个亚群,其中CD56dimCD16+亚群占总循环NK细胞的90% ~95%[8-10]。CD56dimCD16+细胞不但对易感靶细胞具有高度的裂解作用,而且可以通过CD16的表达介导ADCC效应,同时,也可以分泌细胞因子。除此之外,NK细胞在其他大多数器官中也都存在。在淋巴结、扁桃体和肠道中的NK细胞在表型和功能上与PB中的NK细胞亚群不同,主要为细胞毒性较弱的CD56brightCD16-NK细胞,但是,骨髓、脾和肺中的NK细胞主要是细胞毒性较强的CD56dimCD16+NK细胞[11]。
1.2 NK细胞的激活和抑制受体
NK细胞的激活和抑制是由激活性和抑制性受体综合调节,这些整合的受体信号决定了相邻的细胞是否被杀伤。通常,人体中的健康细胞大多数表达MHC-Ⅰ,也被称为Ⅰ类HLAs。MHC-Ⅰ结合NK细胞表面的抑制性杀伤细胞免疫球蛋白样受体(killer cell immunoglobulin-like receptors,KIRs)以抑制NK细胞功能,减少对健康自身细胞的破坏。KIR基因具有多态性,不同基因在NK细胞上的随机表达形成多样化的KIRs库,因此,特定的NK细胞克隆表面至少有一种KIR可以与自身Ⅰ类HLA相互作用形成免疫耐受,这也是NK细胞成熟至有功能细胞的过程,称为“许可”[12-13]。反之,如果NK细胞不表达识别自身Ⅰ类HLA的任何一种KIR,则不具有功能活性[14]。然而,这种不具有功能活性的NK细胞在IL-2或IL-15等因子的刺激下也可以重新获得功能[12]。除此之外,C型凝集素家族成员NKG2A与CD94形成二聚体后可与非典型的MHC-Ⅰ中的HLA-E结合,是NK细胞表达的另一个主要抑制性受体[15]。尽管这些受体代表了NK细胞激活的主要检查点,仍然有一些对NK细胞毒性稳态调节起重要作用的受体,包括T细胞免疫球蛋白和ITIM结构域(T cell immunoglobulin and ITIM domain,TIGIT)、PVR相关的Ig域(PVR-related Ig domain,PVRIG)、淋巴细胞3激活基因(lymphocyte-3 activation gene,LAG3)、T细胞免疫球蛋白黏蛋白分子(T cell immunoglobulin and mucin domain containing-3,TIM3)、程序性死亡分子-1(programmed death-1,PD-1)和CD96。事实上,阻断以上这些抑制性受体与肿瘤上的配体的相互作用已成为NK细胞治疗的有效策略。
除了下调MHC分子,肿瘤细胞也会过表达某些配体以激活NK细胞受体。NK细胞上这些激活受体主要包括自然毒性受体(nature cytotoxicity receptors,NCRs)NKp30/NKp44/NKp46、CD16 和NKG2D等。CD16是NK细胞表面表达的最有效的激活受体。预先经过IgG抗体处理的靶细胞可以通过抗体的Fc区与CD16分子连接,从而激活NK细胞,执行杀伤功能,这一机制被称为抗体依赖的细胞介导的细胞毒作用“ADCC”效应[2]。NKp30、NKp44和NKp46通过识别并直接结合到肿瘤或压力胁迫细胞的配体上,从而诱导NK细胞激活,启动细胞杀伤和细胞因子分泌。肿瘤和病毒感染细胞上的MICA、MICB和ULBP家族配体与NKG2D结合可激活NK细胞的活性[16]。目前,这些激活受体作为治疗靶点被广泛研究,这对于NK细胞功能的提升具有重要意义。
1.3 NK细胞的功能及作用机制
NK细胞的功能包括脱颗粒、细胞因子释放和细胞毒性,受激活受体和抑制受体信号的整合控制。在机体中,NK细胞可以通过“缺失自我”的机制杀伤靶细胞。通常情况下,表达MHC-Ⅰ的正常健康细胞与NK细胞抑制受体形成“免疫耐受”,而低表达或不表达MHC-Ⅰ的细胞则被NK细胞识别并裂解[1]。NK细胞不但可以通过胞吐作用释放穿孔素和颗粒酶等毒性颗粒直接裂解靶细胞,通过活化NK细胞表达FASL/TRAIL,从而诱导细胞凋亡,还可以通过合成和分泌IFN-γ、TNF-α和趋化因子等招募其他免疫细胞产生二次免疫反应[17-18]。NK细胞介导的肿瘤杀伤的另外一个关键机制是ADCC。ADCC可触发NK细胞的脱颗粒反应来杀伤抗体包被的靶细胞,对这一机制的利用临床上主要体现在NK细胞与肿瘤特异性治疗单克隆抗体的联用。
2 制备临床级NK细胞
2.1 NK细胞的来源
NK细胞产品开发过程中面临的首要挑战是获得足量的可用于临床治疗的细胞,而NK细胞起始材料的选择可以在一定程度上解决这个问题。目前用于制造临床级NK细胞产品的细胞来源包括NK细胞系、外周血NK细胞(peripheral blood NK cell,PB-NK)、脐带血NK细胞(umbilical cord blood NK cell,UC-NK)、干细胞来源NK细胞和胎盘来源NK细胞(见表1)。

表1 NK细胞来源的总结和比较Table 1 Comparison of different sources of NK cells
2.1.1 NK细胞系NK细胞系具有无限增殖能力,是被用于临床试验较早的NK细胞。目前,已经建立的NK细胞系包括NK-92、YT、NKL、SNK-6、KHYG-1、NK-YS、NKG和IMC-1等。其中,NK-92细胞系表现出易于扩增培养以及输注后对白血病细胞具有持续的细胞毒性的优点。NK-92也是美国FDA批准用于Ⅰ期和Ⅱ期临床试验的唯一细胞系。NK-92细胞系来源于快速进展的非霍奇金淋巴瘤患者,可以通过添加IL-2在良好生产规范(good manufacturing practice,GMP)条件下大量扩增,同时可以低温保存且解冻后细胞功能恢复良好[19-20]。但是,NK-92不表达CD16受体,无法进行ADCC应答[21]。此外,由于此细胞系来源于肿瘤患者,需要在输注前辐照以消除恶性转化和伴随的染色体异常风险,这降低了NK-92细胞体内增殖活性和持久性。
2.1.2 外周血来源NK细胞在PB中的NK细胞仅占淋巴细胞的5% ~ 15%,主要为CD3-CD56dimNK细胞亚群,可以相对容易地从患者本身或健康供体中分离出来,是NK细胞疗法临床前研究应用最多的细胞来源。然而,癌症患者的自体NK细胞不但会被自身MHC所沉默,而且NK细胞功能往往受到疾病或治疗的损害。因此,异基因PB-NK通常是免疫治疗的首选,但是为了防止GVHD的发生需要严格控制T淋巴细胞的含量。此外,PB-NK细胞功能活性较强,也是过继CAR-NK细胞生产极好的种子细胞来源。但是,PB-NK细胞在低温保存后细胞毒性降低,虽然这种功能损失可以通过细胞因子激活和扩增得到部分恢复,但这也使得PB-NK细胞不是“现货”治疗的最佳选择。
2.1.3 脐带血来源NK细胞与PB-NK细胞不同,UC中的NK细胞仅占TNCs的5%,却为过继免疫治疗提供了独特的同种异体反应优势,提高了NK细胞广泛应用于临床的潜能。尽管在脐带血中幼稚性NK细胞比例较高,但大多数UC-NK经过细胞因子刺激扩增后能够分化为功能成熟的NK细胞。值得关注的是,越来越多研究已经转向采用UC-NK细胞来产生临床前或临床试验的NK/CAR-NK细胞。例如,MD安德森癌症研究中心进行的首个人体Ⅰ/Ⅱ期临床研究证明,UC来源的CAR-NK细胞治疗复发和难治性CD19+B细胞淋巴瘤有效性及安全性均较为满意[5]。然而,获得足够的用于临床的NK细胞仍然是一个挑战。尽管有一些扩增平台利用一份脐带血可制备出上百剂的NK细胞,但是进行大规模NK细胞扩增的产量仍然受限。
2.1.4 干细胞来源NK细胞目前,研究中用于NK细胞生产的干细胞主要包括CD34+HSC、人胚胎干 细 胞(human embryo stem cells,hESCs) 和 人诱导多能干细胞(human induced pluripotent stem cells,hiPSCs)。早期的研究已经表明,由CD34+HSC可以分化为成熟的NK细胞。Glycostem公司的oNKord®即是脐带血CD34+HSC分化而来。事实上,hESCs或hiPSCs产生成熟的NK细胞过程中一个很重要的节点是产生CD34+细胞。近几年的大量研究已经证实,由hESCs或hiPSCs产生NK细胞具有可行性。不同于PB-NK和UC-NK细胞在数量、体外增殖、异质性及冻融敏感的局限性,干细胞来源尤其是hiPSC来源的NK细胞是从主细胞库经标准化扩增而来,可以产生大量均质化、质量可控且能够长期冷冻保存的NK/CAR-NK细胞产品。因此,干细胞衍生的NK/CAR-NK细胞是开发标准化的治疗产品的一个有吸引力的替代方案。鉴于hiPSC-NK产品的治疗潜力,FDA已经批准了Fate Therapeutics公司hiPSC-NK产品FT500的Ⅰ期临床试验(NCT03841110),而FT500也是美国FDA批准的首个iPSC衍生细胞产品的临床研究,主要用于治疗晚期实体肿瘤。
2.1.5 胎盘来源NK细胞胎盘具有的独特免疫生物学特性使其成为同种异体移植种子细胞的优质来源。胎盘来源的NK细胞主要包括胎盘NK细胞(placenta-derived natural killer cells,pNKs) 和胎盘CD34+HSC分化的NK细胞。pNKs一般是指从供者配型和足月的胎盘组织中分离制备的一群CD56+CD3-NK细胞。胎盘CD34+HSC与上述干细胞来源的NK细胞类似,可以在细胞因子诱导刺激下分化为成熟NK细胞。前期研究表明,体外扩增的pNKs与增加的NKG2D、NKp44和NKp46激活受体表达一致,表现出明显增强的抗肿瘤活性[22]。与PB-NK细胞相比,pNKs表现出独特的微RNA(microRNA,miRNA)表达谱、免疫表型和更强的体外抗肿瘤能力[22]。CYNK-001是Celularity公司的一款胎盘造血干细胞来源的“即用型”NK细胞疗法,需冷冻保存,具有同种异体、未经基因编辑修饰的特点。CYNK-001已获得FDA授予治疗恶性神经胶质瘤的孤儿药资格,以及治疗多形性胶质母细胞瘤(glioblastoma multiforme,GBM)和急性髓系淋巴瘤(acute myeloid lymphoma,AML)的快速通道资格。目前,该产品正用于治疗多发性骨髓瘤(multiple myeloma,MM)(NCT04309084)、AML(NCT04310592)、GBM(NCT04489420)以及新型冠状病毒感染(corona virus disease 2019,COVID-19)(NCT04365101)的多种适应证临床研究中。
2.2 NK细胞扩增平台
NK细胞过继免疫疗法是一种很有前景的癌症治疗方法,但存在的挑战也限制了其可用性及临床有效性。其中,主要的困难是缺乏临床级的生产平台来支持高活性NK细胞的大规模扩增。目前NK细胞的扩增方法包括基于饲养细胞、基于质膜颗粒及无饲养细胞的扩增方法。
2.2.1 基于饲养细胞饲养细胞分泌大量细胞因子,可以为NK细胞提供微环境并促进细胞增殖和活化。用自体细胞或灭活的饲养细胞体外共培养NK细胞是NK细胞扩增和活化的极好策略。目前,改造的K562是NK细胞扩增应用最广泛的饲养细胞。与表达膜结合IL-15 (membrane bound IL-15,mb15)和 4-1BB配 体 (4-1BB ligand,41BBL)的 K562细胞(K562-mb15-41BBL)共培养2周左右可使NK细胞扩增数百倍,但扩增出的NK细胞是端粒酶缩短且衰老的细胞[23]。此外,ADAM17的蛋白切割活性可使IL-15激活的NK细胞失去CD16分子,削弱NK细胞的ADCC效应[24]。相比之下,K562细胞表达膜结合IL-21 (membrane bound IL-21,mb21)而不是mb15,显著促进了NK细胞的扩增,而不会引起NK细胞的衰老[23]。K562-mb21-41BBL使NK细胞在3周内平均扩增48 000倍且细胞纯度高于85%[23]。虽然以上2种饲养细胞扩增的NK细胞均已被应用于临床试验研究中,但K562肿瘤细胞系的使用仍然存在临床安全性风险。因此,辐照的外周血单个核细胞(peripheral blood mononuclear cell,PBMC)、Epstein-Barr病毒淋巴母细胞系(Epstein-Barr virus-transferred lymphoblastoid cell lines,EBV-LCLs)和骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)也常作为饲养细胞被用于NK细胞的扩增。
2.2.2 基于质膜颗粒肿瘤细胞系的膜颗粒可以有效替代肿瘤细胞系用于NK细胞扩增。目前,应用的质膜颗粒主要来源于K562-mb15-41BBL和K562-mb21-41BBL细胞,是在无菌条件下经裂解液和液氮裂解,梯度离心和蔗糖密度梯度离心纯化得到[25]。与K562-mb15-41BBL质膜颗粒(PM15颗粒)相比,K562-mb21-41BBL质膜颗粒(PM21颗粒)的NK细胞扩增效率和细胞纯度均较高[26]。此外,PM21颗粒刺激的NK细胞在28 d内呈指数增长,而PM15颗粒刺激的NK细胞在培养第22天就因衰老而停止增长[26]。相较于基于饲养细胞的方法,基于质膜颗粒的方法除了具有与饲养细胞相当的增殖能力,它们还可以提前制备和储存,并作为“现成的试剂”使用,大大简化了NK细胞的制备过程。此外,最终的NK细胞产品也不存在饲养细胞残留及体内增殖的问题,降低了饲养细胞可能导致的临床安全风险,更适合过继NK细胞治疗产品的生产。
2.2.3 无饲养细胞的NK细胞扩增虽然以饲养细胞为基础的扩增系统具有良好的体外NK细胞扩增特性,无饲养细胞的扩增方法更符合GMP的流程,并可能更容易获得治疗药品的许可。目前,被用来激活和扩增NK细胞的主要细胞因子包括IL-2、IL-12、IL-15、IL-18和IL-21。细胞因子的组合直接影响NK细胞的成熟、增殖、存活,NK细胞亚群的分布、激活,以及细胞因子分泌和细胞毒性功能。IL-2和IL-15是研究最广泛的NK细胞激活剂,两者都可以增强抗肿瘤反应,在体外联用时,对NK细胞的刺激具有叠加作用;当IL-2和IL-12联合使用时,IL-2和IL-12在体外协同增强NK细胞的细胞毒性;IL-15/IL-18/IL-27介导的NK细胞激活,与IL-2、IL-15和IL-15/IL-18单独或者组合相比,NK细胞增殖、细胞毒性和IFN-γ分泌效果更好[27]。此外,NK细胞与IL-12、IL-15和IL-18的联合,可产生细胞因子诱导的记忆样(cytokine induced memory-like,CIMK)NK细胞[28]。CIMK NK细胞是一种长寿命的NK细胞,当被再次激活时表现出增强的功能,产生更多的 IFN-γ[29]。
2.3 NK细胞规模化扩增系统
传统的培养瓶和培养袋培养的NK细胞数量已无法满足NK细胞过继免疫治疗的临床应用需求。另外,传统的NK细胞扩增操作过程需要频繁的补充新鲜培养基、细胞因子和生长因子等NK细胞生长所需营养物质,无疑增加了细胞污染的风险。G-Rex和生物反应器的应用实现了在封闭的系统中大规模扩增NK细胞的需求,以XuriTMW25(GE Healthcare)为代表的波浪式生物反应器可实现0.3 ~25 L体系高密度NK细胞的扩增,其上游设备C-Pro全自动封闭式细胞处理设备可进行单个核细胞的分离和清洗,而其下游设备SefiaTMS-2000细胞处理仪可将最终扩增的NK细胞进行浓缩、洗涤及分装,最后经过程序降温设备实现“现货型”临床级NK细胞产品的全封闭制备流程。此外,国内外越来越多的NK细胞扩增系统进入市场,推进了NK细胞标准化制备和NK细胞免疫治疗产品上市的进程。
3 NK细胞治疗的创新策略
随着近期CAR-NK和细胞因子刺激NK细胞疗法的成功,基于NK细胞的过继转移疗法已经成熟。目前国内外大部分的NK/CAR-NK细胞疗法尚处于Ⅰ期或Ⅱ期临床研究,早期研究结果显示出良好的抗肿瘤活性和体内安全性。基于NK细胞的过继转移疗法具有诸多优势,但也面临着挑战。其中最重要的挑战之一就是NK细胞体内存活时间短、功能活性差。为此,大量的研究以此为研究目标进行探索,也开发出一系列解决策略(见图1)。
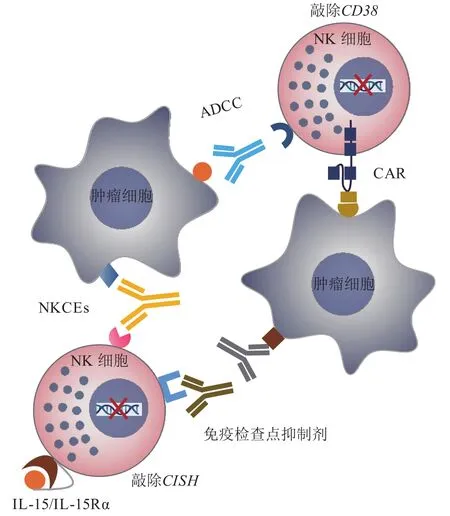
图1 NK细胞免疫疗法的策略Figure 1 Different strategies for NK cell immunotherapy
3.1 IL-15信号途径
IL-15是免疫突触中的关键细胞因子,促进CD8+T细胞和NK细胞的发育和存活。在NK细胞体外扩增中,IL-15也成为影响细胞增殖和细胞毒性的重要因子。因此,研究者开发出各种各样激活IL-15信号通路的方法来提高NK细胞的功能。Imamura等[30]研究表明,在人PB-NK细胞中只需表达一种膜结合形式的IL-15而不需要添加其他细胞因子就能够提高NK细胞在体外和体内的存活和增殖能力,进而增强对恶性血液瘤和实体瘤的杀伤活性。一种由重组IL-15(recombinant IL-15,rIL-15)或IL-15超级激动剂N-803和IL-15Rα融合而成的复合体可以在肿瘤免疫抑制微环境中维持NK细胞的增殖和持久性[31]。此外,IL-15信号调节因子也成为一个增强NK细胞功能的靶点。因子诱 导SH2蛋 白(cytokine-inducible SH2-containing protein,CIS)是NK细胞IL-15信号传导的抑制剂。NK细胞响应IL-15信号表达CIS,而编码CIS的基因CISH的缺失,能够增强NK细胞对IL-15的反应,从而增强NK细胞的生存、增殖和效应功能[32-33]。用CRISPR/Cas9编辑技术敲除iPSC细胞中的CISH基因,此iPSC细胞衍生的NK细胞的体内持久性和抗肿瘤活性得到了有效提高[34]。类似的研究也表明,在PB-NK和UC-NK细胞中敲除CISH也可以提高其抗肿瘤活性[35]。
体外细胞因子诱导培养的NK细胞输入体内后会导致其持久性下降,因此,NK细胞治疗临床研究常用的方案是将NK细胞与IL-15共同输注以维持NK细胞的体内存活和增殖,但是这也导致了恶化的免疫反应等安全性问题。通过基因工程修饰NK细胞,使IL-15信号途径持续激活,能够维持NK细胞的体内持久性和杀伤效力。然而,输注的NK细胞在体内长期存活也可能具有潜在的安全性问题,需要长期的药物代谢临床研究来证实。
3.2 CD16A介导的ADCC途径
由人NK细胞上的CD16A受体介导的ADCC是NK细胞一种重要的效应机制。激活的NK细胞表面CD16A会被ADAM17蛋白酶切割并从膜上脱落,导致NK细胞失去ADCC的能力,这也是NK细胞毒性丧失的一个原因[36]。为了解决这个问题,Jing等[37]将突变的CD16A受体(CD16A/S197P)转入iPSC,阻止了定点突变的CD16A受体被ADAM17切割。为了获得更好的效果,结合CRISPR/Cas9编辑技术敲除ADAM17基因的研究也在进行中。NantKwest公司的高亲和力变体(high affinity NK,haNK)来源于专有的NK-92主细胞库,经基因工程改造表达CD16A受体的haNK可促进癌细胞有效清除[21]。haNK与ImmunityBio公司的IL-15超级激动剂复合物N-803联合疗法在难治性/转移性默克尔细胞癌患者的Ⅱ期临床试验的总体缓解率为29%,且具有良好的耐受性和安全性(NCT03853317)(见表2)。非切割和高亲和性双重修饰CD16A(hnCD16)的人iPSC-NK细胞能够更有效地靶向更多的肿瘤类型[38]。Fate Therapeutics公司的FT516 hnCD16-iNK细胞功能成熟,对多种肿瘤靶点表现出增强的ADCC效应。人B细胞淋巴瘤体内研究表明,使用hnCD16-iNK细胞联合抗CD20单克隆抗体治疗可以显著促进B细胞淋巴瘤的消退[38](见表2)。已获得FDA批准的FT538在FT516 CD16A修饰基础上增加IL-15受体融合蛋白以增强体内存活和持久性,同时敲除CD38以消除抗CD38抗体介导的NK细胞自相残杀[39](见表2)。目前,FT538处于多中心、多剂量的Ⅰ期临床试验中,用于治疗复发/难治性急性髓系淋巴瘤和MM患者(NCT04714372)(见表2)。
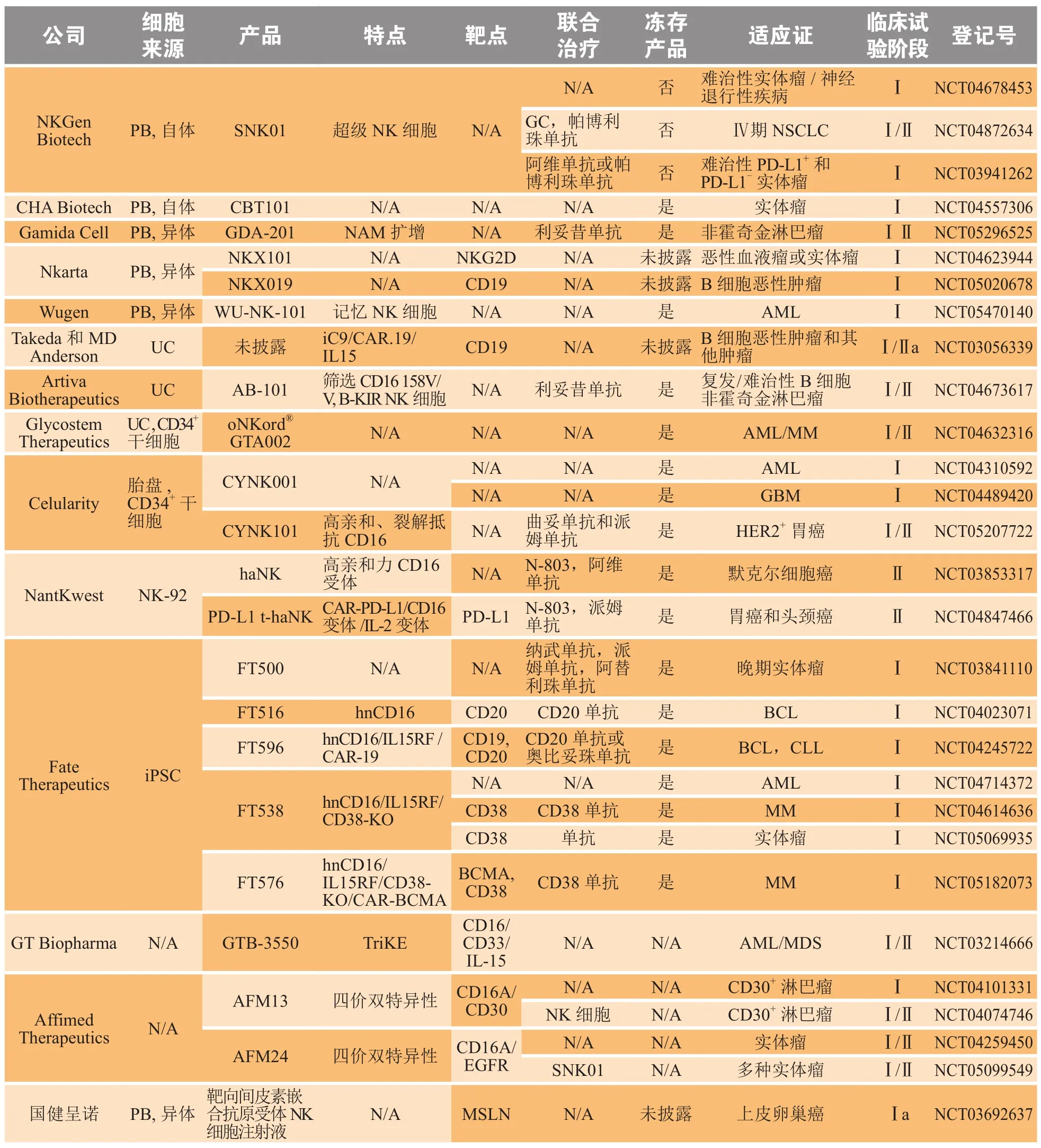
表2 处于临床试验阶段的NK细胞产品Table 2 NK cell products under clinical trial
鉴于CD16A脱落是NK从靶细胞脱离并进行下一个靶细胞杀伤的调节机制,通过对CD16A的改造以阻断其在NK细胞表面脱落的策略虽然可以极大地提高NK细胞的毒性,但是却降低了NK细胞在有限生命内的杀伤效率[40-41]。因此,在临床应用时可能需要输注更多的NK细胞数量。此外,NK细胞持续作用于靶细胞也可分泌大量细胞因子,可能会引起细胞因子释放综合征(cytokine release syndrome,CRS)等副作用。增加CD16A受体表达或提高脱落后CD16A受体的再利用的策略或许可以成为增强NK细胞ADCC效应更有效的替代方法。
3.3 CAR-NK细胞
截至2022年11月,Kymriah、Yescarta、Tecartus、Breyanzi、奕凯达、倍诺达、Abecma和CARVYKTI共8款CAR-T细胞治疗产品获批上市,彻底革新了癌症免疫治疗领域。同样的,CAR的加载也成为增强NK细胞功能的另一条重要途径。截至2022年7月,Clinical Trials.gov.网站显示已有超过20个临床试验正在进行CAR-NK治疗各种血液瘤和实体瘤的研究。一项应用脐带血CAR-NK细胞治疗复发或难治性CD19+非霍奇金淋巴瘤和慢性淋巴细胞白血病的临床试验结果显示,11例患者中有7例患者获得完全缓解而没有出现CRS或ICANS[5]。Nkarta Therapeutics最近公布的NKX101(靶向NKG2D)和NKX019(靶向CD19)治疗血液瘤的最新临床数据显示,NKX101输注高剂量CAR-NK治疗AML呈现良好应答,5例受试者中3例完全缓解,其中2例是微小残留病灶阴性(NCT04623944;Nkarta Therapeutic公布的临床数据)(见表2)。NKX019的6例可评估患者中的5例达到客观缓解,3例完全缓解(NCT05020678;Nkarta Therapeutic公布的临床数据)。两项试验中均未发现剂量限制毒性以及与CAR-T疗法副作用相似的不良事件(Nkarta Therapeutic公布的临床数据)。
2021年11月11日,国家药品监督管理局药品审评中心审批通过了由国健呈诺生物科技(北京)有限公司研发的、针对晚期上皮性卵巢癌治疗的靶向间皮素(mesothelin,MSLN)嵌合抗原受体NK细胞(CAR-NK)注射液的临床试验申请(见表2)。该产品是由国家药品监督管理局药品审评中心正式审批通过的国内首例“现货型”异体来源的CARNK产品,标志着中国免疫细胞药物治疗实体瘤研究迈入新的里程碑。
CAR-NK是通过基因工程手段修饰使其表达CAR,将识别靶细胞表面抗原的抗体与激活免疫细胞所需要的信号分子连接,可以突破抑制性受体的限制而激活NK细胞,以此增强NK细胞对靶细胞的特异性杀伤。然而,基于CAR方法的检测能力仅限于表面蛋白质。虽然可以通过改造NK细胞表达TCR来检测细胞内抗原,但是NK细胞没有配备T细胞中的完整信号机制,从而潜在地降低了通过合成TCR来有效激活NK细胞的能力。此外,传统上为T细胞设计的CAR多被用于CAR-NK细胞的产生。由于T细胞和NK细胞激活及作用机制方面的巨大差异,产生的CAR-NK细胞可能并未达到最好的临床疗效,因此,针对NK细胞的特异性CAR结构尤其是激活或共激活信号分子的选择值得进一步研究。
3.4 免疫检查点抑制剂
肿瘤细胞利用NK细胞抑制受体进行免疫逃逸的免疫检查点抑制已被证明是一种有效的治疗方法。NK细胞表面KIR类的抑制性受体可与MHC-Ⅰ类分子结合,抑制NK细胞活化。KIR抑制性受体的这一特点使其成为NK细胞免疫检查点抑制剂的首选靶标。IPH2101是针对KIR2DL1/2/3 NK细胞抑制受体的IgG4单克隆抗体,可作为单一疗法或与其他药物联合使用。在前期研究中,IPH2101已用于各种恶性血液瘤或实体肿瘤的临床评估[42]。然而,IPH2101治疗MM的单一疗法效果并不明显[42]。临床前研究表明,IPH2101与来那度胺联用可增强NK细胞的功能而不发生自身免疫[43]。总的来说,尽管IPH2101不能作为单一的药物用于肿瘤治疗,但组合疗法仍值得进一步研究。
NKG2A/CD94是C型凝集素家族的异二聚体抑制性受体,它可识别非经典MHC-Ⅰ分子HLA-E作为配体[15]。HLA-E在肺、胰腺、胃、结肠和肝等多种器官肿瘤中表达,与NKG2A结合可抑制NK细胞的效应功能[44]。IPH2201是NKG2A的一种免疫检查点抑制抗体。IPH2201在体外显示出增强NK细胞功能的良好效果,且在一些肿瘤患者体内试验中观察到良好的耐受性[45]。与IPH2101类似,IPH2201的单一疗法效果依然有限。
除了MHC-Ⅰ相关的抑制受体,还有其他一些受体涉及NK细胞的抑制性免疫检查点,包括经典的细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4) 和 PD-1受体以及TIGIT、淋巴细胞活化基因3(lymphocyteactivation gene 3,LAG-3)和T淋巴细胞免疫球蛋白黏蛋白3(T cell immunoglobulin domain and mucindomain-3,TIM-3)。在T细胞中,针对PD-1或CTLA-4的免疫检查点阻断克服了T细胞的衰竭,重建了T细胞的抗肿瘤能力[46]。尽管PD-1阻断对NK细胞的直接影响不如对T细胞明显,但临床前研究表明,它可以增强ADCC介导的抗肿瘤功能[47]。目前,虽然CTLA-4阻断的研究通常是在T细胞的背景下,但也有一些研究表明NK细胞可以增强CTLA-4单抗治疗黑色素瘤的效果[48]。TIGIT、LAG-3和TIM-3在NK细胞中的研究较少。靶向TIGIT、LAG-3和TIM-3的阻断抗体已在T细胞中得到研究,有待进一步在NK细胞中进行验证。
因为NK细胞的功能反应是由激活受体和抑制受体信号的整合决定,用抑制剂阻断抑制信号能够显著增强肿瘤患者NK细胞的抗肿瘤反应。然而,在使用KIR和NKG2A抗体阻断疗法时应谨慎,因为有可能会破坏NK细胞的功能反应性[42]。另外,长期使用免疫检查点抑制剂进行治疗可能无效,需要短期或多次注射以增强NK细胞的反应。此外,T细胞也表达CTLA-4、PD-1、TIGIT、LAG-3和TIM-3等受体,临床试验中很难区分抑制剂是否是作用于NK细胞产生的疗效。
3.5 NK细胞衔接器
为了加强NK细胞与肿瘤细胞之间的相互作用并促进NK细胞持续的抗肿瘤效应,研究者们开发出了一种被称为NKCEs的新型多功能抗体。NKCEs可以将NK细胞引导到肿瘤部位,通过结合肿瘤细胞上的目标抗原同时触发NK细胞上的激活受体来引发强烈的抗肿瘤反应。NKCEs的开发策略包括双特异性或三特异性设计,靶向肿瘤上的一种或多种抗原,或通过交联细胞因子部分,促进NK细胞增殖和存活,旨在增强NK细胞的抗肿瘤作用。各个研究平台已针对NK细胞表面表达的CD16A、NKG2D和NKp46等激活受体开发出不同的NKCEs,以增强NK细胞的临床效果。
目前,靶向NK细胞CD16A的NKCEs研究较多且进展最快。其中,以Affimed公司开发的AFM13为代表,这款CD16A双特异性抗体的靶点是B和T细胞淋巴瘤的表面抗原CD30[49]。AFM13正处于治疗多种实体瘤和恶性血液瘤的Ⅰ期或Ⅱ期临床研究中(NCT02321592、NCT03192202、NCT01221571、NCT04101331、NCT02665650和NCT04074746)(见表2)。除了单一疗法,AFM13与MD安德森癌症中心提供的脐带血来源的NK细胞联用治疗霍奇金和非霍奇金淋巴瘤患者的Ⅰ/Ⅱ期临床试验结果显示,13例接受Ⅱ期推荐剂量治疗的患者达到100%的客观缓解率,且接受两轮治疗后完全缓解率达到62%(AACR公布的结果)(见表2)。与AFM13类似的AFM24是另一种靶向表皮生长因子受体(epidermal growth factor receptor,EGFR)的双特异性药物,目前正处于治疗转移性结直肠癌和非小细胞肺癌的Ⅰ/Ⅱ期临床试(NCT04259450)(见表2)。对于三特异性平台,GT Biopharma公司通过对BiKE双特异抗体平台升级改造建立的TriKE平台,引入了IL-15融合蛋白,赋予NK细胞靶向性的同时,增强了NK细胞的肿瘤杀伤作用[50]。目前,该平台GTB-3550(CD16AIL-15/CD33)已经进入临床试验阶段(NCT03214666)(见表2)。
NK细胞的另一种激活受体NKG2D也可以在感染和肿瘤发生时激活NK细胞的杀伤活性。目前已经有多个公司布局靶向NKG2D的NKCEs研究。Dragonfly Therapeutics公司核心技术平台为TriNKET,其中在此平台开发的DF1001(NKG2DHER2)与其他药物联用治疗实体肿瘤已处于Ⅰ/Ⅱ期临床研究阶段(NCT04143711)。Dragonfly的另一个三特异性抗体DF7001的靶点是5T4,这是一种在癌细胞和基质细胞上表达的蛋白质,支持与多种癌症预后不良相关的肿瘤生长。另外,Xencor公司利用其XmAb平台同样构建了靶向NKG2D的双特异性抗体,其B7-H3-NKG2D处于临床前研究阶段。
基于NKp46的双特异性抗体的开发尚处于早期研究阶段。国际上主要是Cytovia(CYT-303和CYT308) 和 Innate Pharma(IPH6101 和 IPH21)2个公司在开发相应的抗体。IPH6101已获得美国FDA批准进入临床试验。同时,Innate Pharma在NKCE3的基础上融合了IL-2v构建的NKCE4平台,能够更好地激活并维持NK细胞的增殖。
NKCEs是通过靶向肿瘤上的一个或多个抗原或通过交叉连接细胞因子来增强NK细胞抗肿瘤效果的策略[51]。相对于CAR-NK细胞的CAR加载,NKCEs无需基因编辑而能够达到类似CAR的功能,因此制备工艺相对简单且成本较低。此外,由于NKCEs只有在肿瘤细胞存在时才会被激活,所以临床应用的安全性较高且非特异性细胞因子释放的风险较低。然而,NKCEs疗法下的长期刺激可能导致NK细胞衰竭。通过设计间断注射NKCEs的临床方案避免NK细胞的持续激活或许可以解决这个问题。
4 结语与展望
随着人们对免疫细胞生物学基础知识体系的不断完善,细胞免疫疗法的时代已经到来。相较于CAR-T细胞自体疗法的种种局限性,基于NK细胞疗法的优势日益凸显。NK细胞的来源丰富,无论是基于饲养细胞的NK细胞扩增方法,还是基于细胞因子的方法均能获得大量的高活性的NK细胞。hPSC-NK细胞制备技术的成熟以及规模化扩增平台的建立也使得规模化制备质量均一的GMP级NK细胞免疫治疗产品成为可能。然而,NK细胞扩增的过程涉及到癌症免疫疗法的剂量、安全性、有效性和成本,这些研究是过继治疗临床规模应用的基础。
日益发展的基因编辑技术提供了优化NK细胞治疗的可能,通过引入CAR、靶向激活受体和敲除抑制性分子等修饰可增强NK细胞治疗效果。然而,PB-NK、UC-NK和胎盘源NK等天然NK细胞的基因工程存在基因转导困难、细胞编辑效率低、编辑后细胞存活率低等一系列问题。虽然iPSC衍生的NK细胞可能从根本上解决基因编辑的问题,但其衍生的NK细胞与体内发育的NK细胞生物学的差异、临床有效性和安全性仍然需要长期临床研究验证。随着过继细胞免疫疗法的发展,目的基因的递送技术也取得重大突破。目前,除了广泛使用的慢病毒或者γ-逆转录病毒等病毒载体递送方式,睡美人和PiggyBac转座子系统、CRISPR/Cas9、mRNA和纳米载体等非病毒载体技术也是克服基因转导障碍的新型解决方案。虽然NK细胞在治疗恶性血液病方面取得良好的临床疗效,但对于实体瘤的治疗效果有限,基于编辑的策略抑制肿瘤免疫微环境、增强NK细胞在肿瘤微环境中的活性也是治疗实体瘤的有效策略。大量的临床前和临床研究已表明基于NK细胞、细胞因子拮抗剂、免疫检查点抑制剂、单克隆抗体以及双特异性或多特异性抗体的单一疗法临床效果有限。因此,结合两种或两种以上的联合疗法可能是基于NK细胞免疫疗法发展的必然趋势。总之,基于NK细胞的免疫疗法已经成为一种成熟的、不断发展的癌症免疫疗法,在治疗多种癌症方面有着巨大的潜力。
