血管紧张素Ⅱ1型受体A1166C基因多态性与中国人原发性高血压相关性的Meta分析
2023-02-21朱倩寅沐婷玉陈灵杉沈翠珍
朱倩寅 沐婷玉 陈灵杉 沈翠珍
原发性高血压是一类严重危害人类健康的重大疾病[1]。我国高血压患病人数达2.45亿[2],且不断攀升。在1990年至2019年期间,我国男性高血压流行率上升幅度位居世界第五[3]。然而高血压可防可控[4],目前认为高血压是遗传和环境危险因素共同介导所致的多基因遗传性疾病[5]。肾素-血管紧张素系统(reninangiotensin system,RAS)是高血压发病的机制之一[6],其主要组成部分血管紧张素Ⅱ通过血管紧张素Ⅱ1型受体(AT1R)发挥升压作用[7]。AT1R基因位于3号染色体(3g21-25)的长臂上,该基因约有20多个已被发现的单核苷酸多态性(SNP),其中研究最多的是A1166C(rs5186 A>C)。受种族、民族、地区影响,AT1R A1166C基因多态性与中国人群高血压的关系仍存在着争议[8-9]。本文探讨AT1R A1166C基因多态性与中国人原发性高血压的相关性。
1 资料与方法
1.1 文献的纳入和排除标准 (1)纳入标准:①研究对象为无血缘关系的中国人;②研究类型为病例对照试验;③对高血压有明确的诊断标准:收缩压≥140 mmHg和/或舒张压≥90 mmHg(1 mmHg=0.133 kPa),研究对象为原发性高血压且未合并糖尿病、心肌梗死、脑血管意外或其他严重疾病;④研究内容为AT1R A1166C基因多态性,并详细报告病例组和对照组的基因型数据;⑤中英文文献。(2)排除标准:①基因型频率及等位基因频率偏离Hardy-Weinberg遗传平衡规律(HWE);②研究的样本量较小,并与其他文章中的样本量重叠;③只有摘要或无法获得全文。
1.2 文献来源 对PubMed、Web of science(WOS)、Embase、Cochrane Library、中国知网(CNKI)、万方数据库、中国生物医学文献数据库(SinoMed)进行系统检索,并查看纳入文献的参考文献,以防遗漏相关研究。
1.3 检索策略 使用主题词(MeSH)、自由词以及布尔逻辑运算符“OR”“AND”相结合进行文献检索。中文检索词包括:“血管紧张素Ⅱ1型受体,AT1,AT1R,AGT1R”“高血压”“基因多态性,基因多型性”。英文检索词包括:“receptor,angiotensin,type 1/angiotensin II type 1 receptor/receptor,angiotensin II type 1/angiotensin AT1 receptor/AT1 receptor,angiotensin/receptor,angiotensin AT1/angiotensin type 1 receptor/type 1 angiotensin receptor/AT1R”“polymorphism,genetic/genetic polymorphism/gene polymorphism/polymorphism,gene/polymorphisms/SNP”“hypertension”。
1.4 文献筛选 将7个数据库中检索到的所有文献导入EndNoteX9软件中,并使用该软件剔除重复文献。其次,两名研究者独立地阅读文献的标题和摘要,剔除明显不相关的文献。最后,根据纳排标准进一步对全文进行评价和分析,最终纳入符合要求的文献。
1.5 资料提取 两名研究者根据事先制定好的表格独立进行数据收集并相互核对,如遇疑问,通过咨询第三位研究者予以解决。具体提取内容如下:第一作者的姓名,发表年份,研究对象所在地区,研究对象的民族,基因检测方法,病例组和对照组的一般资料,病例组和对照组基因型、等位基因数量,是否符合HWE。
1.6 文献质量评价 由两名研究者使用Newcastle-Ottawa文献质量评价量表(NOS)对所有纳入的文献进行独立评价。该量表共3大内容,包括研究对象的选择、组间可比性、暴露因素的测量。评价者需对每项内容做出判断并打分,病例对照研究总分最高为9分。评价过程中若2名研究者产生分歧,则通过第3名研究者以达成统一意见。
1.7 统计学方法 采用RevMan5.3软件。通过计算比值比(OR)和95%置信区间(95%CI)评估AT1R A1166C基因多态性与高血压之间的相关性。采用χ2检验确定研究之间的异质性,当P>0.10,I2<50%时,异质性较低,采用固定效应模型;否则,采用随机效应模型(P<0.10,I2>50%)。使用漏斗图和Egger’s检验分析发表偏倚。P<0.05为差异有统计学意义。
2 结果
2.1 文献检索流程及结果 通过数据库检索,共检索到1,259篇文献。在筛选前,484篇重复的文献被剔除。阅读标题和摘要后,剔除665篇文献。在检索和筛查剩余文献全文后,最终纳入39篇文献[8-46],其中中文文献32篇,英文文献7篇。
2.2 纳入文献的基本特征 39篇文献均为病例对照试验,其中病例组12,638例,对照组8,494例。所有纳入文献均详细报告基因型数据,且所报告的基因型频率及等位基因频率均符合HWE。
2.3 纳入文献的质量 纳入研究的质量评价得分在4~8分。最常见的选择偏倚为大多数纳入文献的对照人群均选自医院。少数研究在设计和统计分析时未能充分考虑病例和对照的可比性。但所有的研究均较好控制了暴露偏差。
2.4 A1166C基因多态性与中国人群高血压的相关性分析 病例组和对照组的A1166C基因型、等位基因数量见表1。病例组中AA和AC/CC的累积基因型百分比为83.53%和16.47%,对照组中AA和AC/CC的累积基因型百分比为86.44%和13.56%。病例组中C等位基因的平均占比为9.80%,对照组中C等位基因平均占比为7.02%。Meta分析结果显示,AC/CC基因型(OR:1.81,95%CI:1.49~2.20,P<0.0001;异质性检验P<0.001,I2=76%,采用随机效应模型)和C等位基因(OR=1.80,95%CI:1.51~2.15,P<0.001;异质性检验P<0.001,I2=72%,采用随机效应模型)占比越高,患高血压风险越高(见图1~2)。不同亚组间分析见表2。

表2 各亚组分析
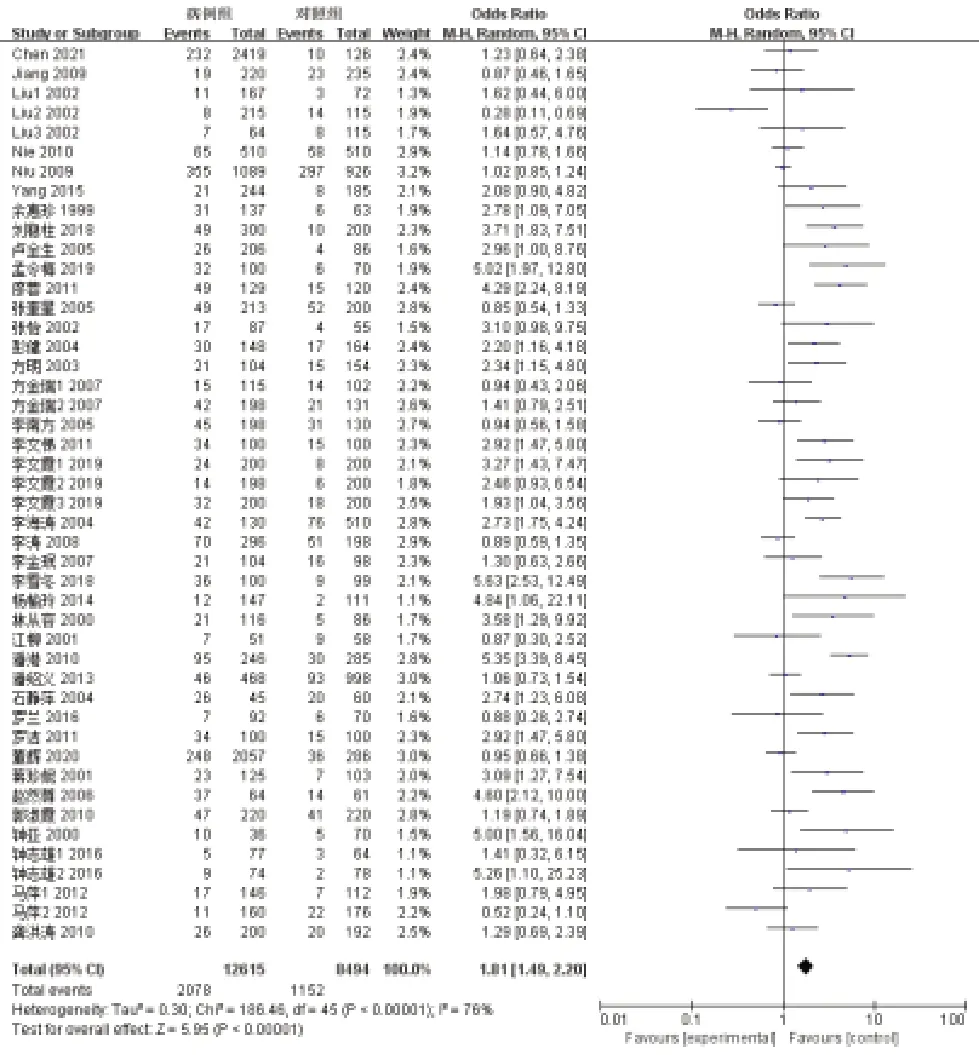
图1 A1166C基因多态性中AC/CC基因型与高血压关系的森林图

表1 病例组及对照组A1166C基因型、等位基因数量

图2 A1166C基因多态性中C等位基因与高血压关系的森林图

表2(续)
2.5 发表偏倚 使用漏斗图和Egger检验检测发表偏倚。AC/CC基因型和C等位基因的图形均较为对称(见图3~4),且Egger’s检验P>0.05,显示此Meta分析纳入文献的发表偏倚较低。

图3 A1166C基因多态性中AC/CC基因型与高血压关系的漏斗图

图4 A1166C基因多态性中C等位基因与高血压关系的漏斗图
3 讨论
相较于之前的研究,本Meta分析主要研究对象为中国高血压人群,针对性更强,对我国高血压防治更具借鉴意义。此外,根据不同民族、地区以及年龄进行了亚组分析,更好揭示了A1166C与中国人高血压的相关性。A1166C的C等位基因和AC/CC基因型可能是高血压的易感基因。目前该基因的C等位基因和AC/CC基因型影响血压的机制尚不明确。有研究表明C等位基因可通过阻断MiR-155与mRNA结合[47]影响AT1R的表达,C等位基因还可与其他SNP共同作用改变AT1R的活性[48]。此外,升高血浆AT1R水平[49]和调节血管内皮舒张功能也是C等位基因影响血压的方式[50]。CC基因型可以升高胆固醇和甘油三酯水平,这在一定程度上也会导致高血压的发生。这些结果表明,在临床中,A1166C对高血压的防治仍具有参考意义,医护人员可根据患者的易感基因型早期应用高血压预防措施。
在民族亚组中,汉族和彝族高血压人群中C等位基因和AC/CC基因型数量高于对照组,表明C等位基因与AC/CC基因型可能是高血压的危险因素。然而,在哈萨克族人群中未发现A1166C多态性与高血压相关,这很可能是由于哈萨克族亚组中的研究文献较少且样本量较小,提示今后可开展更多针对少数民族的基因与高血压相关性研究。地区亚组分析结果显示,C等位基因和AC/CC基因型均会增加东部和中部人群患高血压的风险,然而在西部人群的AC/CC基因型中这种相关性并未被发现。以上结果表明A1166C基因多态性存在民族和地区差异性,这种差异存在的原因除遗传因素外,也可能由不同民族和地区的生活方式、饮食习惯、自然环境不同导致。因此,高血压在基因-基因之间、基因-环境之间的交互作用应被进一步研究。在年龄亚组分析中,两个年龄组的高血压人群C等位基因和AC/CC基因型频率均高于对照组,提示年龄可能不是影响A1166C与高血压相关性的因素。但由于纳入的文献研究对象平均年龄较大(>45岁),这一结果应进一步在年龄范围更广、规模更大的人群研究中得到证实。以上三组亚组分析表明在不同类型人群中A1166C与高血压的相关性不同,提示在未来防治中,可通过基因识别,为不同类型的人群提供个体化防治措施,这也与目前所提倡的“精准个体化治疗”相契合。
综上所述,AT1R A1166C与中国人群高血压存在相关性,其C等位基因和AC/CC基因型可能会增加中国人群患高血压的风险。但由于各种局限性,未来还需纳入更多纵向性大样本前瞻性研究。
