黄芩苷防治雄激素性秃发的网络药理学研究
2023-02-21杨国蓉林苇舟杨一诺杨贞唐亮丁滨
杨国蓉 林苇舟 杨一诺 杨贞 唐亮 丁滨
雄激素性秃发(Androgenetic alopecia,AGA)是临床上最为常见的脱发类型,是一种发生于青春期和青春期后的毛发进行性减少性疾病[1]。流行病学调查显示AGA在我国男性的患病率为21.3%,女性患病率为 6.0%[2]。AGA的发病与遗传因素、雄激素及雄激素受体的作用、微炎症作用、芳香酶作用和环境等因素相关[3],但具体发病机制尚不明确。现代医学认为雄激素过多或对雄激素敏感性增强会增加AGA发生的可能性。在AGA患者脱发部位的毛囊中睾酮(Testosterone,T)及其代谢物二氢睾酮(Dihydrotestosterone,DHT)和雄激素受体(Androgen receptor,AR)的水平显著上升,而5α-还原酶在脱发过程中发挥重要作用[4]。国内外多项研究还发现多种与AGA发病相关的信号分子,包括雄激素受体(AR)、外生质素A2受体、WNT10A以及炎性因子如TGFβ1、IL-1α和TNF-α等[5-6]。AGA的治疗方法包括内用药物非那雄胺,外用药物米诺地尔[7],毛囊移植等,但均有一定的副作用。黄芩苷(Baicalin)是“至墨植萃粉”中的活性成分之一,具有生发[8]、提高免疫力、抗氧、抗衰老、抗肿瘤、抗病毒等作用[9]。由于其促进毛发生长的作用机制尚不明确,本研究通过网络药理学方法,预测黄芩苷治疗AGA可能的靶点及其分子机制。
1 资料与方法
1.1 分子对接 从PubChem(https://pubchem.ncbi.nlm.nih.)检索黄芩苷的二维结构。导入ChemBio 3D软件进行优化,转换为3D结构。在PDB数据库(http://www.rcsb.org/)下载蛋白受体靶点SRD5A2(Ⅱ型5α-还原酶)的3D结构。通过Autodock软件进行分子对接,得到黄芩苷与Ⅱ型5α-还原酶结合能和氢键结合位点,最后应用Pymol软件进行可视化处理。
1.2 黄芩苷的靶点预测 首先利用中药系统药理数据库TCMSP(https://old.tcmsp-e.com/tcmsp.php)检索化合物黄芩苷,获取其Pubchem Cid,将Pubchem Cid输入PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库进行检索,获取相应的2D化学结构式并下载。将结构式导入Pharm Mapper(http://www.lilab-ecust.cn/pharmmapper/)数据库,预测出黄芩苷的潜在靶点,应用Uniprot数据库(https://www.uniprot.org/),对搜集筛选得到的靶点蛋白与基因信息进行矫正,筛选出黄芩苷的潜在靶点。
1.3 雄激素性秃发相关疾病基因的筛选 以“Androgenetic alopecia”为关键词输入GeneCards(https://www.genecards.org/)、OMIM(https://www.omim.org/)数据库检索,整理删除重复项后即可得到疾病相关靶点。
1.4 共同靶点的筛选及“疾病-靶点-化合物网络”构建 将黄芩苷的潜在靶点和AGA疾病靶点输入Venny 2.1.0在线软件作图工具平台(https://bioinfogp.cnb.csic.es/tools/venny/),绘制韦恩图,两者交集所表示的共同靶点即为黄芩苷作用于AGA的关键靶点。采用Cytoscape 3.9.0软件构建“疾病-靶点-化合物”关系网络。
1.5 黄芩苷-AGA蛋白互作网络的构建及核心靶点的筛选 将筛选到的共同靶点上传至STRING在线数据库(https://cn.string-db.org/),设置蛋白种类为Homo sapiens,最低相互作用阈值为0.4,获得黄芩苷-AGA的蛋白互作关系,将其TSV格式导入Cytoscape 3.9.0,进行共同基因的分析及核心靶点的筛选,形成蛋白质相互作用网络图(Protein-Protein Interaction Networks,PPI)。
1.6 GO分类富集和KEGG通路富集分析 将共同靶点上传至DAVID数据库中(https://david.ncifcrf.gov/),设置参数(Select Identifier设置为Official Gene Symbol,List Type设置为Gene List,限定物种为人),对这些靶点进行GO功能富集和KEGG通路富集分析,将结果以条形图或气泡图形式输出。
2 结果
2.1 分子对接 黄芩苷与Ⅱ型5α-还原酶的结合能为-11.1 kcal/moL,在GLU-197、TYR-98、ASN-193、ASP-164、HIS-231、ARG-227、TRP-53位置处形成氢键(见图1)。

图1 分子对接
2.2 黄芩苷-AGA核心靶点分析 通过Pharm Mapper数据库筛选,Uniprot数据库预测出黄芩苷的潜在靶点191个;在GeneCards和OMIM数据库中检索到AGA疾病靶点460个。用Venny 2.1.0分析黄芩苷和AGA的共同靶点,发现AR、SHBG、ALB、CYP19A1、NR3C2、STS、ESR1、EGFR、AKT1、SRC、TYMS、HSP90AA1、CASP3、ANXA5、NR1H2、DPP4、PTPN1、OTC共18个(见图2 A)。将此18个共同靶点输入Cytoscape 3.9.0软件中,绘制出“疾病-靶点-化合物”相互作用网络图(见图2 B)。用STRING数据库分析这18个靶点之间的调控关系、并经Cytoscape 3.9.0软件以PPI网络图的形式展示(见图2 C)。图中共有17个节点(剔除了一个游离节点NR1H2),节点之间共有67条边,平均节点度是7.44,平均局部聚类系数是0.764。图中的节点表示AGA与黄芩苷的共同靶点,边代表靶点间的互作关系。核心度(Degree)较高的靶点用较大的节点和较深的颜色表示,相关度(Combine score)较强的靶点边缘用较粗和较深的线表示。得到Degree值最大的5个核心靶点分别为ALB、AKT1、AR、ESR1、EGFR。

图2 黄芩苷-AGA核心靶点分析
2.3 靶点富集通路分析 将18个共同靶点上传到DAVID数据库进行GO富集分析,共富集到68条生物学过程(Biological process,BP)、17条细胞组成(Cellular component,CC)和30条分子功能(Molecular function,MF),以P<0.05和基因富集程度为筛选条件,选出前10的结果展示见图3 A。KEGG通路分析发现12条信号通路,分别为雌激素信号通路(Estrogen signaling pathway)、癌症中的蛋白聚糖通路(Proteoglycans in cancer)、癌症信号通路(Pathways in cancer)、前列腺癌通路(Prostate cancer)、催乳素信号通路(Prolactin signaling pathway)、黏附连接通路(Adherens junction)、ErbB信号通路(ErbB signaling pathway)、胰岛素阻抗通路(Insulin resistance)、甲状腺激素信号通路(Thyroid hormone signaling pathway)、乙型肝炎途径(Hepatitis B)、Rap1信号通路(Rap1 signaling pathway)、MAPK信号通路(MAPK signaling pathway)。将12条通路可视化,绘制成气泡图(见图 3B)。
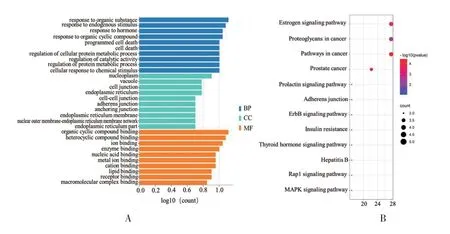
图3 GO功能分析及KEGG通路分析
3 讨论
中药学是我国历史悠久的医学技术,在世界医学领域中是重要的组成部分。相比于西药,使用中药更注重整体的协调统一,能够全面、有效补充机体所需要的营养,增强免疫力,副作用小,病愈后不易复发,因此在治疗慢性疾病和疑难杂症有明显的优势[10]。但中药成分组成复杂,服用后发挥药效的活性成分以及相应的作用机制无法明确。网络药理学能够根据数据库系统性筛选活性成分和疾病的相关靶点及通路,从而为研究中药复杂的作用机制提供新途径[11]。
AGA是一种多基因控制的慢性皮肤病,其发生是一个雄激素依赖性的过程。位于X染色体上的雄激素受体基因(Androgen receptor,AR)包含多个多态性位点,与AR介导的雄激素代谢紊乱有关,被认为是AGA的主要致病因素[12]。5α-还原酶同工酶参与多种类固醇如睾酮、孕酮皮质酮等转化为相应的5α-还原代谢物的过程。目前发现由基因SRD5A1、SRD5A2和SRD5A3编码的三种5α-还原酶同工酶,其抑制会降低DHT的水平,影响AGA的发生[13]。AGA患者的Ⅱ型5α-还原酶将在T细胞内代谢为DHT,后者与AR的结合力更强,与AR结合改变其蛋白构象,形成的AR-DHT复合体从细胞质移位到细胞核,并被招募到雄激素调节基因启动子区,与雄激素反应元件(Androgen responsive element,ARE)结合,激活DNA控制中心,调节靶基因的转录[14-15],合成的特异性信使RNA和蛋白质修饰真皮毛乳头与毛囊间的信号转导,诱导毛囊提前从生长期进入休止期,并发生微型化,引起AGA发生[4]。本研究结果显示,相较于非那雄胺,黄芩苷与Ⅱ型5α-还原酶的结合能更低,结合位点却不尽相同[16]。但黄芩苷可有效嵌入5α-还原酶的活性中心,表明黄芩苷可能有5α-还原酶的抑制活性,有望作为治疗AGA的有效成分。
基于网络药理学系统性筛选,获得18个黄芩苷-AGA共同靶点,其中ALB、AKT1、AR、ESR1、EGFR为聚焦度最高的5个蛋白,而一个靶点NR1H2与其余17个靶点并无交集。本研究预测到的多个相关靶点可能共同影响AGA的发生。白蛋白(Albumin,ALB)是血清中重要的运输蛋白,负责运输生物活性分子、生长信号、营养物质等,在组织、细胞的生长期中具有重要作用[17]。丝氨酸/苏氨酸蛋白激酶AKT1能够通过一系列下游底物的丝氨酸/苏氨酸磷酸化介导,参与细胞代谢、存活、增殖等多种生物学过程。活化的AKT1蛋白能明显影响细胞增殖,延长生长期从而促进头发生长[18]。ESR1基因编码雌激素特异性受体α(Estrogen receptor 1),该蛋白是配体激活的转录因子,被雌激素激活可以抑制毛囊的生长及毛囊退行期向生长期的转换[19]。EGFR(epidermal growth factor receptor,EGFR)属于受体酪氨酸激酶家族[20]。EGFR能够以不活跃的单体形式稳定存在,与特异性配体结合后,自身结构改变,形成二聚体,随即在胞内酪氨酸激酶区(TK)位点发生自磷酸化,从而启动下游信号通路,调节细胞增殖、凋亡、周期和侵袭等生物进程[21-22]。表明黄芩苷可以通过改善毛囊局部活性分子运输营养供给,促进毛囊细胞增殖与分化改善雄激素性秃发。
GO分析中,从细胞组成、生物过程和分子功能三方面描述黄芩苷的活性。并通过KEGG通路富集分析,共富集到12条通路,其中富集度前5个通路中3个与癌症相关。位于第1位的雌激素信号通路[23]与靶点分析的结果相符。此外,第5位的催乳素信号通路[24]也已经被报道与AGA密切相关。此外,黏附连接通路(Adherens junction)[25]、胰岛素阻抗通路(Insulin resistance)[26]、甲状腺激素信号通路(Thyroid hormone signaling pathway)[27]、Rap1信号通路(Rap1 signaling pathway)[28]、MAPK信号通路(MAPK signaling pathway)[29]均被报道参与AGA的调控。
综上所述,黄芩苷治疗AGA的活性机制可能与雌激素信号通路密切相关。此研究为设计后续实验,深入探讨药物的作用机制奠定基础。
