红苞凤梨AbF3′5′H基因上游调控因子筛选
2023-02-21林东璞臧要强张霄鹏周徐子鑫
林东璞,臧要强,张霄鹏,周徐子鑫,马 均
(四川农业大学 风景园林学院,四川 成都 611100)
红苞凤梨(Ananascomosusvar.bracteatus)是一种来源于热带的凤梨属多年生常绿草本观赏植物,因其果型独特、色彩艳丽、株型优美而成为重要的新型观赏植物,果枝作鲜切花保鲜可达1个月以上,也是新型的切花植物[1]。金边红苞凤梨具有绿白镶嵌的金边嵌合叶片,叶果兼赏[2],叶片在春秋季和花期会因花青素的积累而呈现出红色,叶片色彩显著,观赏期长,极大地提高了红苞凤梨的观赏价值[3-4]。
植物的颜色由组织细胞中不同种类的色素以一定的比例组合形成,而在以红-紫-蓝色系为主的观赏植物中,花青素的种类和含量起主导作用[5]。近年来,植物颜色的研究主要集中在花青素的生物合成代谢途径上,通过分子手段对观赏植物的颜色性状进行改良。在具体应用方面,蓝色观赏植物的培育仍然是业内的一大热点,前人研究认为植物产生蓝色性状需要3个条件:呈色物质飞燕草素的积累、黄酮醇或者黄酮糖苷等物质的积累和较高的pH值[6-7]。类黄酮3’5′-羟化酶(flavonoid 3’5′-hydroxylase,F3′5′H)是花青素生物合成途径中的关键酶,可通过与二氢山奈酚反应生成二氢杨梅素,后续生成蓝色飞燕草色素,对植物蓝色表型的形成起到举足轻重的作用,因此F3′5′H基因又被称为蓝色基因[8]。Holton等[9]于1993年将矮牵牛F3′5′H基因导入缺少该基因的粉色系矮牵牛中,使得飞燕草色素大量积累,花色最终呈现蓝紫色。Okinaka等[10]将风铃草、矮牵牛和洋桔梗的F3′5′H基因导入本氏烟草后发现,风铃草的F3′5′H基因可以在烟草中高效表达,从而使烟草花瓣中飞燕草色素大量积累,经测量飞燕草素含量约为转基因前的2倍。F3′5′H基因的表达水平很大程度上决定了花青素的种类组成和飞燕草素的相对含量,而在高等植物中,基因的表达水平受到多种因素的影响,其中转录水平调控基因表达的研究较为深入,在目前对F3′5′H基因的表达调控研究中已发现MYB、bHLH、WD40家族转录因子对F3′5′H的表达起到重要的调控作用[11-13]。
酵母单杂交技术起源于酵母双杂交技术,主要应用于研究调控基因的上游转录因子,该技术依据酵母GAL4转录因子的结构域特性,通过将诱饵载体和cDNA文库连接后观察报告基因的表达情况来判断文库内是否存在调控该基因的上游转录因子[14]。目前酵母单杂交技术已广泛应用于研究植物代谢途径和调控机理方面,郭育强等[15]通过构建木薯酵母单杂交文库并用MeCWINV6启动子片段进行筛库工作,筛选出3个转录因子和1个线粒体受体,为进一步研究提供了候选转录因子;郭荣荣等[16]为研究葡萄成花调控机理,对夏黑葡萄VlTFLlA基因启动子进行了筛库工作,最终选出9个调控因子;李晓雪[17]通过酵母单杂试验筛选出DkMYB9转录因子,后续通过双荧光素酶试验,证明了DkMYB9与目的基因存在相互作用。
红苞凤梨的花瓣为蓝色,叶片和苞片为红色,呈现出不同的花青素积累特性。本研究对红苞凤梨不同颜色的组织进行花青素种类与含量的测定,厘清花青素的种类组成和相对含量对组织颜色的决定作用;并对红苞凤梨AbF3′5′H基因及其启动子序列进行克隆,将序列结果进行生物信息学分析;根据分析结果构建诱饵载体后进行酵母单杂交筛选,筛选调控AbF3′5′H基因的上游转录因子;对筛选出的上游转录因子采用酵母单杂交验证互作关系,以期为AbF3′5′H基因表达调控机制的研究提供候选转录因子。
1 材料与方法
1.1 材料
金边红苞凤梨种植于四川农业大学试验苗圃。
DH5α感受态细胞、Y1H酵母感受态细胞、pAbAi质粒均购买于Solarbio公司,DL marker 2000、DL marker 5000与核酸染料采购于南京诺唯赞生物科技股份有限公司,金担子素AbA、Insert Check Mix 1酶采购于索莱宝生物工程 (大连)有限公司。
1.2 花青素种类与含量测定
于2021年10月红苞凤梨颜色最鲜艳时分别选择红苞凤梨红色叶片、红色苞片和紫色花瓣组织进行取样,材料分别取自3棵不同植株作为重复。对植物材料进行真空冷冻干燥处理,处理后研磨成粉末状,将粉末溶于提取液(80%甲醇水溶液,含0.1%盐酸)后涡旋振荡10 min,超声处理10 min后离心取上清液,过滤后使用LC-ESI-MS/MS分析。色谱条件:色谱柱ACQUITY BEH C18 1.7 μm,2.1 mm×100 mm;流动相A相为超纯水(加入0.1%甲酸),B相为甲醇(加入0.1%甲酸);洗脱梯度:0 min B相比例为5%,6 min时增至50%,12 min时增至95%,保持2 min,14 min时降至5%,并平衡2 min;流速控制在0.35 mL·min-1;柱温40 ℃;进样量2 μL。该方法能够检测到极性高、热稳定性差的化合物,并能够对物质进行精确定量。花青素在植物体属于次级代谢物,液相色谱串联质谱(LC-MS/MS)能够满足花青素准确定性和定量的要求[18]。
1.3 红苞凤梨AbF3′5′H基因克隆与分析
以红苞凤梨植株的花瓣作为克隆材料,提取RNA后使用试剂盒反转录为cDNA作为基因克隆模板,设置3个生物学重复。课题组前期已经完成红苞凤梨基因组测序、组装的相关工作[19],通过本地化Blast比对在数据库中对符合F3′5′H基因特点的序列进行初步筛选,最终筛选出序号为Aco_HBLgroup1g004620的基因,经CD-Search工具分析保守结构域初步判定该基因为AbF3′5′H。利用Primer Premier 6.0设计引物(AbF3′5′H-F、AbF3′5′H-R)进行序列扩增(引物见表1),将正确条带纯化回收后送生工生物工程(上海)股份有限公司测序,对正确测序结果进行Blast对比,同时分析其开放阅读框(open reading frame,ORF)与蛋白质理化性质,预测其蛋白质结构。

表1 引物序列
1.4 AbF3′5′H基因启动子克隆与分析
使用CTAB法提取红苞凤梨花瓣的DNA作为启动子克隆的模板,从基因组数据库中筛选出AbF3′5′H基因上游2 000 bp作为启动子序列,将启动子分为两段1 500 bp的序列,分别设计引物PrF3′5′H-A-F、PrF3′5′H-A-R与PrF3′5′H-B-F、PrF3′5′H-B-R进行克隆。对长度正确的条带进行回收并连接Blunt simple 007载体,转入DH5α大肠埃希菌后将阳性菌提质粒测序。在完成启动子序列克隆后,使用启动子顺式作用元件预测工具PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对序列进行分析[20]。
1.5 诱饵载体pBait-AbF3′5′H构建
根据启动子分析结果选择目标顺式作用元件密集区设计引物F3′5′H-F、F3′5′H-R,该区域位于AbF3′5′H基因ATG上游100~350 bp。跑出目标序列条带并纯化回收后转入DH5α大肠埃希菌,提质粒确定测序结果,用KpnⅠ和SalⅠ分别将测序正确的质粒与pAbAi载体进行双酶切,酶切产物分别纯化回收后用T4连接酶连接,连接后转DH5α扩繁,选取单菌落提质粒进行酶切检测,对长度合适的进行测序验证。
1.6 诱饵载体和阴性对照转化酵母菌株
使用BstbⅠ酶对已构建好的诱饵载体pBait-AbF3′5′H和阴性对照pBait-AbAi分别进行线性化处理,并转入Y1H Gold酵母菌株中,使用一缺培养基SD-Ura进行培养筛选,置于30 ℃培养箱中培养3~4 d后,挑取单菌落,使用Matchmaker Insert Check PCR Mix 1试剂进行菌液PCR检测,检测阳性对照与诱饵载体是否转入Y1H Gold中。
1.7 诱饵载体最低AbA抑制浓度的筛选
配制含100、150、200、250 ng·mL-1金担子素A(AbA)的SD-Ura培养基,使用牙签分别挑取少量诱饵载体与阳性对照菌体混匀在100 μL无菌水中,分别稀释10、100、1 000倍后吸取2 μL点在SD-Ura/AbA培养基上,30 ℃培养3~4 d后观察酵母菌落生长情况。最低AbA抑制浓度即为酵母完全无法生长的培养基上的AbA浓度。
1.8 酵母单杂筛库
将含诱饵载体酵母菌于100 mL YPDA培养液中培养至D600为0.4~0.5,收集菌体后使用TE/LiAC与PEG/LiAc将其制备为感受态,后加入酵母文库质粒培养90 min,取200 μL涂布于SD-Leu/AbA培养基上,30 ℃培养5~7 d,进行初步筛选。初筛过后挑取单克隆反复转板进行假阳性排除,排除过程中可以适当提高AbA浓度,将转板过后依旧生长的酵母菌抽提质粒,将质粒转入DH5α大肠埃希菌中扩繁后再次抽提质粒,最后送至生工生物工程(上海)股份有限公司测序。测序结果在NCBI上进行比对,初步分析筛出的基因序列。
1.9 酵母单杂交互作验证
将筛出的阳性克隆质粒转入含诱饵载体的Y1H Gold感受态中,振荡培养60 min后取100 μL分别稀释10、100倍后涂布于SD-Leu/AbA(260 ng·mL-1)培养基上,以此来回转验证单杂筛库结果。若该转录因子确实与AbF3′5′H存在互作,则酵母可以正常生长,验证过程使用pGADT7空载体作为对照。
2 结果与分析
2.1 红苞凤梨不同组织花青素种类和含量
经LC-ESI-MS/MS检测显示,金边红苞凤梨的叶片、苞片和花瓣中都含有飞燕草素、天竺葵素、矢车菊素、锦葵色素、矮牵牛花色素和芍药花色素6大类花青素,是少有的可以同时合成积累6大类花青素的植物。3种不同组织材料的花青素种类和含量如图1所示。红色叶片边缘组织中矢车菊素苷占总花青素含量的97.42%,而蓝色飞燕草素苷仅占1.91%,因此叶片呈现艳丽的红色;红色苞片中矢车菊素苷占总花青素含量的55.07%,芍药花色素占39.45%,这2种色素在植物细胞内都呈现红色,同时飞燕草素占比仅达0.9%,因此苞片呈现红色;花瓣中蓝色飞燕草素在总花青素含量中的占比显著升高,达到32.74%,而矢车菊素苷只占总花青素含量的47.30%,花瓣呈现出蓝紫色。说明红色花青素和蓝色花青素的相对含量决定了红苞凤梨组织红、蓝颜色的呈现,通过调控叶片中飞燕草素苷的相对比例,可以培育新的叶色种质材料。
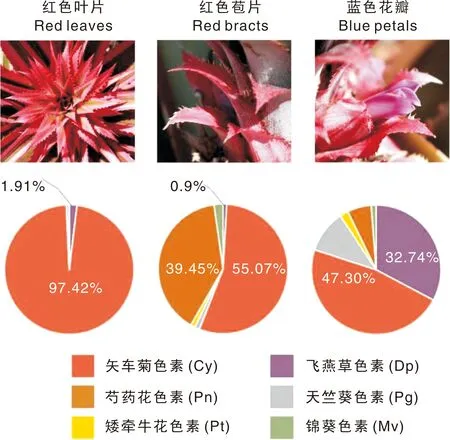
图1 红苞凤梨不同组织花青素种类与含量
2.2 AbF3′5′H基因的生物信息学分析
以cDNA为模板进行扩增,得到长度为1 530 bp的基因片段(图2-A)。经Blast比对发现,该序列与菠萝(XM_020246386.1)的核苷酸序列相似性最高,达94.78%,与野蕉(THU68827.1)、小果野蕉(XP_009411862.1)等物种序列相似性70%以上。经ORF Finder分析发现,AbF3′5′H序列包含一个长度为1 530 bp的开放阅读框,编码509个氨基酸。蛋白质分子式为C2541H4071N723O691S29,分子量(Mw)与等电点(pI)分别为56 735.45和9.18,含带负电荷残基(Asp+Glu)53个,带正电荷残基(Arg+Lys)62个,蛋白稳定指数为38.90,因此其结构功能都较为稳定。使用SWISS-MODEL对其蛋白质三维结构进行预测,发现其GMEQ值为0.69,QMEAN值为0.71,表明该蛋白质为高质量蛋白质,与模板匹配度较高,结构如图2-B。
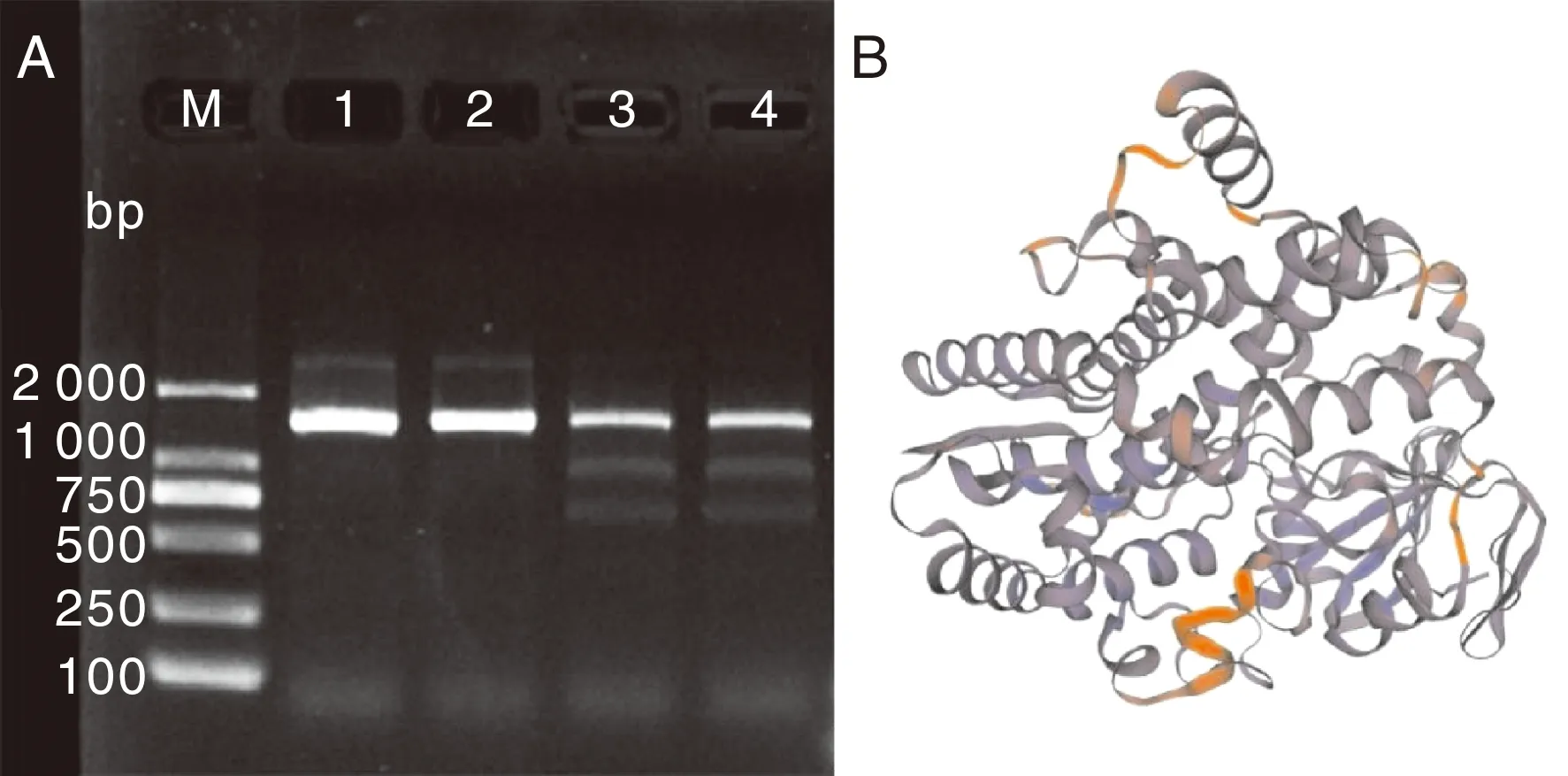
M, DL2000 marker。1~4为PCR扩增产物。
经NCBI的CD-Search分析发现,AbF3′5′H基因编码的氨基酸与PLN00110和Cyp基因家族有关,其中有5条保守结构与都与Cyp有关,说明AbF3′5′H属于p450蛋白家族。
2.3 AbF3′5′H基因启动子的顺式作用元件
克隆得到长度为2 020 bp的启动子序列,使用Plant CARE对启动子序列进行顺式元件在线预测,并通过TBtools对预测结果进行可视化处理。结果(表2)表明,AbF3′5′H基因启动子中含有大量的光响应元件,如ATCT-motif、Box 4、G-Box、MRE,除此之外还含有一些激素和逆境响应元件,如脱落酸响应元件(ABRE)、低温响应元件(LTR)、创伤反应元件(WUN-motif)等,以及在花青素合成途径中非常关键的MYB响应元件。这表明AbF3′5′H基因可能受到光、逆境、激素,以及花青素相关转录因子的诱导和调控。

表2 红苞凤梨AbF3′5′H启动子顺式作用元件
2.4 诱饵载体与诱饵菌株鉴定
根据启动子分析结果,选择顺式作用元件较多的ATG上游100~350 bp序列进行诱饵载体的构建。基于目的片段序列设计上下游引物克隆目的片段,将目的片段与pAbAi载体连接,经PCR检测后长度在5 000 bp以上,图4中泳道1为KpnⅠ和XhoⅠ双酶切质粒,泳道2为质粒DNA,1显示长度正确,诱饵载体构建成功。
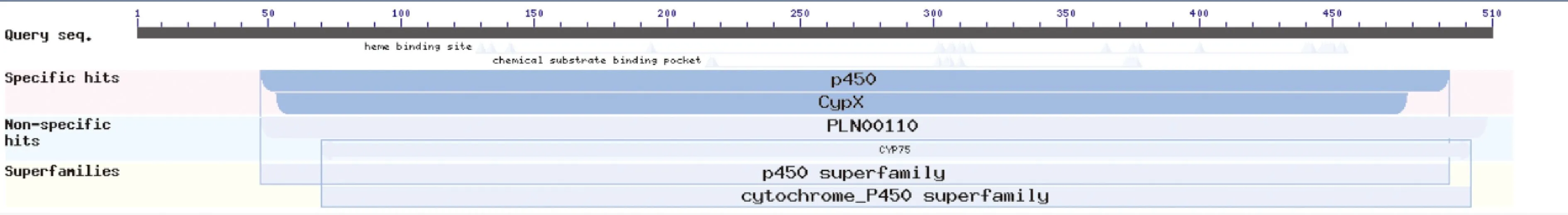
图3 AbF3′5′H基因CD-Search分析
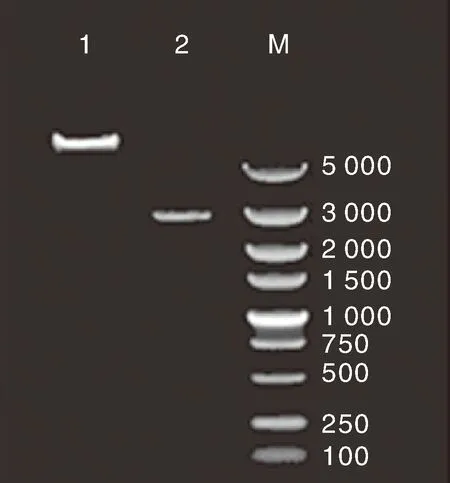
1, KpnⅠ和XhoⅠ双酶切质粒;2, 质粒DNA; M, DL 5000 marker。
2.5 Y1H Gold酵母菌株的转化
将pAbF3′5′H-AbAi与pBait-AbAi空载体经BstbⅠ线性化后转入Y1H Gold感受态中,涂布于SD-Ura培养基上,2~3 d后取单克隆进行PCR检测。空载体长度为1 365 bp,阳性诱饵菌株的长度应大于1 365 bp,如图5,将长度正确的单克隆用于进一步实验。
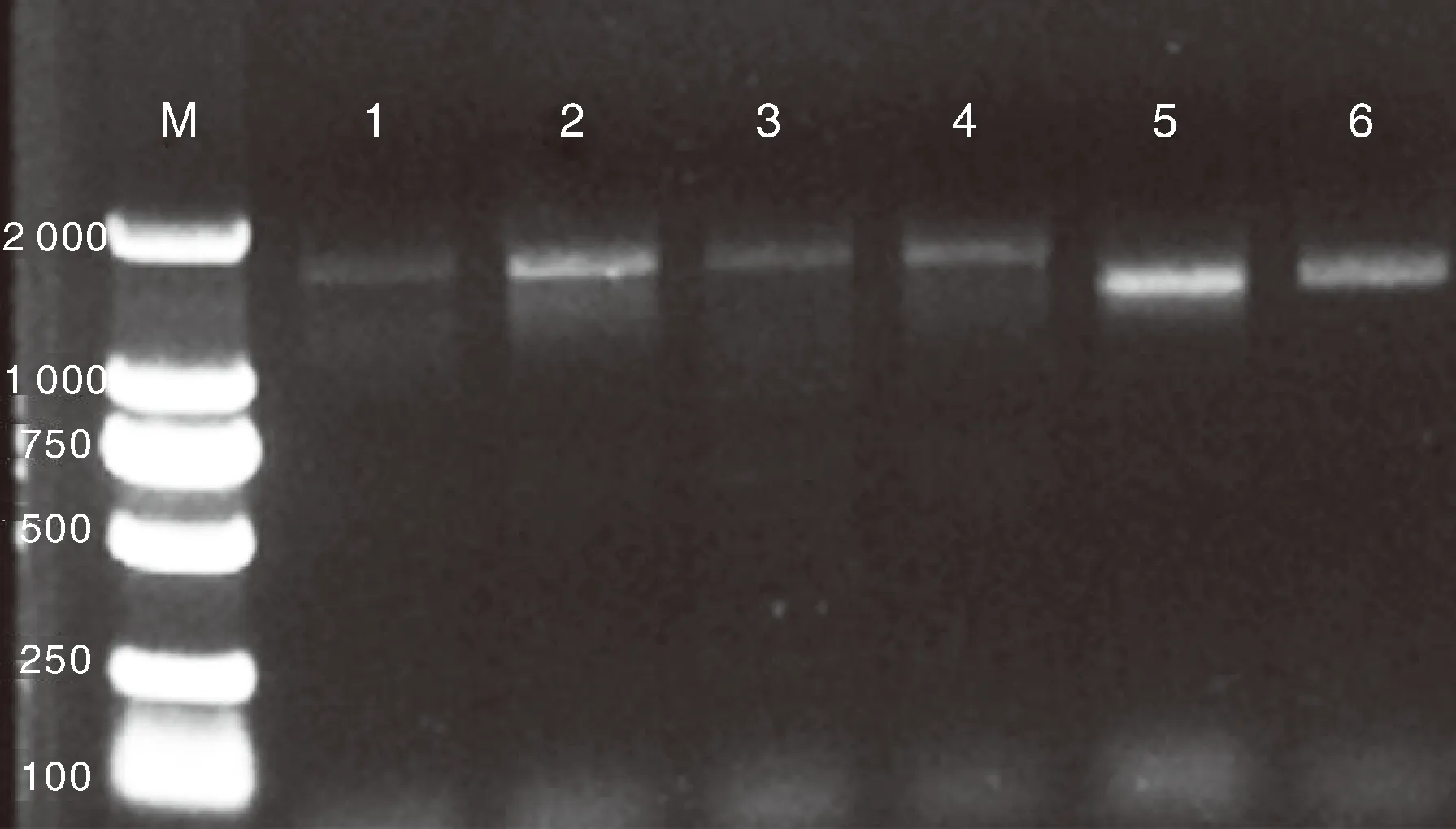
泳道1~4为阳性克隆,5、6为空载体对照。
2.6 最低AbA抑制浓度的筛选
挑取诱饵载体菌株于100 μL无菌水中,稀释不同倍数后分别涂于不同AbA浓度的SD-Ura培养基上,生长结果如图6所示。转入空载的酵母菌株只能在无AbA培养基上生长,而诱饵载体菌株在SD-Ura/AbA(200 ng·mL-1)上仍能生长,说明诱饵载体菌株内启动子片段存在反式激活效应。诱饵载体菌株在SD-Ura/AbA(250 ng·mL-1)培养基上不再生长,因此在单杂筛库过程中AbA质量浓度应在250~280 ng·mL-1,本次筛库选择浓度为260 ng·mL-1。
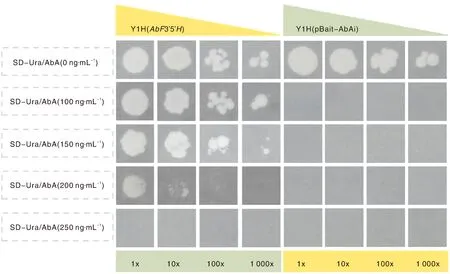
图6 最低AbA抑制浓度筛选结果
2.7 酵母单杂筛库
将Y1H Gold(pAbF3′5′H-AbAi)处理为感受态后加入10 μg酵母文库质粒与50 μL预变性的Carrier DNA,然后在30 ℃摇床中振荡培养90 min,涂布于SD-Ura/AbA(260 ng·mL-1)培养基上,30 ℃培养3~5 d后,选取阳性单克隆转移至相同培养基进行二次筛选,结果如图7所示。共筛选出9个单克隆,对单克隆进行酵母质粒抽提并扩增后送至生工生物工程(上海)股份有限公司测序,并留一部分进行一对一验证。对测序结果进行Blast分析后发现,9个克隆共编码3种不同的蛋白,分别为BTB/POZ锌指蛋白、GLOX-like乙二醛氧化酶、HSP81-1(heatshock protein 81-1)。

图7 阳性单克隆二次筛选结果
2.8 酵母单杂交互作验证
对单杂筛库结果中的3种蛋白进行点对点单杂交互作验证,将单杂筛库过程中提取并测序成功的阳性酵母质粒分别用Carrier DNA转入Y1H Gold(pAbF3′5′H-AbAi)感受态中,涂布于SD-Leu/AbA(260 ng·mL-1)培养基上,结果如图8所示,使用空载体作对照,结果显示,筛出的3个转录因子均能与AbF3′5′H启动子结合产生AbA抗性。
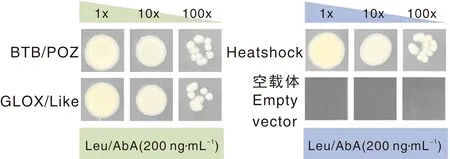
图8 酵母单杂点对点验证结果
3 讨论
通过研究红苞凤梨不同颜色组织的花青素种类与含量,证明红苞凤梨的叶片、花瓣和苞片都可以合成积累全部6大类花青素,而各组织中不同种类花青素的相对含量不同,使各组织呈现出不同的红蓝颜色。花青素的种类组成和相对含量决定红苞凤梨组织红/蓝颜色的呈现,改变叶片花青素种类的相对含量就可以获得新的叶色种质材料,是红苞凤梨叶色育种的有效途径。
在花青素的合成代谢途径中,二氢山奈酚分别在F3′H、DFR、F3′5′H作用下生成不同的中间物质,并进一步分别生成矢车菊素、天竺葵色素与飞燕草色素,其中F3′5′H是蓝色飞燕草色素分支形成的关键基因,研究它的表达调控机制,可以为通过基因工程手段调控飞燕草素的相对含量,进而培育叶色新材料提供理论基础。AbF3′5′H基因编码的氨基酸47~494位都属于p450超家族,该家族在有色类黄酮的生物合成中起着重要作用。黄烷酮、二氢黄酮醇、黄酮醇和黄酮的羟基化模式由CYP75(p450家族75)蛋白质决定,通常花青素B环上羟基数量越多,花青素呈现颜色越蓝[21-22],再一次验证了该基因与蓝色花青素积累密切相关。根据AbF3′5′H启动子响应元件分析结果,推测AbF3′5′H基因可能受到光、逆境、激素、花青素相关转录因子的诱导和调控,在此基础上通过酵母单杂交,筛选出AbF3′5′H上游的3个调控因子,分别为BTB/POZ、GLOX-like、HSP81-1。
BTB/POZ锌指蛋白家族是一个超蛋白家族,该蛋白参与植物整个生长和发育过程,如向光性、抗逆性、细胞蛋白纤维网络构建等方面[23]。HE等[24]通过对可编码BTB/POZ蛋白的辣椒CaBPM4基因的沉默研究发现,CaBPM4沉默可以显著降低植物防御相关基因CaPR1、CaDEF1和CaSAR82的转录水平,从而削弱植株对辣椒疫霉病的抗性。在大豆疫霉菌影响下,大豆GmBTB/POZ转基因苗表现出更强的抗性,初步推断是该基因与水杨酸介导的植物防御机制存在正反馈机制,同时GmBTB/POZ对SOD、POD两种抗氧化酶活性和表达具有积极的调节作用,通过提高大豆中抗氧化酶的活性为大豆提供足够的抗氧化保护,来提高植株对病菌的抗性[25]。
乙二醛氧化酶是一种含铜酶,可以与过氧化物酶协同作用降解木质素。编码GLOX的基因广泛分布在降解木材的真菌中,目前在植物领域的GLOX研究中,已经检测到数种植物中存在GLOX/GLOX-like编码基因,包括葡萄(Vitisvinifera)(GenBank XP_002274763)、拟南芥(Arabidopsisthaliana)(GenBank NP_190963)和水稻(Oryzasativa)(GenBank ABF95066)等[26-27]。Zhou等[28]首先在中国野生葡萄(Vitispseudoneticta)中发现并验证了该基因功能,通过在已接种植物病原体的葡萄叶片中过表达该基因,发现GLOX基因增强了植物的抗病性。乙二醛氧化酶可以与底物发生反应被氧化为羧酸,随后O2充当共基质将GLOX还原为活性状态,同时生成H2O2,H2O2可以对病原体造成直接伤害,同时还能激活植物防御基因起到双重保护作用[29]。此外,植物过氧化物酶需要H2O2来进行质外体结构蛋白连接和木质素聚合,从而在机械损伤后恢复细胞壁,增强对微生物酶攻击的抵抗能力[30]。联合启动子序列中的WUN-motif创伤响应元件分析初步推断机械损伤胁迫可能与AbF3′5′H表达密切相关。
热休克蛋白又称热激蛋白,是在高温环境下产生的蛋白质,根据其分子量不同可以分为HSP100、HSP90、HSP70、HSP60、SHSP,其中HSP81-1属于HSP90蛋白,一般来说HSP蛋白可以通过分子伴侣作用使植物细胞具有更强的耐高温能力[31],HSP蛋白不仅与耐热性相关,同时也与植物的抗寒性相关。Shen等[32]通过对茶树高温与低温胁迫发现,不仅在高温诱导下HSP90与HSP70表达量显著提高,低温下HSP基因的表达量同样显著升高,证明了HSP蛋白与植物抗寒性相关。此外,在Shen等[32]的研究中,低温处理下茶树叶片中总花青素含量会显著提升,但高温下花青素的含量却会降低,结果与Mori等[33]2007年对葡萄果实高温下花青素含量测定的变化结果相同。花青素合成、HSP蛋白表达均与温度相关。在启动子分析中发现,AbF3′5′H启动子含有3个低温响应元件,因此推测AbF3′5′H可能受到低温的调控,但与HSP蛋白的关系还需要进一步研究。
BTB/POZ锌指蛋白、乙二醛氧化酶和热激蛋白81-1对植物体本身有着增强抗逆性的作用。本课题组对红苞凤梨基因组数据的共表达分析表明,花青素生物合成途径的基因表达趋势往往与抗逆性基因表达呈正相关趋势(数据未发表)。此外,根据切片观察发现:红苞凤梨花青素在嵌合叶片的白色组织中的积累水平高于绿色组织[34]。白色组织中叶绿素a、叶绿素b、类胡萝素含量均显著低于绿色组织,嵌合叶片中白色组织的增多会导致叶片光合速率下降[35],可以将白色组织中叶绿素的缺失作为一种光合胁迫,在这种胁迫下抗逆性基因表达量升高,花青素作为抗氧化物表达量也会进一步升高。
在前期序列分析中,在启动子序列中分析出了MYB结合位点与G-box,研究表明,G-box可以作为HY5转录因子的结合位点[36]。MYB转录因子家族是花青素生物合成途径中至关重要的一环。Shi等[37]对茄子SmMYB75的研究表明,过表达SmMYB75可以使茄子花青素积累显著升高,而且F3′5′H表达量上升幅度远高于其他植物。此外,MYB还可以与其他转录因子形成结合蛋白参与转录调控,如与bHLH结合对花青素合成进行调控[38]。HY5是bZIP基因家族的成员,其功能丰富,不仅能够在植物光形态建成中起作用,在植物激素信号传递过程中也起到重要作用[39],HY5还能够调控花青素生物合成途径中的结构基因,HY5蛋白在接收上游光信号后,通过直接激活下游结构基因或借其他方式间接调控下游花青素的积累。但在本次酵母单杂中并没有筛出MYB与HY5这2种在花青素生物合成途径中至关重要的转录因子,可能是因为酵母文库构建时选用材料主要为金边红苞凤梨的叶片组织,没有选用花瓣与苞片,而飞燕草素苷在叶片花青素中占比极低(1.91%),AbF3′5′H在叶片中相对表达水平较低[40],导致调控因子筛选不完全。在后续研究中可以通过以下2种方法完善研究内容:首先构建包含叶片、花瓣、苞片等不同组织的全新酵母杂交文库,进行重新筛库;其次可以通过构建目的转录因子如AbHY5、AbMYB的猎物载体,与AbF3′5′H诱饵载体进行酵母单杂交点对点验证,通过观察菌落生长情况判断是否存在调控机制,后续也可以通过双荧光素酶实验来进一步厘清AbF3′5′H与调控因子之间的关系。
