百里香酚体外抗伪狂犬病毒活性评价及其作用方式
2023-02-21宋天浩庞莲凤陈凌霜邓惠丹徐志文任志华邓俊良
宋天浩,庞莲凤,陈凌霜,邓惠丹,徐志文,朱 玲,任志华,邓俊良,*
(1.四川农业大学 动物医学院,四川 成都 611130; 2.四川省凉山彝族自治州甘洛县农业农村局 动物疫病预防控制中心,四川 甘洛 616850)
伪狂犬病毒(pseudorabies virus,PRV)是疱疹病毒科(Herpesviridae)α疱疹病毒亚科(alpha-Herpesvirinae)水痘病毒属(Varicellovirus)的成员[1]。我国在1950年首次报道猪PRV感染。目前,PRV感染已成为对养猪业危害最大的疾病之一[2-3]。国内外主要通过接种疫苗的方法来预防PRV感染,但该病毒拥有潜伏感染机制,会增大疫苗免疫的难度。2011年,在我国使用Bartha-61疫苗免疫的猪场中发现一种新的PRV变种[4],这就意味着需要研发新的疫苗。然而,疫苗研发始终落后于病毒的变异。目前,人用抗病毒西药在食品动物上已全面禁用。因此,寻找和开发有效的抗病毒药物是防治PRV感染的必要手段。
牛至精油具有抗病毒、抗细菌、抗真菌、抗氧化、抗炎等多种生物学活性[5-7],其中,百里香酚(thymol)是牛至精油的主要活性成分之一。研究表明,百里香酚对包括单纯疱疹病毒(HSV)、牛疱疹病毒(BoHV)在内的多种疱疹科病毒具有良好的抗病毒活性[7-8];然而,关于百里香酚对PRV的抗病毒活性目前还未见相关报道。为此,特围绕百里香酚对PRV的抗病毒活性,以及可能的抗病毒作用方式等开展研究,旨在评价其作为抗PRV药物的潜力,在为猪伪狂犬病防控提供新方法的同时,也为抗疱疹病毒药物的开发提供新思路。
1 材料与方法
1.1 试验材料
百里香酚(纯度>98%),上海源叶生物科技有限公司;仓鼠肾细胞(BHK-21)、PRV,由四川农业大学生物技术中心徐志文教授惠赠;新生牛血清,内蒙古奥普赛生物科技有限公司;高糖DMEM培养基、青链霉素,生工生物工程(上海)股份有限公司;TIANamp Genomic DNA Kit血液/细胞/组织基因组DNA提取试剂盒(DNA提取试剂盒),天根生化科技(北京)有限公司;2×Taq PCR MasterMix(PCR预混液),北京博迈德基因技术有限公司;PrefectStartTMGreen qPCR SuperMix(qPCR预混液),北京全式金生物技术股份有限公司。
1.2 试验仪器
Forma 3111型二氧化碳培养箱、SorvallTMST-16台式高速离心机、Varioskan Flsah全波长酶标仪,美国Thermo;T100型PCR仪、CFX-96型实时荧光定量PCR仪,美国Bio-Rad;DS-U3型倒置显微镜,日本尼康公司;CJ-2F型超净工作台,江苏苏州净化设备公司。
1.3 试验方法
1.3.1 PRV半数组织培养物感染量(TCID50)的测定
收集处于对数生长期、状态良好的BHK-21细胞,制备均匀的细胞悬液,按每孔100 μL的规格接种于96孔板中,于37 ℃、5% CO2条件下在CO2培养箱中培养24 h,待细胞融合度达80%~90%时接毒。使用细胞维持液(高糖DMEM培养基、新生牛血清、青链霉素按98∶2∶1的比例混合制成)梯度稀释PRV病毒液(10-1~10-9),共计9个浓度梯度,每个浓度梯度设6个细胞孔重复,每孔接种100 μL PRV病毒液,于37 ℃、5% CO2条件下在CO2培养箱中培养72 h,观察细胞板中的致细胞病变效应(CPE)(图1),使用Reed-Muench法(RM法)计算病毒的TCID50(表示病毒的滴度大小)。

图1 正常的BHK-21细胞(左)与感染PRV后的BHK-21细胞(右)的形态(200×)
1.3.2 无水乙醇对BHK-21无细胞毒性、对PRV无抑制作用的体积分数确定
以不同体积分数的无水乙醇-细胞维持液作为试验组(无水乙醇的体积分数分别为10%、8%、6%、4%、2%),以细胞维持液(无水乙醇体积分数为0)作为正常对照组,在每个无水乙醇体积分数下设置6个重复,每孔加100 μL,于37 ℃、5% CO2条件下培养72 h后弃去孔中液体,用PBS缓冲液洗涤3次,然后向每孔加入110 μL混合了CCK-8试剂的细胞维持液(细胞维持液与CCK-8按10∶1的体积比混合),避光、继续孵育30min,使用酶标仪测定450 nm处的吸光值(D450),计算细胞相对存活率,确定不会对BHK-21的活性产生显著影响的无水乙醇体积分数范围,并据此进行下一步试验。
将病毒液与上一步确定的对BHK-21活性无明显影响的无水乙醇-细胞维持液进行等体积混合,使得混合液中病毒液的浓度为TCID50的100倍。上一步试验确定体积分数不超过4%的无水乙醇对BHK-21细胞活性无明显影响,以此为基础,设计无水乙醇体积分数分别为4%、3%、2%、1%作为试验组。同时,设置病毒对照组(CK-1E,无水乙醇体积分数为0)和正常细胞对照组(CK-2E,仅有等体积的细胞维持液,病毒液、无水乙醇体积分数均为0)。每组设置6个重复,每孔100 μL,于37 ℃、5% CO2条件下吸附1.5 h,吸弃剩余液体,用PBS缓冲液洗涤3次,再向每孔分别加入100 μL混有对应体积分数无水乙醇(4%、3%、2%、1%、0)的细胞维持液,继续培养72 h,使用CCK-8(操作同上)测定D450,计算溶剂对PRV的抑制率,确定对BHK-21、PRV都无抑制作用的无水乙醇的体积分数。
1.3.3 百里香酚对BHK-21细胞活性的影响
使用细胞维持液梯度稀释百里香酚,以百里香酚质量浓度分别为256、128、64、32、16、8 μg·mL-1的作为试验组(通过预试验确定),设置不加百里香酚的正常对照组。同1.3.2节操作计算细胞相对存活率,得出百里香酚的最大无害浓度(MNTC),并使用RM法计算其半数抑制浓度(IC50)。
以细胞相对存活率和IC50来确定百里香酚对BHK-21细胞无毒性作用的质量浓度(结果为64 μg·mL-1),并据此进行下一步试验。
1.3.4 百里香酚对PRV的抑制作用
将病毒液与用细胞维持液稀释的百里香酚进行等体积混合,使得混合液中病毒液的终浓度为TCID50的100倍,百里香酚的质量浓度分别为64、32、16、8、4、2 μg·mL-1,以其作为试验组。同时,设置病毒对照组(CK-1,接种100 μL浓度为TCID50100倍的PRV,不添加百里香酚)和正常细胞对照组(CK-2,不接种病毒液,不添加百里香酚)。使用RM法计算百里香酚的半数有效浓度(EC50),并结合1.3.3节得出的百里香酚的IC50,计算百里香酚的治疗指数(TI),以初步评价百里香酚体外抗PRV的活性。
1.3.5 百里香酚对PRV滴度的影响
试验操作分组同1.3.4节,接毒后培养至72 h,将细胞板中的细胞、液体反复冻融3次,以释放出全部的病毒粒子,分别收集每一个浓度梯度下所有细胞孔中的剩余液体,按1.3.1节方法测定各浓度梯度所对应的病毒液的TCID50。
1.3.6 百里香酚对PRV在BHK-21中一步生长曲线的影响
根据上述试验结果,选择抗PRV效果最明显的百里香酚质量浓度(试验结果为64 μg·mL-1)作为试验组(T)设定的质量浓度,对照组(CK)中PRV病毒液的浓度为TCID50的100倍。
收集处于对数生长期、状态良好的BHK-21细胞制备均匀的细胞悬液,以每孔1.0 mL的规格接种于12孔板中,在37 ℃、5% CO2条件下培养24 h,吸弃孔中培养液。每孔先接种1.0 mL PRV病毒液,继续在培养箱中吸附1.5 h后,吸弃孔中液体,使用PBS缓冲液洗涤3次。试验组加入1.0 mL 64 μg·mL的百里香酚溶液,对照组加入1.0 mL的细胞维持液,开始记时,然后分别于2、4、6、8、12、24、36、48、60、72 h(共计10个时间点)收集孔中剩余液体,测定TCID50。以试验组TCID50值(以0.1 mL作为基本体积单元)的负常数对数值为y轴,以各时间点为x轴,绘制各组的PRV体外生长曲线。
1.3.7 百里香酚体外抗PRV的作用特征研究
试验共设置病毒对照组(CK-V)、空白对照组(CK-B)、试验组(百里香酚的质量浓度分别为64、32、16 μg·mL-1,分别简记为T1、T2、T3)。其中,病毒对照组接种等体积的100倍TCID50的PRV病毒液,空白对照组仅加入等体积的细胞维持液。
(1)取生长良好的单层BHK-21细胞六孔板,试验组先加相应质量浓度的百里香酚于37 ℃、5% CO2培养箱中孵育1.5 h后,吸弃孔中剩余液体,每孔使用PBS缓冲液洗涤;然后,试验组与病毒对照组统一接种PRV病毒液2 mL,空白对照组接种2%细胞维持液2 mL,继续于37 ℃、5% CO2培养箱中培养1.5 h(即吸附培养),完成病毒吸附过程,吸弃孔中剩余液体,用PBS缓冲液洗涤,每孔加入2%细胞维持液2 mL,于37 ℃、5%CO2培养箱中继续培养72 h,研究百里香酚的体外抗PRV是否涉及预防保护作用。
(2)按照病毒对照组、空白对照组与试验组的设置,取5个5 mL离心管,加入相应的药剂,每管2 mL,其中,试验组中百里香酚与PRV病毒液等体积混合,病毒对照组中2%细胞维持液与PRV病毒液等体积混合。将离心管置于37 ℃、5% CO2培养箱中孵育1 h。取生长良好的单层BHK-21细胞六孔板,每孔对应加入上面孵育后的混合液,吸附培养。完成后,吸弃孔中剩余液体,用PBS缓冲液洗涤,每孔加入2%细胞维持液2 mL,于37 ℃、5% CO2培养箱中继续培养72 h,研究百里香酚的体外抗PRV是否涉及直接杀灭作用。
(3)取生长良好的单层BHK-21细胞六孔板,置于4 ℃冰箱中预冷30 min(温度低导致病毒停留在吸附穿入阶段),吸弃孔中剩余液体,使用于4 ℃预冷的PBS缓冲液洗涤。按1.3.7节(2)中各处理设置于对应孔中加入相应的药剂,每孔2 mL,继续在4 ℃吸附培养。完成后,吸弃剩余液体,每孔加入2%细胞维持液2 mL,于37 ℃、5% CO2培养箱中继续培养72 h,研究百里香酚体的外抗PRV是否涉及抗病毒侵入作用。
(4)取生长良好的单层BHK-21细胞六孔板,向试验组和病毒对照组孔中先加入PRV病毒液2 mL,向空白对照组孔中接种2%细胞维持液2 mL,吸附培养1.5 h后,吸弃孔中剩余液体,用PBS缓冲液洗涤,然后向试验组中加入相应质量浓度的百里香酚,向病毒对照组和空白对照组中加入细胞维持液,均为2 mL,于37 ℃、5% CO2培养箱中继续培养72 h,研究百里香酚的体外抗PRV是否涉及抗病毒胞内增殖作用。
经过上述处理后,按照DNA提取试剂盒说明书方法提取DNA样品,检测DNA纯度,选取合格样品于-20 ℃保存,待测。利用本实验室基于PRV-gE基因建立的SYBR染料FQ-PCR检测方法(绝对荧光定量),计算不同样品中PRV-gE基因的拷贝数以反映不同样品中PRV的病毒量,从而判断在不同处理方式下PRV在BHK-21中的增殖情况和百里香酚体外抗PRV可能的作用方式。
FQ-PCR反应体系(20 μL):2×PerfectStartTMGreen qPCR SuperMix,10 μL;上、下游引物,各1 μL;模板,2 μL;ddH2O,6 μL。反应条件:94 ℃ 30 s预热;94 ℃ 5 s,60 ℃ 15 s,72 ℃ 10 s,循环40次。上、下游引物序列(5′→3′)分别为CGTGTTCTTTGTGGCGGTG、AGCGTGGCGGTAAAGTTCTC。
2 结果与分析
2.1 PRV的TCID50测定结果
将10-1~10-9浓度梯度的PRV病毒稀释液接种至细胞后,连续培养72 h,每24 h观察并记录一次CPE情况(表1)。依据RM法,计算出PRV的TCID50为10-6.636mL-1。
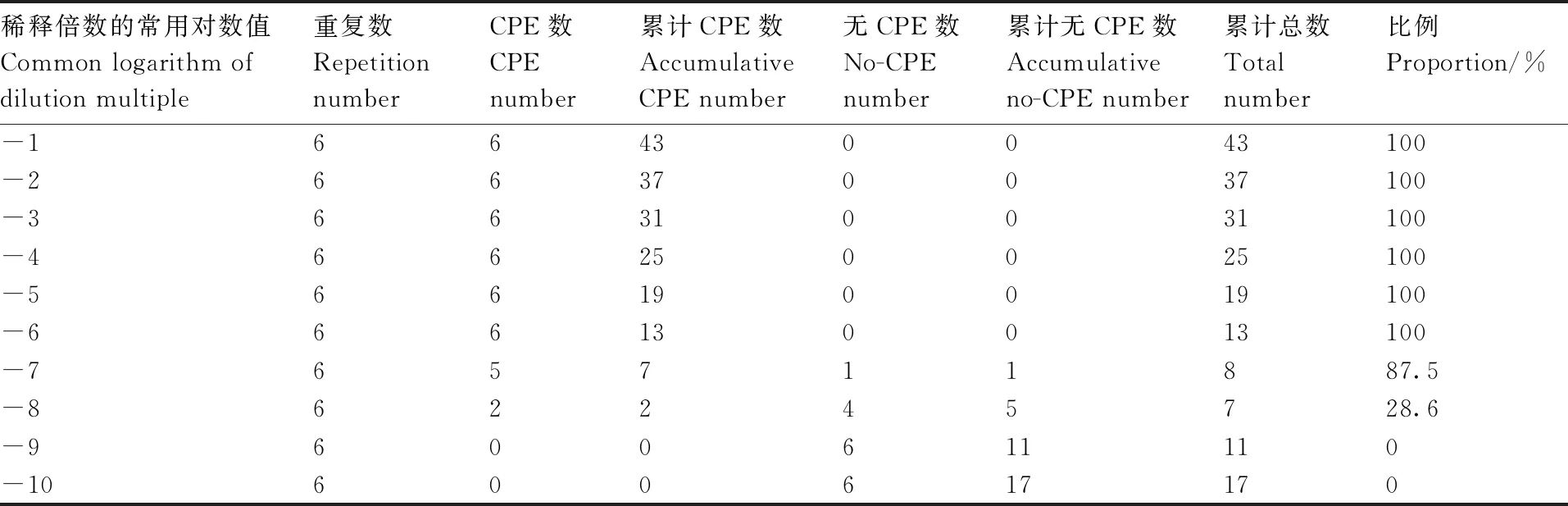
表1 PRV TCID50的测定统计结果
2.2 不影响BHK-21活性、不抑制PRV的无水乙醇体积分数
在无水乙醇对BHK-21生长的抑制试验中,当无水乙醇在无水乙醇-细胞维持液中的体积分数为4%及以上时,其与正常对照组的吸光值存在显著(P<0.05)差异(表2)。据此,确定无水乙醇的体积分数不超过4%。

表2 不同体积分数无水乙醇对BHK-21生长的抑制结果
在无水乙醇对PRV引起的BHK-21病变抑制效果试验中,仅当无水乙醇的体积分数为4%时,其与CK-2E的吸光值存在显著(P<0.05)差异(表3)。综合上述试验结果,确定后续试验中所有试验组、对照组的无水乙醇的最终体积分数不超过2%。

表3 不同体积分数无水乙醇对PRV引起的BHK-21病变的抑制结果
2.3 百里香酚对BHK-21相对存活率和IC50的影响
使用CCK-8法测定百里香酚对BHK-21细胞生长的抑制作用(表4),确定64 μg·mL-1为百里香酚对BHK-21的MNTC(相对存活率>90%),并据此设计后续试验药物的浓度梯度。另外,经测定,百里香酚对BHK-21的IC50为(212.789±1.652)μg·mL-1。
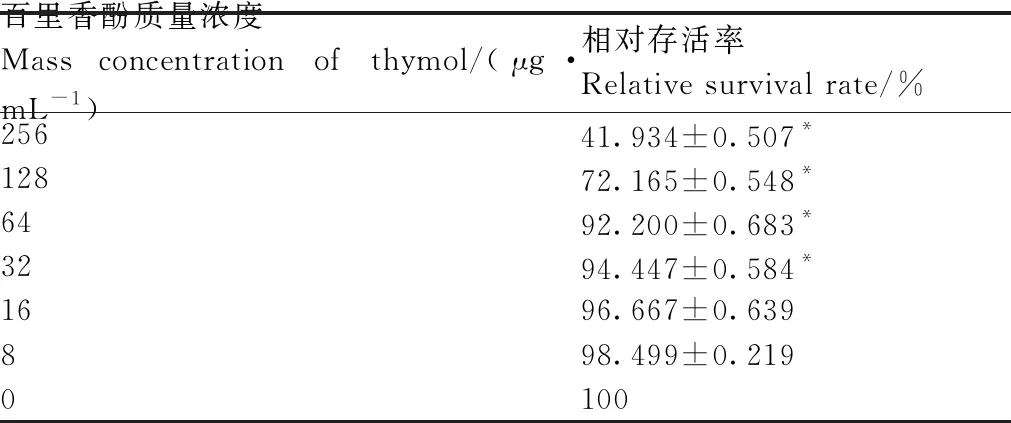
表4 不同质量浓度百里香酚对BHK-21相对存活率的影响
2.4 百里香酚对PRV的抗病毒活性
使用CCK-8法检测百里香酚对PRV导致BHK-21出现CPE的抑制作用(表5),其中,64 μg·mL-1的百里香酚对PRV具有最强的抑制作用。经测算,百里香酚对PRV的EC50为(30.710±0.303)μg·mL-1,TI为6.929,说明百里香酚属于高效低毒类抗PRV药物,具有一定的开发潜力。

表5 不同质量浓度百里香酚对PRV引起的BHK-21病变的抑制结果
2.5 百里香酚对PRV毒力的影响
在8~64 μg·mL-1范围内,百里香酚可以剂量依赖性地显著(P<0.05)降低PRV在BHK-21中增殖后的毒力,且以64 μg·mL-1的作用效果最佳(表6),与前文CCK-8的检测结果一致。

表6 不同质量浓度百里香酚作用后BHK-21中生长的PRV的TCID50值的负常用对数值[-lg(TCID50)]
2.6 百里香酚对PRV体外一步生长曲线的影响
对照组和试验组的-lg(TCID50)在前48 h都呈现明显的上升趋势(图2),但试验组在0~4 h阶段未出现CPE。48 h后,对照组和试验组的-lg(TCID50)均趋于稳定,其中,对照组在48 h后TCID50稳定于10-6.5mL-1左右,百里香酚组 TCID50维持于10-4.8mL-1左右,说明百里香酚具有抑制PRV在BHK-21中生长的作用。
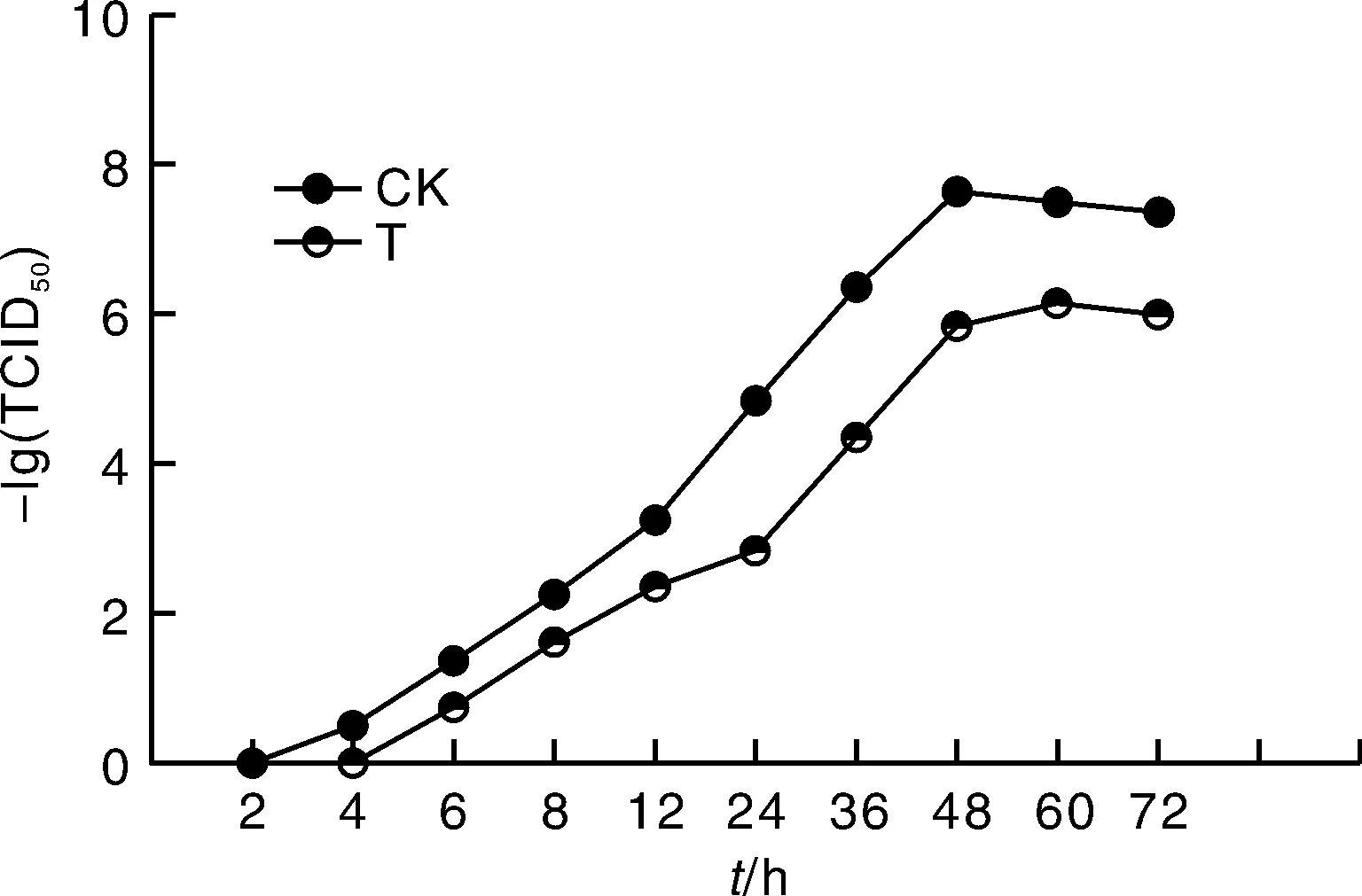
图中的-lg(TCID50)值均以0.1 mL作为基本体积单元计算得到。
2.7 百里香酚体外抗PRV的作用方式
使用qPCR方法检测不同的加药、病毒感染方式下百里香酚对PRV在BHK-21不同感染阶段的抑制效果(图3),其中,各处理下空白对照组的拷贝数均为0,不在图中展示。
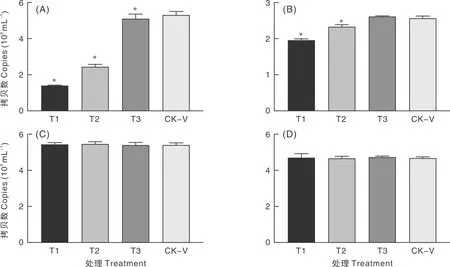
A,抗病毒胞内增殖作用;B,直接杀灭作用;C,抗病毒侵入作用;D,预防保护作用。“*”表示与CK-V相比差异显著(P<0.05)。
抗病毒胞内增殖作用组中:不同质量浓度(64、32、16 μg·mL-1)百里香酚试验组的PRV-gE基因拷贝数均显著(P<0.05)低于病毒对照组。直接杀灭作用组中:64、32 μg·mL-1百里香酚试验组的PRV-gE基因拷贝数与病毒对照组差异显著。在预防保护和抗病毒浸入两种作用方式中,不同药物浓度组与病毒对照组之间均无显著性差异。
由此推测,16~64 μg·mL-1百里香酚抗PRV的主要作用方式是在抗病毒胞内增殖阶段发挥作用。同时,32~64 μg·mL-1的百里香酚还具有直接杀灭PRV的作用。
3 讨论
3.1 百里香酚的体外抗PRV活性与评价方法
在药物体外抗病毒试验中,受试药物的溶解性和溶媒类型对试验结果具有重要影响。一般地,水溶性较差的药物通常会使用有机溶剂作为溶媒,如甲醇、乙醇、二甲基亚砜等,当此类物质在溶剂中占比过高时,会对细胞、病毒的生存(或活性)产生一定的抑制作用[9]。因此,本试验在进行百里香酚体外抗PRV试验前,先检测了所选溶媒——无水乙醇对BHK-21细胞的毒性和对PRV的抑制作用。结果表明,体积分数低于2%的无水乙醇对本试验选用的BHK-21无细胞毒性,对PRV无明显的抑制作用。在本研究的后续试验中,均控制无水乙醇的体积分数不超过2%,以排除无水乙醇对试验结果可能造成的影响。
学界将可以维持90%以上细胞活力的药物浓度定义为最大无害浓度,又称最大工作浓度[10]。在研究中,药物浓度梯度设置的最大值不宜超过最大工作浓度。本试验使用CCK-8法检测了不同质量浓度的百里香酚对BHK-21细胞活性的影响。当百里香酚的质量浓度为256、128 μg·mL-1时,BHK-21细胞的相对存活率分别仅为41.934%、72.165%,均低于90%;当百里香酚的质量浓度为64 μg·mL-1时,BHK-21细胞的相对存活率为92.200%,且随着百里香酚质量浓度的进一步降低,BHK-21细胞的相对存活率进一步上升。这一结果表明,当百里香酚的质量浓度为0~64 μg·mL-1时,其对BHK-21细胞的毒性小于10%。由此确定,本试验中百里香酚的最大工作浓度为64 μg·mL-1。后续试验均以此为基础,设计百里香酚的质量浓度梯度,以探究其可能的剂量依赖性。
百里香酚具有多样的生物学活性。在抗病毒活性方面,研究表明,百里香酚对单纯疱疹病毒(HSV)、牛疱疹病毒(BoHV)[7-8]、猫杯状病毒(FCV)、鼠诺如病毒(MNV)、人类免疫缺陷病毒(HIV)、猿类免疫缺陷病毒(SIV)等均具有不同程度的抑制作用[11-14]。其中HSV、BoHV与PRV同属于疱疹病毒科,所以百里香酚在抗PRV病毒的研究领域具有一定的潜力。本研究发现,百里香酚具有优秀的体外抗PRV活性。当百里香酚的质量浓度为64 μg·mL-1时,对PRV具有显著的抑制作用,相对抑制率为78.881%,并且能将PRV的-lg(TCID50)值由6.545±0.079降低至4.775±0.121。而且,这种抑制效果与百里香酚的质量浓度表现出剂量依赖性。
评价药物体外抗病毒活性常用的3项指标为IC50、EC50、TI。IC50指细胞活性维持于50%的受试药物浓度,其值越高,说明该药物的毒性越低。EC50指由病毒导致的CPE被抑制50%的受试药物浓度,值越低,说明抑制效果越好。TI是IC50与EC50的比值,一般认为当药物的TI>2时,该药物对病毒属于高效低毒类药物;1≤TI≤2时,归类为低毒有效类药物;TI<1时,认为该药物无开发利用价值[9]。Pilau等[8]基于该评价体系,研究一种提取自墨西哥牛至草的精油对单纯疱疹病毒一型(HSV-1)和牛疱疹病毒二型(BoHV-2)的抗病毒活性,使用MTT法检测该牛至精油对HSV-1、BoHV-2的TI分别为13.1和9.7。本试验利用该评价体系,对百里香酚的体外抗PRV活性进行评价。结果表明,百里香酚对BHK-21的IC50为(212.789±1.652 )μg·mL-1,对PRV的EC50为(30.710±0.303) μg·mL-1,TI为6.929。据TI判断,百里香酚对于PRV属于高效低毒类药物,具有进一步研究开发的价值。
通过绘制病毒的一步生长曲线,可以检测病毒在细胞中的生长复制情况。姚子璇[15]分离鉴定了一株伪狂犬病毒分离株,并绘制了该毒株的一步生长曲线,结果显示,该病毒滴度于接种后的0~36 h有明显的上升,之后呈现稳定趋势,至60 h时虽保持稳定但表现出微弱的下降趋势。方超等[16]绘制了经典PRV RA株、分离株的一步生长曲线,得出了相似的结论。本文采用类似的方法绘制了百里香酚作用下PRV于BHK-21中的一步生长曲线。在64 μg·mL-1百里香酚作用下:0~4 h无法测定出PRV的病毒滴度;4~60 h,一步生长曲线出现上升趋势,说明病毒开始快速增殖;60~72 h,-lg(TCID50)值逐渐稳定,且明显低于病毒对照组。结果说明,百里香酚能够显著地抑制PRV于BHK-21细胞中的生长增殖,降低了PRV的病毒滴度。
3.2 百里香酚体外抗PRV的作用特征
病毒的复制周期大致可以分为以下几个步骤:(1)成熟的病毒粒子吸附并且穿入宿主细胞;(2)mRNA转录、复制,病毒蛋白质合成;(3)新病毒粒子的组装和出芽。上述病毒复制过程均可成为抗病毒药物的直接作用靶点,对作用靶点的抑制会降低病毒的传染性。一般地,判断药物对病毒的作用机制,通常通过控制添加药物时间的方法来进行初步的分析,这也是研究药物于细胞间/细胞内抑制特性时最广泛、最常见的方法[17]。根据病毒的复制周期特征和前期试验结果,本研究将百里香酚体外抗PRV的作用特征分为4种类型——直接杀灭作用、预防保护作用、抗病毒侵入作用(即对病毒的吸附穿入阶段作用)、抗病毒胞内增殖作用,每种类型分别对应于一种药物添加时间和处理方式。采用FQ-PCR方法,通过测定各处理下样品中PRV-gE基因拷贝数的变化,来判断百里香酚对PRV的具体作用方式。
在直接杀灭作用研究中,百里香酚直接与病毒粒子作用,于37 ℃、5% CO2环境中孵育1 h时,以未加入百里香酚的PRV病毒液为病毒对照组,将上述病毒液接种于BHK-21细胞中,72 h后提取DNA,使用qPCR方法检测病毒中相关基因的拷贝数,以此判断百里香酚是否在预先处理中灭活了PRV。结果表明,较高质量浓度(32~64 μg·mL-1)的百里香酚能够在体外直接灭活部分PRV。在预防保护作用、抗病毒侵入作用研究中,不同的处理方式和百里香酚添加时间均不能降低PRV中相关基因的拷贝数,说明百里香酚并不是通过保护作用或阻止PRV吸附穿入BHK-21细胞来发挥抗病毒活性的。在抗病毒胞内增殖作用研究中,将未经过任何处理的PRV直接接种至BHK-21细胞,再加入不同浓度的百里香酚与接毒后的BHK-21细胞相互作用。结果发现,在该处理模式下,16~64 μg·mL-1的百里香酚均能显著降低病毒PRV-gE基因拷贝数,说明百里香酚能够在PRV进入BHK-21细胞后的胞内增殖阶段发挥抗病毒作用。
Sökmen等[7]将主成分为香芹酚、百里香酚的牛至精油醇提取物以不同时间加入接种了HSV-1的MDBK细胞中,发现其能够抑制HSV-1的胞内增殖;Zhang等[18]使用类似的处理模式,研究了百里香酚的同分异构体——香芹酚对HSV-1的抗病毒活性,结果发现,香芹酚能抑制该病毒的胞内增殖。Wang等[19]发现,牛至精油能够剂量依赖性地抑制HSV-2的胞内增殖。Sharifi-Rad等[20]将百里香酚(40~640 μg·mL-1)直接与HSV-1混合处理2 h,之后接种至细胞中,结果显示,试验组形成的斑块剂量依赖性地显著少于对照组,表明百里香酚能够剂量依赖性地直接杀灭HSV-1病毒粒子。上述研究结论与本试验结果类似,但由于试验用到的病毒和细胞不同,具有显著抑制作用的药物剂量表现出一定的差异。
综上所述, 16~64 μg·mL-1的百里香酚有良好的体外抗PRV活性,能够剂量依赖性地抑制由PRV导致的BHK-21病变,并显著地降低PRV的病毒滴度,抑制PRV于BHK-21中的生长复制。百里香酚主要是通过抗病毒胞内增殖发挥抗PRV活性作用的,且32~64 μg·mL-1的百里香酚还能够直接杀灭PRV病毒粒子。百里香酚对PRV属于高效低毒类抗病毒药物,具有开发成为新型抗伪狂犬病毒感染防控药物的潜力。
