外源表没食子儿茶素没食子酸酯对甜瓜幼苗白粉病抗性的影响
2023-02-21方明雅余宏伟武雅娴韩文炎刘海河
方明雅,余宏伟,武雅娴,韩文炎,李 鑫,*,刘海河,*
(1.河北农业大学 园艺学院,河北 保定 071700; 2.建德市农业农村局,浙江 建德 311600; 3.中国农业科学院 茶叶研究所,浙江 杭州 310008)
甜瓜(CucumismeloL.)是一年生双子叶植物。由于其果实色、香、味俱佳,营养成分丰富且经济效益高而在世界各地广泛栽培,是世界十大水果之一[1]。我国是世界甜瓜种植面积最大的国家[2]。然而,在甜瓜的栽培过程中,尤其是在设施栽培中容易受到各种病害的威胁,其中白粉病是最严重的病害之一。甜瓜白粉病是由白粉病菌(Podosphaeraxanthii)引起的一种毁灭性病害,从甜瓜苗期到果实成熟,无不影响着甜瓜植株的生长和果实的产量及品质[3]。温室大棚等高温高湿的环境更加有利于白粉病的发生和传播。另外,栽培管理措施也与白粉病的发生有着密切的关系。例如,施肥不足、灌溉不及时、光照不充足等均会降低甜瓜的抗性水平,诱发白粉病[4]。
研究表明,自20世纪70年代以来,人们相继采用苯并咪唑类、取代嘧啶类、麦角甾醇生物合成抑制剂类和甲氧丙烯酸酯类杀菌剂防治瓜类白粉病,但病原菌在短时间内陆续对上述杀菌剂产生了抗药性,田间防治效果下降或完全丧失。而采用化学药剂进行防治则会产生药剂残留以及土壤和环境污染等问题[4]。因此,采用生物防治或选育抗病的甜瓜品种是防止和减轻甜瓜白粉病危害的有效途径。但采用常规育种和杂交育种技术进行甜瓜抗白粉病育种工作,育种周期较长,难以在短时间内获得优质抗病品种。使用分子标记辅助育种可以加快选育白粉病抗病品种,但由于甜瓜对白粉病抗性遗传机制的复杂性以及缺乏高效的白粉病抗性连锁标记,甜瓜抗白粉病育种工作一直进展缓慢。因此,研究环境友好型、绿色无污染的甜瓜白粉病防治手段对甜瓜生产具有重要的意义。
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)属于黄酮类化合物,是茶多酚中含量最丰富的一种组分,是茶叶特有的儿茶素,其含量占茶多酚制品的40%~50%,因其活跃的抗氧化特性而一直备受关注。与其他儿茶素组分相比,EGCG具有更强的抗氧化能力。在医学方面的研究也表明,EGCG具有多种抗炎[5]、抗氧化[6]和骨调节特性[7]。近年来,大量关于抗肿瘤治疗的研究表明,EGCG可单独或与标准疗法联合作为口腔癌的治疗药物,可以增强疗效,并且可减少肿瘤患者治疗的副作用[8]。
EGCG可以提高植物的非生物胁迫,例如外源EGCG不仅提高了盐胁迫下种子的发芽率,而且提高了种子的发芽势和发芽指数;150 mmol·L-1NaCl处理的种子产生了大量的活性氧(ROS),加剧了细胞膜脂过氧化程度,而100 μmol·L-1EGCG处理清除了过量的ROS。100 μmol·L-1EGCG处理显著提高了胚根抗坏血酸过氧化物酶(APX)和过氧化氢酶(CAT)活性[9]。抗氧化酶系统分析表明,EGCG能提高盐胁迫下超氧化物歧化酶(POD)、过氧化物酶(POD)、APX和CAT的活性[10]。植物生理研究表明,外源EGCG在冷热胁迫下对抗氧化酶活性的提高最为显著。尽管外源EGCG在干旱条件下抑制或不改变APX、SOD和POD的活性,但EGCG处理后,干旱胁迫下植物体内CAT活性显著增加,表明CAT可能在EGCG诱导的耐旱性中发挥主要作用[11-12]。近年来关于EGCG在植物应对非生物胁迫中的调控机理也被进一步阐明。但关于EGCG在植物与生物胁迫互作中的作用及其调控机理仍然有待进一步探讨和开发应用。
本研究拟以甜瓜品种甜宝为试验材料,通过外源EGCG处理,探讨EGCG对甜瓜白粉病抗性的影响,并利用生理生化分析和实时定量PCR等分子生物学技术阐明外源EGCG对甜瓜白粉病抗性的影响及其调控机理,以期利用外源EGCG提高甜瓜对生物胁迫尤其是白粉病的抗性水平,从而提高甜瓜在设施栽培中的产量、品质以及经济效益。
1 材料与方法
1.1 实验材料与处理
供试甜瓜品种为甜宝,由西北农林科技大学惠赠。EGCG采购于湖州荣凯植物提取有限公司,分析纯(>99%)。白粉病病原菌由浙江省农业科学院从发病甜瓜植株分离,并通过电子显微镜观察确定其为白粉病病原菌。
试验在中国农业科学院茶叶研究所温室进行,2020年5月中旬至7月下旬进行预实验,在预实验基础上于2020年8月至2021年5月完成实验。本试验设置以下4个处理,即用清水喷施叶片(Control)、用EGCG喷施叶片(EGCG)、只接种白粉病病原菌(Podosphaerax)、喷施EGCG并且接种白粉病病原菌(EGCG+Podosphaerax),每个处理30株甜瓜幼苗。
甜瓜种子于55 ℃进行温汤浸种15 min,随后放于28 ℃培养箱催芽。待甜瓜种子露白后,将其播于穴盘中,穴盘苗生长至一叶一心时移栽至直径20 cm的花盆中,培养箱昼/夜温度为28 ℃/18 ℃,昼/夜相对湿度为70%~80% / 85%~95%,光照/黑暗条件为16 h/8 h。待甜瓜幼苗长至六叶一心时,用100 μmol·L-1EGCG溶液喷施叶片,至叶片腹背布满溶液且不滴落为宜,经过12 h后,进行白粉病病原菌接种试验,将田间发病甜瓜叶片上的白粉病菌抖落,配置成2×105mm-3孢子悬浮液,并将孢子悬浮液均匀喷施在甜瓜叶片上,待接种后12 h后进行取样。样品采集后立即放入液氮中,随后放于实验室-80 ℃超低温冰箱进行保存。
1.2 测定项目与方法
1.2.1 二氨基联苯胺(DAB)染色
参考Li等[13]的方法进行DAB染色。配制质量体积比为0.1%的DAB溶液,将鲜叶按照处理组浸没于DAB溶液中,25 ℃下光照培养使之充分吸收DAB染色液,待叶片上出现深褐色类似伤害斑点即可停止染色,将叶片放入95%乙醇中,置于100 ℃水浴煮沸15 min,再将叶片放置于新鲜的95%乙醇中,待叶绿素完全脱去,进行拍照。
1.2.2 丙二醛(MDA)含量和抗氧化酶活性测定
参考Ahammed等[14]的方法进行MDA含量,以及SOD、APX、POD、CAT活性的测定。
粗酶液的提取:取甜瓜冷冻叶片0.2 g,分3次加入总体积3 mL 50 mmol·L-1pH 7.8磷酸缓冲液(PBS),再加2% PVP 研磨,12 000g4 ℃ 离心20 min,取上清液,用于各种酶活性和MDA含量的测定。
MDA含量的测定:取1 mL提取液,加入3 mL TCA反应液,在95℃水浴保温30 min,立即置于冰浴中完全冷却,15 000×g离心10 min,取上清液,测定其在532 nm和600 nm处的紫外吸收值。SOD活性的测定:取50 μL上清液,加入3 mL NBT反应液,空白对照为50 μL pH值7.8磷酸缓冲液中加入3 mL NBT反应液,将样品和空白对照置于25 ℃光照下,充分照光25 min,保证受光均匀,以缓冲液调零,在560 nm下检测其紫外吸收值。POD活性的测定:取1 700 μL 25 mmol·L-1PBS(pH值7.0)缓冲液,分别加入1%愈创木酚100 μL,20 mmol·L-1过氧化氢100 μL,以及100 μL粗酶提取液,立即置于470 nm下检测其紫外吸收值。CAT活性的测定:取1 700 μL 25 mmol·L-1PBS(pH值7.0)缓冲液,分别加入100 mmol·L-1过氧化氢200 μL,以及100 μL粗酶提取液,立即置于240 nm下检测其紫外吸收值。APX活性的测定:取1 700 μL 25 mmol·L-1PBS(pH值7.0)缓冲液,分别加入5 mmol·L-1抗坏血酸100 μL,20 mmol·L-1过氧化氢100 μL,以及100 μL粗酶提取液,立即置于290 nm下检测其紫外吸收值。
1.2.3 实时荧光定量PCR(qRT-PCR)分析
本次实验采用 Tiangen试剂盒提取甜瓜叶片的RNA并进行反转录。利用Light Cycler 480II和SYBR Green荧光染料试剂盒进行qRT-PCR分析,引物序列见表1。SYBR Green 10 μL,ddH2O 8.8 μL,正义引物0.1 μL,反义引物0.1 μL,DNA模板1 μL,共组成20 μL的反应体系。PCR的反应条件为:95 ℃反应30 s后,相同温度下变性10 s,最后在58 ℃下退火45 s,进行40个循环。PCR循环完成后,分析熔解曲线,确定得到的PCR产物均为单一物质。采用Livak[15]的方法计算基因相对表达量。

表1 实时荧光定量PCR引物设计
1.3 数据统计
使用Origin 9.0软件绘制图表,数据采用SPSS统计软件进行分析。
2 结果与分析
2.1 外源EGCG对甜瓜白粉病抗性表型的影响
本试验通过对甜瓜叶片进行组织化学染色,分析过氧化氢(H2O2)的积累情况作为甜瓜白粉病抗性的表型。DAB染色结果显示,在接种白粉病后,甜瓜叶片的H2O2积累增加,表现为强烈的深棕色。而外源EGCG预处理的甜瓜叶片则呈浅棕色,表现出相对较少的H2O2积累量(图1)。
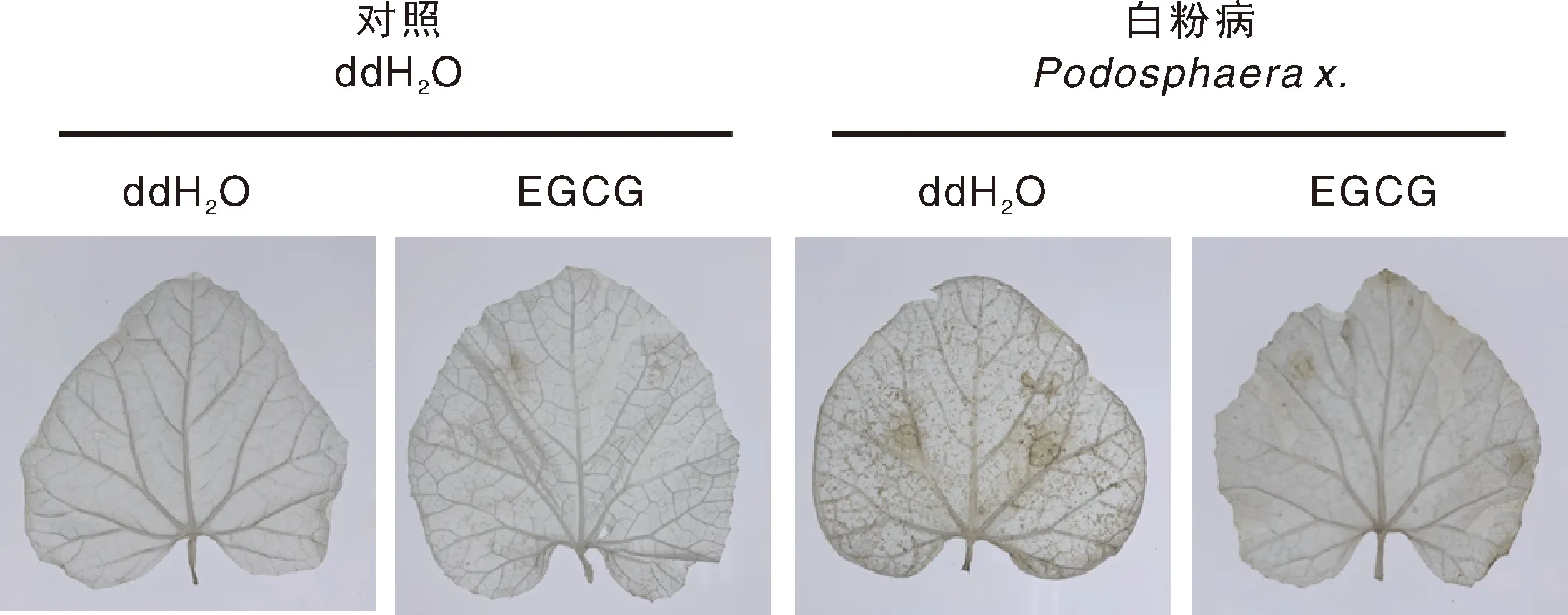
图1 外源EGCG对甜瓜白粉病抗性表型的影响
2.2 外源EGCG预处理对白粉病侵染后甜瓜幼苗MDA含量的影响
MDA是脂质过氧化的终产物,通常被认为是氧化应激或者ROS诱导的植物细胞膜损伤的标志[14]。与对照相比(清水处理),经过白粉病处理的甜瓜幼苗MDA含量均显著(P<0.05)提高;而在外源EGCG预处理后接种白粉病12 h,甜瓜幼苗的MDA含量比只接种白粉病的甜瓜幼苗显著降低,降幅为32.6%(图2)。
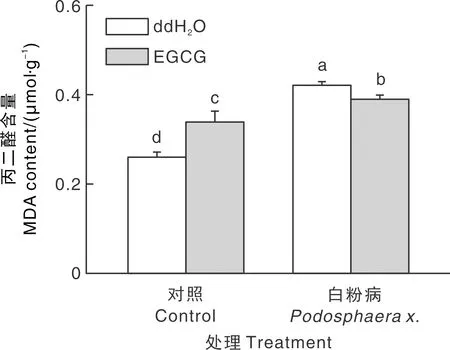
图中不同字母代表差异显著(P<0.05),下同。
2.3 外源EGCG预处理对白粉病侵染后甜瓜幼苗抗氧化酶活性的影响
植物的抗氧化酶系统在其应对各种生物胁迫和非生物胁迫中均发挥着重要作用。本研究中,对照条件下,外源EGCG处理可以在一定程度上诱导甜瓜幼苗叶片中CAT、APX、SOD和POD活性,分别提高了46.65%、130.33%、37.55%和17.60%(图3)。白粉病入侵也导致甜瓜叶片中抗氧化酶活性的显著(P<0.05)提高,其中CAT活性响应最为明显,与对照相比,提高了214.85%。在白粉病侵染的条件下,外源EGCG预处理对甜瓜叶片中的抗氧化酶活性有进一步的促进作用。与单独接种白粉病相比,外源EGCG预处理导致CAT、APX、SOD和POD活性分别提高了62.22%、60.64%、36.17%和32.56%(图3)。
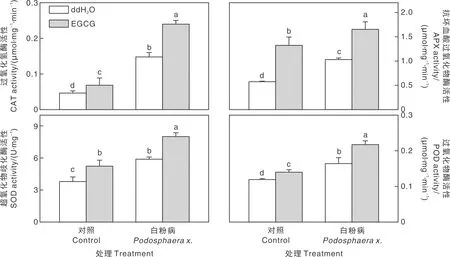
图3 外源EGCG预处理对白粉病侵染后甜瓜幼苗抗氧化酶活性的影响
2.4 外源EGCG预处理对白粉病侵染后甜瓜幼苗抗氧化酶相关基因表达的影响
进一步分析了外源EGCG预处理对白粉病侵染后甜瓜幼苗抗氧化酶相关基因表达的影响。与抗氧化酶活性的结果相一致,在经过外源EGCG预处理后,接种白粉病,甜瓜幼苗叶片中的抗氧化酶合成相关基因CmCAT、CmAPX、CmSOD和CmPOD的转录水平较其他处理均出现显著(P<0.05)上升趋势。 其中CmCAT和CmPOD最为明显。与单独接种白粉病相比,外源EGCG预处理的甜瓜幼苗CmCAT和CmPOD基因的转录水平提高了9.62倍和11.82倍(图4)。CmAPX和CmSOD基因的表达水平也分别提高了81.91%和35.88%。
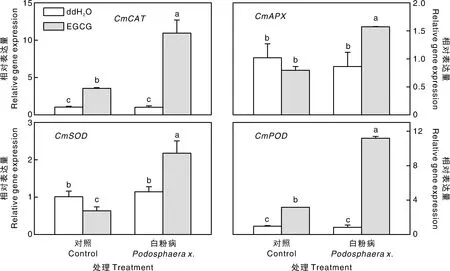
图4 外源EGCG预处理对白粉病侵染后甜瓜幼苗抗氧化酶相关基因表达的影响
3 讨论
在受到外界环境条件刺激或者遭遇病原物侵害时,植株最主要的表现是会在其体内产生氧化应激反应等生理生化过程,以提高自身对抗逆境胁迫的抗性。在之前的研究中我们发现,外源EGCG可以诱导番茄植株抗氧化酶活性,缓解氧化应激[15],对提高番茄幼苗对盐胁迫的耐受性发挥着重要作用。同时,EGCG可以作为一种广谱非生物胁迫抗性诱导物质,缓解番茄对冷害、高温胁迫、干旱等的抗性[14]。然而,外源EGCG在植物应对生物胁迫中的作用及其调控机理仍不清楚。本试验研究表明,外源EGCG显著降低了甜瓜遭遇白粉病后的甜瓜幼苗叶片中H2O2的积累和MDA含量,并伴随相关抗氧化酶活性和合成基因表达量的上调。这表明外源EGCG增强了白粉病菌感染后甜瓜幼苗的抗氧化能力,减少了ROS的积累,从而提高了甜瓜对白粉病的抗性。
MDA是多不饱和脂肪酸的分解产物,MDA含量的高低展示的是植物脂膜过氧化的严重程度,过量的MDA会使植物存在膜损伤现象,引起植物组织坏死甚至死亡[16-17]。前人研究发现,伴生小麦能够提高西瓜根系的抗氧化酶活性[18],减少MDA含量,提高西瓜对枯萎病的抗性。本试验中,在接种白粉病后,MDA含量显著上升,表明白粉病入侵将导致甜瓜幼苗的膜脂过氧化程度提高。而经过外源EGCG处理的甜瓜幼苗的MDA含量显著下降。这表明,外源EGCG可以减缓脂膜过氧化现象,防止植物细胞膜氧化损伤,维持正常的生命状态,提高了甜瓜对白粉病的抗性。
近年来,研究普遍,植物中的H2O2具有双重作用[19-20],一方面,高浓度的H2O2被认为是ROS,过量产生的ROS可诱导生物分子的氧化损伤,造成植物的氧化胁迫[19-20]。另一方面,瞬时和特异性的H2O2积累是各种植物发育和应激反应过程中的信号物质,可以诱导植物的抗逆性[21]。在研究中,白粉病侵染诱导甜瓜叶片中ROS的大量积累,ROS过度累积会扰乱光合活性和细胞完整性,造成叶片的膜脂过氧化程度加重。此外,研究还发现,外源EGCG可以诱导的甜瓜叶片中少量H2O2积累,而在白粉病侵染的条件下,外源EGCG预处理可以减少ROS积累改善植株受胁迫程度。这表明,在正常条件下,外源EGCG诱导H2O2积累可能作为信号物质,参与了对甜瓜抗氧化酶系统的调控。相关结果与前期研究中发现的,外源EGCG通过诱导H2O2信号提高番茄对非生物胁迫的广谱抗性相一致。
在植物组织中,ROS的清除能力在很大程度上归因于抗氧化酶活性的强弱。本研究表明,在正常条件下,外源EGCG对CAT、APX、SOD、POD活性均有显著促进作用。在白粉病侵染后,植物的抗氧化酶活性均显著增强,表明植物通过提高自身的应激响应以清除病原菌入侵引发的ROS积累。这表明,在遭受生物胁迫时,植物的抗氧化酶系统发挥了重要的作用。同时,研究还发现,外源EGCG预处理可以进一步提高患白粉病甜瓜叶片中CAT、APX、SOD、POD的活性。
CmCAT、CmPOD、CmAPX和CmSOD基因的定量表达分析表明,CmCAT和CmPOD的表达模式与CAT和POD的活性相一致,都不同程度地被外源EGCG诱导上调。而CmAPX和CmSOD仅在遭受白粉病侵染后,被外源EGCG诱导上调表达。本研究中,CmCAT、CmPOD、CmAPX和CmSOD基因表达没有受到白粉病侵染的诱导,可能是由于相关基因家族在病害诱导时容易受到反馈调节[22],而外源EGCG处理则能在白粉病侵染时进一步诱导抗氧化酶相关基因表达。
上述研究进一步证实,外源EGCG诱导了甜瓜叶片中抗氧化酶活性从而提高了甜瓜对白粉病的抗性,这与前人的研究结果基本一致[23]。然而,外源EGCG诱导的信号如何在转录水平上调控抗氧化酶活性还有待进一步研究。
