利口葡萄酒混浊物结构及其蛋白组分鉴定分析
2023-02-21李雯陈彦雄赵圆圆李蔚张珍杜建明张生祥王丽
李雯,陈彦雄,赵圆圆,李蔚,张珍*,杜建明,张生祥,王丽
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)2(甘肃祁连葡萄酒业有限公司,甘肃 张掖,734000)
根据国际葡萄与葡萄酒组织的规定,利口葡萄酒是由葡萄汁(包括部分发酵的葡萄汁)经添加蒸馏酒等原料调配而成的一种酒精度在15% vol~22% vol的特种葡萄酒,其酒体含有一定的蛋白质、酚类、果胶等大分子物质及其络合物,贮藏和运输过程中容易发生混浊或者轻微的沉淀现象[1],导致消费者对产品质量产生质疑,很大程度上阻碍了利口葡萄酒产业的良好发展。
近年来,许多研究者已对白葡萄酒混浊的可能原因进行了分析报道。研究发现,蛋白质可能导致葡萄酒胶体不稳定,形成无定型沉淀物或絮凝物,并在装瓶前或装瓶后产生悬浮和不良的混浊物,是造成白葡萄酒不稳定的主要因素[2]。相关报道[3-5]显示,类甜蛋白(VVTL1)亚型是白葡萄酒混浊形成的主要因素;干白葡萄酒不稳定主要是酒体中类甜蛋白作用的结果,蛋白质稳定时其二级结构是二硫键、α-螺旋和β-折叠;几丁质酶会产生更高水平的聚集,是导致白葡萄酒出现不稳定现象的主要蛋白。课题组前期试验表明,以‘赛美蓉’葡萄品种为原料,通过酒精发酵酿造‘赛美蓉’白葡萄酒后,添加‘赛美蓉’葡萄汁、‘白玉霓’白兰地以及‘贵人香’冰酒调配得到的利口葡萄酒经长期放置后产生了轻微的混浊现象,导致利口葡萄酒品质下降,影响了利口酒的感官质量[6]。然而,目前关于以白葡萄品种为原料生产的利口葡萄酒中混浊物的研究鲜有报道,尤其对利口葡萄酒混浊物结构及蛋白组分的研究尚未见报道。
因此,本文研究了利口葡萄酒陈酿6个月后混浊物的形态与结构、主要成分及其蛋白组成,旨在探究引起利口葡萄酒混浊的主要蛋白种类,为解决利口葡萄酒混浊问题提供理论参考,以促进利口酒产业的发展,为消费者提供更优质的产品。
1 材料与方法
1.1 实验材料
‘赛美蓉’葡萄(糖度24.6 Brix°),于2020年采自祁连的葡萄酒业种植基地;‘白玉霓’白兰地(酒精度51% vol),甘肃省葡萄酒产业技术研发中心;‘贵人香’冰酒(酒精度9% vol),祁连葡萄酒业公司。
乙腈(ACN,质谱级),Fisher Chemical公司;甲酸(FA,质谱级)、NH4HCO3(质谱级)、二硫苏糖醇(dithiothreitol,DTT,分析纯)、碘乙酰胺(iodoacetamide,IAA,分析纯)、三氟乙酸(trifluoroacetic adic,TFA,分析纯),Sigma-Aldrich公司;胰蛋白酶(测序级),Promega公司;总糖和还原糖检测试剂盒(DNS比色法),上海源叶生物科技有限公司;其他试剂均为分析纯。
1.2 主要仪器
Easy-nLC 1200毛细管高效液相色谱仪、Q Exactive电喷雾-组合型离子阱Orbitrap质谱仪,美国Thermo Fisher Scientific公司;Concentrator plus真空离心浓缩仪,德国Eppendorf公司;H-1850R台式高速冷冻离心机,湘潭湘仪仪器有限公司。
1.3 实验方法
1.3.1 利口葡萄酒的酿制
1.3.1.1 利口葡萄酒生产工艺
‘赛美蓉’葡萄→挑选→破碎→添加SO2→添加果胶酶→除去沉淀→添加膨润土→降温澄清→过滤→装罐→接种酵母→酒精发酵→终止发酵→陈酿→调配→贮藏→取样分析
1.3.1.2 ‘赛美蓉’葡萄酒酿造
挑选成熟度一致的‘赛美蓉’葡萄除梗破碎后,向葡萄汁中均匀添加60 mg/L SO2(以亚硫酸钠计)和35 mg/L果胶酶,迅速降温,于10 ℃静置8 h。澄清后分离沉淀,并加入600 mg/L膨润土,在2 ℃条件下继续静置4 d后,分离沉淀。以0.2 g/L添加量接种酿酒酵母,(20±1) ℃条件下进行酒精发酵,发酵结束后将发酵基酒于14~16 ℃陈酿1~2个月。
1.3.1.3 利口葡萄酒配制
参考丁凯等[6]优化的调配参数,以‘赛美蓉’白葡萄酒、‘白玉霓’白兰地、‘贵人香’冰酒、和‘赛美蓉’葡萄汁为原料,配制‘赛美蓉’利口葡萄酒。
1.3.2 利口葡萄酒混浊物的分离
利口葡萄酒低温贮藏6个月,2 296×g离心10 min,用冷冻干燥机将离心后的沉积物干燥,密封并储存在-20 ℃条件下,进行检测分析。
1.3.3 利口葡萄酒混浊物形貌和结构表征
1.3.3.1 扫描电子显微镜(scanning electron microscope,SEM)观察
将少量混浊物冻干粉分散在样品座上,用离子溅射仪镀金60 s,通过SEM观察混浊物在不同倍数下的表面形貌。
1.3.3.2 X射线衍射(X ray diffraction,XRD)分析
采用XRD对混浊物物相结构进行测定分析,扫描范围10~80°;扫描速度1°/min;扫描步长0.01。
1.3.3.3 傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析
采用FT-IR对混浊物化学结构进行测定分析,扫描范围4 000~400 cm-1,分辨率4 cm-1。
1.3.4 利口葡萄酒混浊物成分测定
参考WU等[7]的方法并略做修改。将0.02 g混浊物溶于10 mL 5 mmol/L NaOH溶液中,并在摇床中120 r/min培养20 min,使用1 mol/L HCl溶液调整pH至(7.0±0.2),分析其成分。
1.3.4.1 混浊物中蛋白含量的测定
参考BRADFORD[8]的方法,采用考马斯亮蓝法进行测定。
1.3.4.2 混浊物中总酚含量的测定
参考王华[9]的方法,采用Folin-Ciocalteu比色法进行测定。
1.3.4.3 混浊物中总糖含量的测定
参考总糖和还原糖检测试剂盒(DNS比色法)测定。
1.3.5 利口葡萄酒混浊物蛋白分离鉴定
1.3.5.1 聚丙烯酰胺凝胶电泳
将混浊物冻干粉溶解于ddH2O,取V(样本)∶V(加载缓冲液)=1∶5混合,沸水中加热5 min后,将样品和marker加入质量分数12%分离胶的孔中,盖上顶盖,连接电极。电压设定为80 kV,运行15 min,随后将电压设定为120 kV,继续运行15 min。取下胶板,将剥离胶浸入考马斯亮蓝染液中,室温下染色1 h,添加脱色液,放入摇床(80 r/min)进行脱色,每20 min置换1次脱色液,直至彻底脱净。
1.3.5.2 胰蛋白酶酶解
(1)胶粒脱色:将目的条带切成1 mm3的胶粒,分别装入1.5 mL离心管中。使用[V(ACN)∶V(50 mmol/L NH4HCO3)=1∶1]溶液脱色,放置10~30 min吸出弃去,重复此操作至胶粒无色。
(2)胶粒脱水:加入100 μL 100% ACN,放置30 min,待胶粒呈白色索状至团状,弃去ACN,室温放置干燥。
(3)还原烷基化:各离心管加入100 μL 10 mmol/L DTT于56 ℃水浴中还原1 h,吸出弃去。然后各管加入100 μL 55 mmol/L IAA,暗处室温反应1 h,吸出弃去。加脱色液[V(ACN)∶V(50 mmol/L NH4HCO3)=1∶1]洗1遍,吸出弃去,继续加入100 μL 100% ACN,放置30 min,待胶粒呈白色索状至团状,弃去ACN,室温放置干燥。
(4)酶切:各管加入7~10 μL 15 ng/μL的酶(用50 mmol/L NH4HCO3稀释),放入4 ℃冰箱孵育40 min,取出后各管补加5~10 μL 50 mmol/L NH4HCO3溶液,密封置于37 ℃水浴中酶切16 h。
(5)肽段提取:各管加入100 μL提取液[V(TFA)∶V(ACN)∶V(H2O)=1∶10∶9],37 ℃水浴1 h后,超声5 min,离心5 min,分离提取液后重复提取1次,合并提取液,真空离心干燥。
(6)脱盐:酶切后的肽段经自填脱盐柱脱盐后,置于真空离心浓缩仪(45 ℃)中至溶剂挥发完全。
1.3.5.3 LC-MS/MS检测
毛细管液相色谱条件:流动相A为0.1%甲酸(体积分数,下同),流动相B为0.1%甲酸,80% ACN(体积分数),流速600 nL/min,各组分的分析时间为66 min。
质谱条件:一级质谱设定:分辨率70 000m/z,AGCtarget:3e6,MaximumIT:100 ms,扫描范围300~1 800m/z;二级质谱设定:分辨率17 500m/z,AGCtarget:1e5,MaximumIT:50 ms,TopN:20,扫描范围200~2 000m/z。采用Maxquant(1.6.2.10)数据库查找匹配目标蛋白。
1.4 数据分析
所有测试均重复进行3次,运用Origin 2018进行绘图,SPSS 22对数据进行统计分析(P<0.05),数据用均值±标准差表示。
2 结果与分析
2.1 利口葡萄酒混浊物形貌分析
利口葡萄酒中混浊物通常是在贮藏过程中产生的,慢慢沉降到瓶底,形成棕色颗粒。一些混浊物颗粒附着在瓶壁上,形成不完整的薄膜。由图1可见,利口葡萄酒混浊物外观不规则,边缘光滑(图1-a)。当在更大的放大倍数下(图1-b)混浊物具有层状结构。小的层堆积成大的层,大的层堆积成更大的层。

a-×5 000;b-×10 000图1 利口葡萄酒混浊物的SEM图Fig.1 SEM image of haze in liqueur wine
2.2 利口葡萄酒混浊物XRD分析
如图2所示,非晶原子在小衍射角区域有序,在大衍射角区域无序。在2θ值为19.5°时,发现典型的非晶态漫散衍射峰,说明混浊物中的配位原子密度很高,相应的非晶散射信号很强。在高衍射角区域(2θ>20°)没有观察到明显的衍射信号。
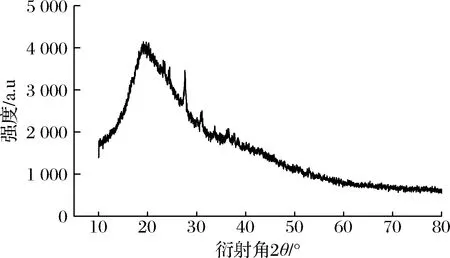
图2 利口葡萄酒混浊物的XRD图Fig.2 XRD image of haze in liqueur wine
2.3 利口葡萄酒混浊物FT-IR分析


图3 利口葡萄酒混浊物的FT-IR图Fig.3 FT-IR spectrum of haze in liqueur wine
2.4 利口葡萄酒混浊成分分析
在利口葡萄酒贮藏过程中,蛋白质和多酚化合物结合并进一步聚集,形成共轭物,可能会导致沉淀[12]。如表1所示,利口葡萄酒混浊物中蛋白质含量相对最高,达(114.70±0.51) mg/g,显著高于总酚和总糖的含量(P<0.05),主要原因可能是试验所用利口葡萄酒原料均由白葡萄品种组成,这与以往关于蛋白质是引起白葡萄酒混浊主要原因的研究结论相符[4]。
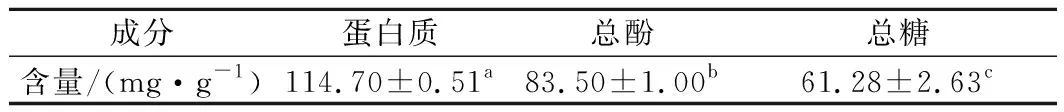
表1 利口葡萄酒混浊物主要成分含量Table 1 Content of main components of haze in liqueur wine
2.5 利口葡萄酒混浊物蛋白LC-MS/MS鉴定分析
2.5.1 混浊物肽段及蛋白分子质量分析
本试验中,LC-MS/MS共鉴定到利口葡萄酒混浊物蛋白90个,肽段111条,其中唯一肽段数为1条的蛋白数量高达84种,极少数蛋白的唯一肽段数量达8条(图4-a)。对蛋白分子质量数据进行分析发现,大多数蛋白分子质量分布在10~70 kDa(图4-b),且20~30 kDa蛋白数目高达21种,说明利口葡萄酒混浊物蛋白主要由低分子质量蛋白组成,该研究结果与张明霞[13]的报道相一致。

a-唯一肽段分布;b-蛋白分子质量分布图4 利口葡萄酒混浊物蛋白唯一肽段及分子质量分布Fig.4 Unique peptides and molecular mass distribution of haze protein in liqueur wine
2.5.2 混浊物主要组成蛋白分析
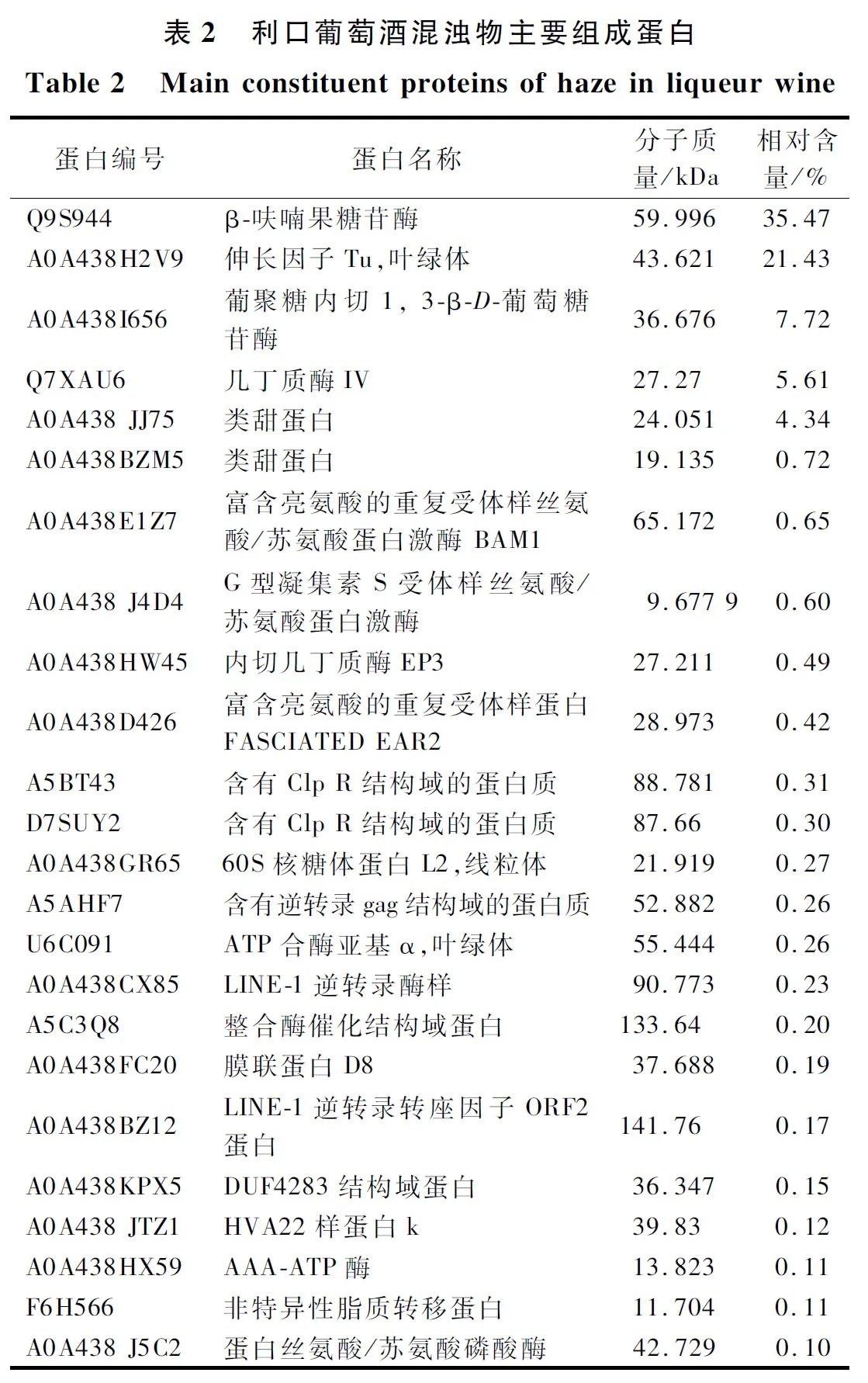
由表2鉴定结果可知,利口葡萄酒混浊物中蛋白分子质量为9~142 kDa,主要为β-呋喃果糖苷酶(35.47%)、叶绿体内相关蛋白生长因子Tu(21.43%)、葡聚糖内切1, 3-β-D葡萄糖苷酶(7.72%)和病程相关蛋白(几丁质酶、类甜蛋白、非特异性脂质转移蛋白),此外还含有酶类和线粒体内相关蛋白。其中几丁质酶、类甜蛋白和脂质转移蛋白被认为是果汁和葡萄酒中典型的病程相关蛋白,且与混浊形成有关[14],可能是引起利口葡萄酒混浊的主要蛋白。
3 讨论
本研究通过对利口葡萄酒混浊物形貌、结构和成分组成进行分析,初步探究了引起利口葡萄酒混浊的可能原因,试验结果表明,混浊物中蛋白和总酚占据一定的比例,试验中考虑到蛋白含量相对较高,进而采用LC-MS/MS对混浊物蛋白进行了鉴定分析,以便进一步讨论造成利口葡萄酒混浊的主要蛋白。
蛋白鉴定发现利口葡萄酒混浊物中含有几丁质酶、类甜蛋白和非特异性脂质转移蛋白3类病程相关蛋白。研究表明,病程相关蛋白是引起葡萄酒混浊的主要蛋白,该类蛋白在酿酒过程中高度稳定,但其中一些会随着时间的推移和温度的升高而沉淀[15]。其中,类甜蛋白和几丁质酶在葡萄发育的所有阶段都有表达,它们的耐热性使其容易受到变性和复性过程的影响,是促进分子聚集的基础,且除了这2类致浊蛋白外,β-1, 3-葡聚糖酶、成熟相关蛋白grp22和脂质转移蛋白也被认为与混浊形成有关[16-17]。FALCONER等[18]研究发现,几丁质酶是‘长相思’和‘赛美蓉’葡萄酒混浊的主要原因,而类甜蛋白是仅次于几丁质酶并可能会导致葡萄酒混浊的第二类蛋白,该报道与本研究结果相似。因此,几丁质酶、类甜蛋白和非特异性脂质转移蛋白可能是引起利口葡萄酒混浊的主要蛋白。
同时,当蛋白质发生解折叠和聚集时,蛋白质类型将影响最终聚集物的特性。本研究观察发现利口葡萄酒混浊物由大小不一、不规则颗粒聚集形成,这可能是因为类甜蛋白和几丁质酶形成的颗粒大小不同[5],一些类甜蛋白亚型具有热不稳定性且会发生可逆变性,优先与多糖、酚类化合物和亚硫酸盐离子相互作用[19],倾向于形成肉眼不可见的亚稳态的微团聚集体(在正常葡萄酒离子强度下<150 nm),而几丁质酶以其不可逆展开而闻名[20],可以快速絮凝并产生清晰可见的大的聚集体(≥1 μm)[21]。
此外,本研究发现混浊物蛋白中含有一些酶类,如富含亮氨酸的重复受体样丝氨酸/苏氨酸蛋白激酶BAM1和G型凝集素S受体样丝氨酸/苏氨酸蛋白激酶,该类酶是植物基因中已知的一类跨膜类受体激酶[22],其能转移出ATP中的磷酸,通过共价键与特定蛋白质中的某些丝氨酸、苏氨酸或酪氨酸残基的羟基相结合,进而使蛋白质和酶的构象及活性发生改变。有学者报道,几丁质酶含有较高的丝氨酸含量,类甜蛋白含有较高比例的苏氨酸、赖氨酸和精氨酸残留量[23]。然而,即使利口葡萄酒中存在该类蛋白激酶可能会有利于利口葡萄酒的蛋白稳定性,但在实际生产中,为获得品质稳定的高质量利口葡萄酒,添加一定的澄清剂依旧十分必要。目前在商业酿酒中,蛋白质的稳定性几乎是通过添加膨润土来实现的,但蛋白质结合的膨润土是以酒糟的形式松散地沉降到酒罐底部,约占原始葡萄酒体积的3%~10%[24]。从膨润土酒糟中回收葡萄酒的方法费力且会造成葡萄酒体积损失,甚至可能会降低葡萄酒的质量[25]。因此,研究利口葡萄酒中混浊蛋白的种类及其特性,指导生产商在实际生产中使用针对性的蛋白酶或采取一定的生产技术对预防利口葡萄酒混浊具有一定的参考价值。
4 结论
利口葡萄酒混浊物颗粒大小不一、边缘光滑,其含有蛋白和酚类等物质,且蛋白含量为(114.70±0.51) mg/g,显著高于总酚和总糖含量(P<0.05)。几丁质酶(27 kDa)、类甜蛋白(24 kDa)和非特异性脂质转移蛋白(11 kDa)3类病程相关蛋白可能为引起利口葡萄酒混浊的主要蛋白。此外,蛋白如何与多酚和多糖等成分相互作用影响利口葡萄酒的品质有待进一步研究。
