红螯螯虾CHH2基因的表达特征及其在卵巢发育中的功能
2023-02-21陈乐然郑建波贾永义迟美丽刘士力刘一诺蒋文枰顾志敏
陈乐然,郑建波,贾永义,迟美丽,李 飞,程 顺,刘士力,刘一诺,蒋文枰,顾志敏
(1.上海海洋大学 水产与生命学院,农业农村部淡水水产种质资源重点实验室,上海 201306; 2.浙江省淡水水产研究所 农业农村部淡水渔业健康养殖重点实验室,浙江省淡水水产遗传育种重点实验室,浙江 湖州 313001)
X-器官-窦腺复合体(XO-SG)是甲壳类动物最重要的神经内分泌器官,它的主要功能是合成与分泌大量神经肽激素,类似于脊椎动物的下丘脑垂体系统[1]。其中,甲壳类高血糖激素神经肽家族(CHH/MIH/GIH/MIOH)是XO-SG分泌最多的激素 ,已被证明参与甲壳动物的多种生理活动。研究表明,高血糖激素基因(CHH)可以调节甲壳类动物渗透压、血糖代谢和变态过程[2-4]。此外,CHH还与甲壳动物的繁殖和蜕皮有关[5]。目前已在多个甲壳类动物中鉴定获得高血糖激素肽序列,包括龙虾[6]、螃蟹[7-8]、小龙虾[9-10]、对虾等[11-12]。
在十足目甲壳类动物中,眼柄切除被认为是促进卵巢成熟和产卵最有效的手段,主要是眼柄切除干扰XO-SG分泌性腺抑制激素[13]。尽管切除眼柄能明显促进卵巢发育,但仍存在一些问题:1)术后雌虾死亡率高且只能使用1次,卵子成熟质量差、繁育效率低;2)眼柄切除促进卵巢发育的分子机制知之甚少,制约甲壳类动物养殖业的可持续发展[14]。因此,研究CHH在甲壳类动物卵巢发育中的作用有重要意义。
红螯螯虾(Cheraxquadricarinatus)俗称澳洲淡水龙虾,隶属于节肢动物门(Arthropoda)甲壳纲(Crustacea)十足目(Decapoda)拟螯虾科(Parastacidae)光壳虾属(Prawns),是一种具有重要商业价值的淡水经济虾类,原产于澳大利亚北部和新几内亚南部[15-16]。近年来,红螯螯虾由于其肉质鲜美、适应性强等优点,在我国养殖规模和产量不断扩大。然而,相对于其他经济虾类,红螯螯虾怀卵量少,为300~700颗,导致幼苗价格高昂,限制了该产业的快速发展。为此,着力开展与促进红螯螯虾卵巢发育成熟和排卵相关的研究,对建立苗种规模化繁育技术体系有十分重要的意义。
高血糖激素作为甲壳动物眼柄神经节中含量最为丰富并且被研究最多的神经肽,探索其在甲壳动物生长繁殖中的作用广受关注[17]。已从红螯螯虾中分离到CHH基因的几种亚型,包括CHH1、CHH2、CHH-B等。本研究主要报道CHH2基因的基因组结构及其生物信息学分析结果。此外,通过实时荧光定量PCR(qRT-PCR)检测CHH2在不同组织和卵巢发育不同时期的表达水平。最后,通过体内注射双链RNA观察抑制CHH2后对红螯螯虾卵巢发育标记基因VTG表达水平的影响。研究结果将有助于揭示红螯螯虾卵巢发育调控机制,也可为实现规模化苗种繁育提供理论支撑。
1 材料与方法
1.1 实验样本
实验用到的红螯螯虾材料均来自浙江省淡水水产研究所八里店实验养殖基地,暂养于28 ℃水箱中,3 d后分别选相应雌雄虾(10月龄,平均体重55 g)进行解剖,取卵巢、精巢、心、肝胰腺、肌肉、鳃和肠。基于实验室原先的切片结果确定卵巢发育时期划分标准,包括OⅠ-未发育(GSI:0.11)、OⅡ-发育期(GSI:0.18)、OⅢ-快速发育期(GSI:0.32)、OⅣ-成熟期(GSI:0.66)。各时期样本采集完之后立即储存于液氮中,用于后续的核酸提取。
1.2 总RNA提取与cDNA合成
使用TRIzol法提取不同发育阶段卵巢与成虾各个组织的总RNA,通过1%琼脂糖凝胶电泳和Nanodrop 2000c分光光度计检测总RNA的质量和浓度,选择无降解、质量好的RNA,使用PrimeScriptTMRT试剂盒和gDNA Eraser(TaKaRa,日本),每个样品取大约0.1 μg总RNA用于cDNA第一链合成。
1.3 生物信息学分析
根据GenBank数据库已提交的CHH2编码区序列(GenBank Accession No. MH210971),结合实验室已组装完成的红螯螯虾全基因组序列,将CHH2编码区序列作为搜索序列进行本地Blast,直接进行基因结构分析,预测外显子和内含子组成。使用ORF Finder程序(https://www.ncbi.nlm.nih.gov/orffinder/)预测CHH2的开放阅读框(ORF),推导出分子量和等电点(pI)。使用Expasy-PortParam(http//web.expasy.org/translate/)推导CHH2氨基酸序列,并预测分子量和等电点(pI)。通过DNAMAN软件对不同物种的CHH蛋白序列进行多重比对分析,同时利用MEGA5软件通过邻接法构建系统发育树,bootstrap设置为1 000。本研究中使用的蛋白序列如表1所示,使用的所有引物如表2所示。
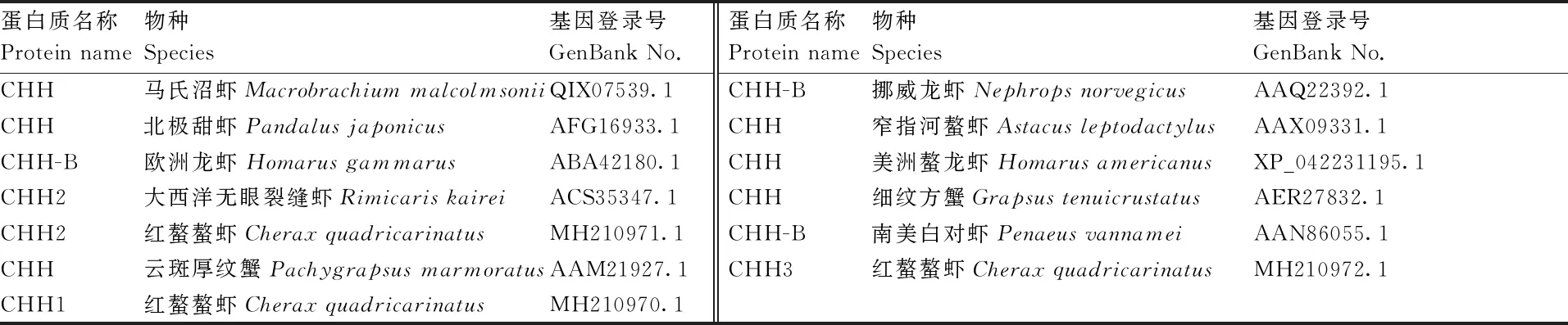
表1 序列比对与系统进化分析所用CHH蛋白质序列

表2 基因克隆与表达分析所用引物
1.4 实时荧光定量PCR(qRT-PCR)分析
提取不同成虾组织与不同发育时期雌虾的卵巢样本RNA,反转录获得cDNA,再通过qRT-PCR进行基因表达分析。反应体系10 μL:5 μL SYBR Premix Ex-TaqTM(Takara,日本),每种引物0.5 μL(2.5 μmol·L-1),3 μL ddH2O和1 μL cDNA模板,每个样本设3个重复。qRT-PCR以红螯螯虾β-actin基因作为内参,通过2-ΔΔCT法计算相对表达水平[18]。
1.5 眼柄切除实验
为研究眼柄切除对红螯螯虾卵巢CHH2基因表达的影响,使用烧红的镊子摘除雌性红螯螯虾的右侧眼柄。在切除眼柄后的不同时间段,通过qRT-PCR分析CHH2的表达水平。本实验选取两组雌性红螯螯虾(每组20只):第一组进行单侧眼柄切除,设为实验组,第二组为未切除眼柄螯虾,设为对照组。在眼柄切除后12、24 h两组各收集5只红螯螯虾,解剖取卵巢进行RNA提取、反转录和qRT-PCR分析。
1.6 RNAi沉默CHH2 基因表达
使用T7 High Yield RNA Transcription Kit试剂盒(Vazyme,中国)在体外合成CHH2和EGFP的双链RNA,检测dsRNA的浓度和质量,然后保存至-20 ℃备用。将20只成年雌性红螯螯虾分为两组:实验组(n=10)以5 μg·g-1体重的剂量注射CHH2 dsRNA,对照组注射等剂量EGFP-dsRNA,通过qRT-PCR分析红螯螯虾注射dsRNA后24 h对2个靶基因CHH2和VTG表达水平的影响。
1.7 数据分析
2 结果与分析
2.1 红螯螯虾CHH2基因生物信息学分析
红螯螯虾CHH2基因全长cDNA序列为918 bp,包括111 bp的5′-UTR和393 bp的3′-UTR,编码137个氨基酸残基,理论等电点(pI)为8.50,分子量为15.19 ku。基于目前组装的全基因组序列(基因组大小约为3.95 G,N50为33 Mb),预测到红螯螯虾CHH2基因由2个外显子和1个内含子组成。使用DNAMAN软件对不同甲壳动物的CHH直系同源蛋白进行多重序列比对,结果发现,它们具有非常高的相似性,所有蛋白质序列的平均相似度高达66.84%(图1)。系统发育结果显示,所选甲壳动物CHH蛋白主要分为2个分支,龙虾类物种聚集在一个分支中,其他甲壳类动物聚集在另一个分支中。其中,红螯螯虾CHH和窄指河螯虾(Astacusleptodactylus)的同源性最高(图2)。
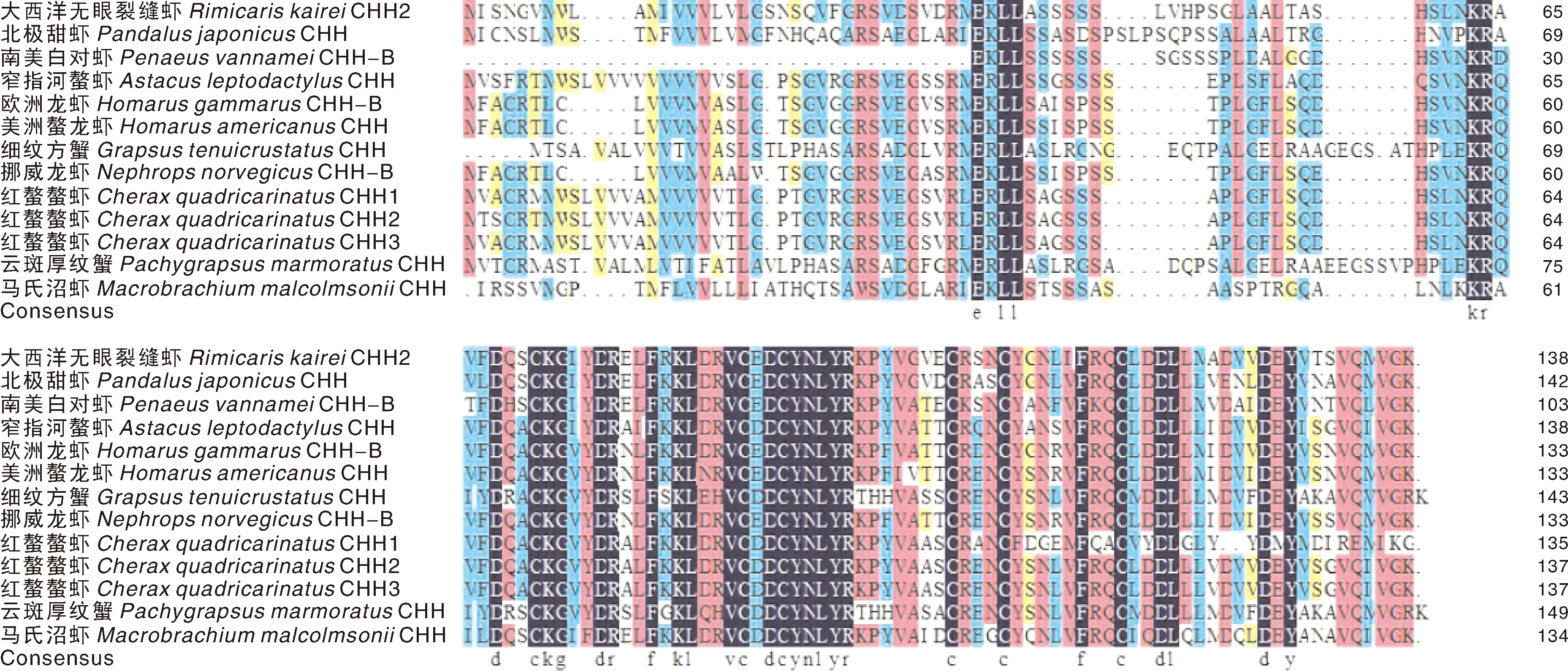
图1 红螯螯虾CHH2氨基酸多重序列比对

图2 基于不同物种CHH蛋白序列的系统进化树
2.2 红螯螯虾CHH2基因的组织特异性
qRT-PCR结果显示,CHH2基因在卵巢的表达水平显著高于其他组织,在肝胰腺中几乎未检测到。除性腺外,雌雄个体的其他组织中CHH2基因表达水平没有明显差异(图3)。
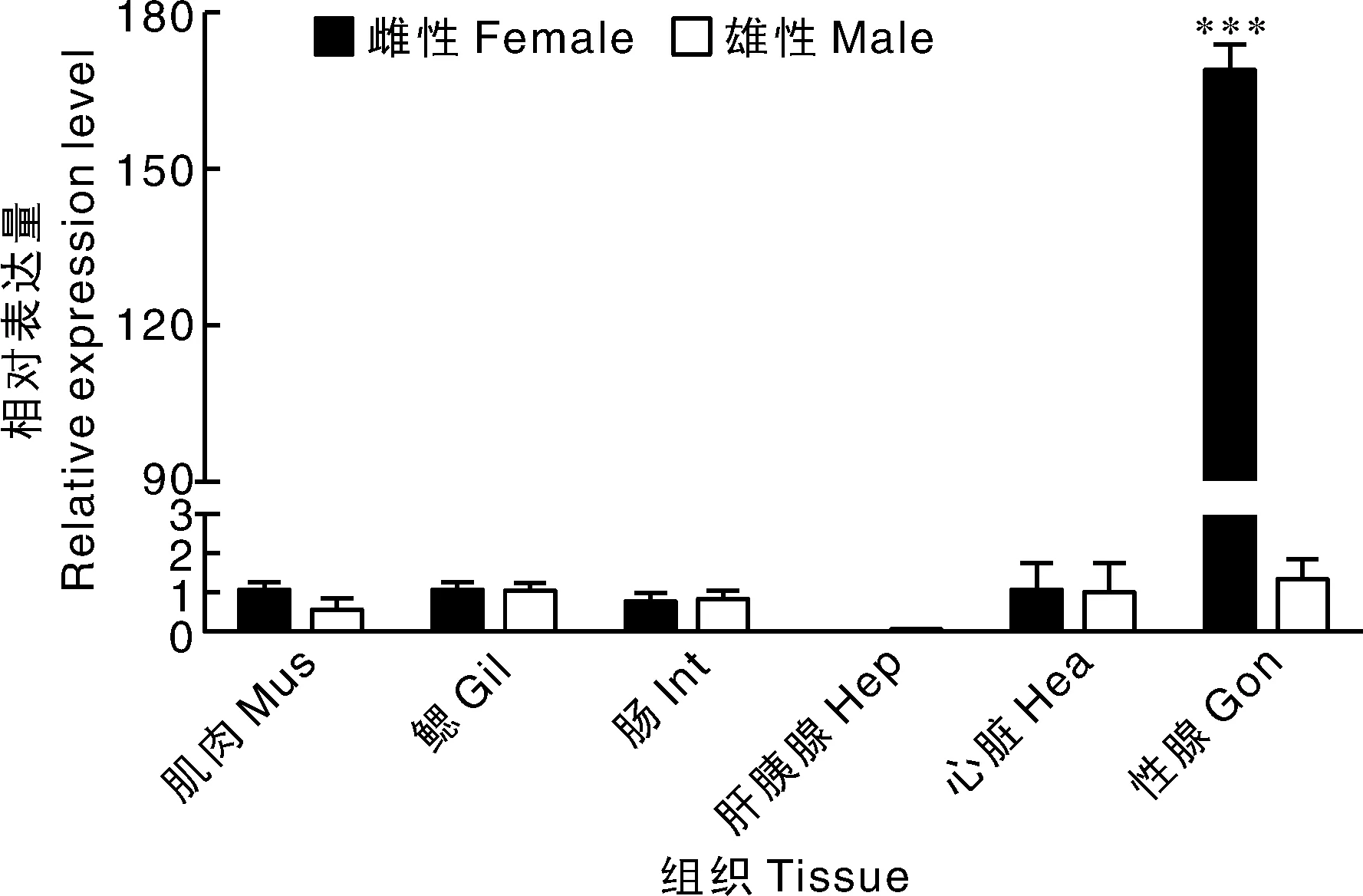
***表示差异极显著(P<0.001)。
2.3 CHH2在卵巢不同发育阶段的表达水平
鉴于CHH2 mRNA在卵巢中的表达水平最高,提示其可能在卵巢发育中起重要作用。用qRT-PCR检测CHH2在红螯螯虾卵巢不同发育时期的相对表达水平,结果表明,从未发育期到发育期CHH2表达水平增加,在快速发育期下降,直至卵巢发育成熟期降至最低水平(图4)。
2.4 单侧眼柄切除对CHH2基因表达的影响
已有研究表明,切除眼柄可促进虾蟹类性腺发育与成熟,qRT-PCR检测结果(图5)显示,在眼柄切除后12 h和24 h,红螯螯虾卵巢CHH2基因的相对表达水平均显著低于对照组。
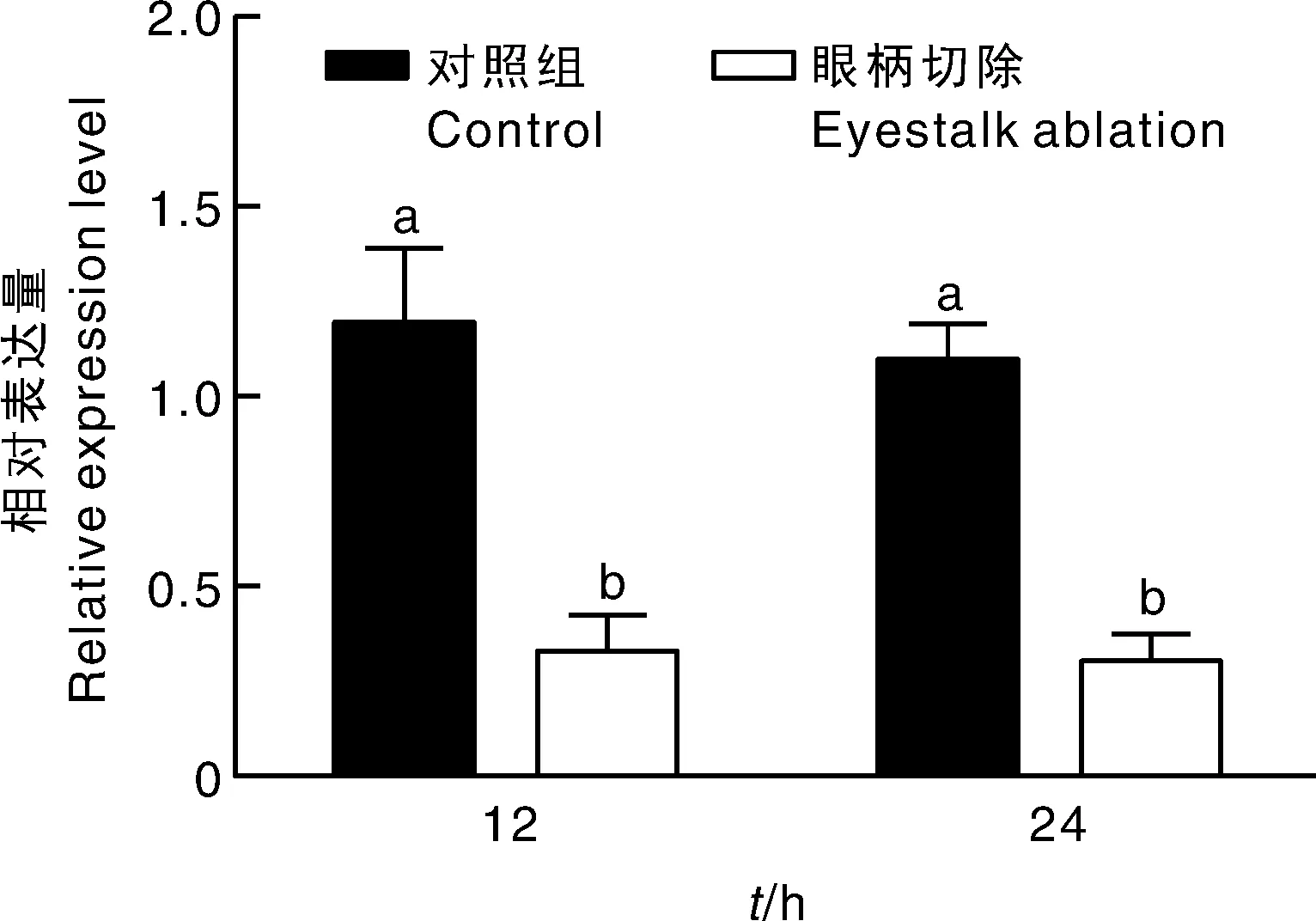
图5 切除单侧眼柄后不同时间段CHH2的表达情况
2.5 靶向沉默CHH2基因对VTG基因表达的影响
通过注射dsRNA特异性沉默CHH2基因后,卵巢中CHH2基因表达水平显著下降,沉默效率为80%,表明注射dsRNA进行CHH2基因沉默是成功的。在CHH2基因被沉默后,VTG转录水平显著上升,进一步揭示CHH2在卵巢发育中可能起负调控作用(图6)。
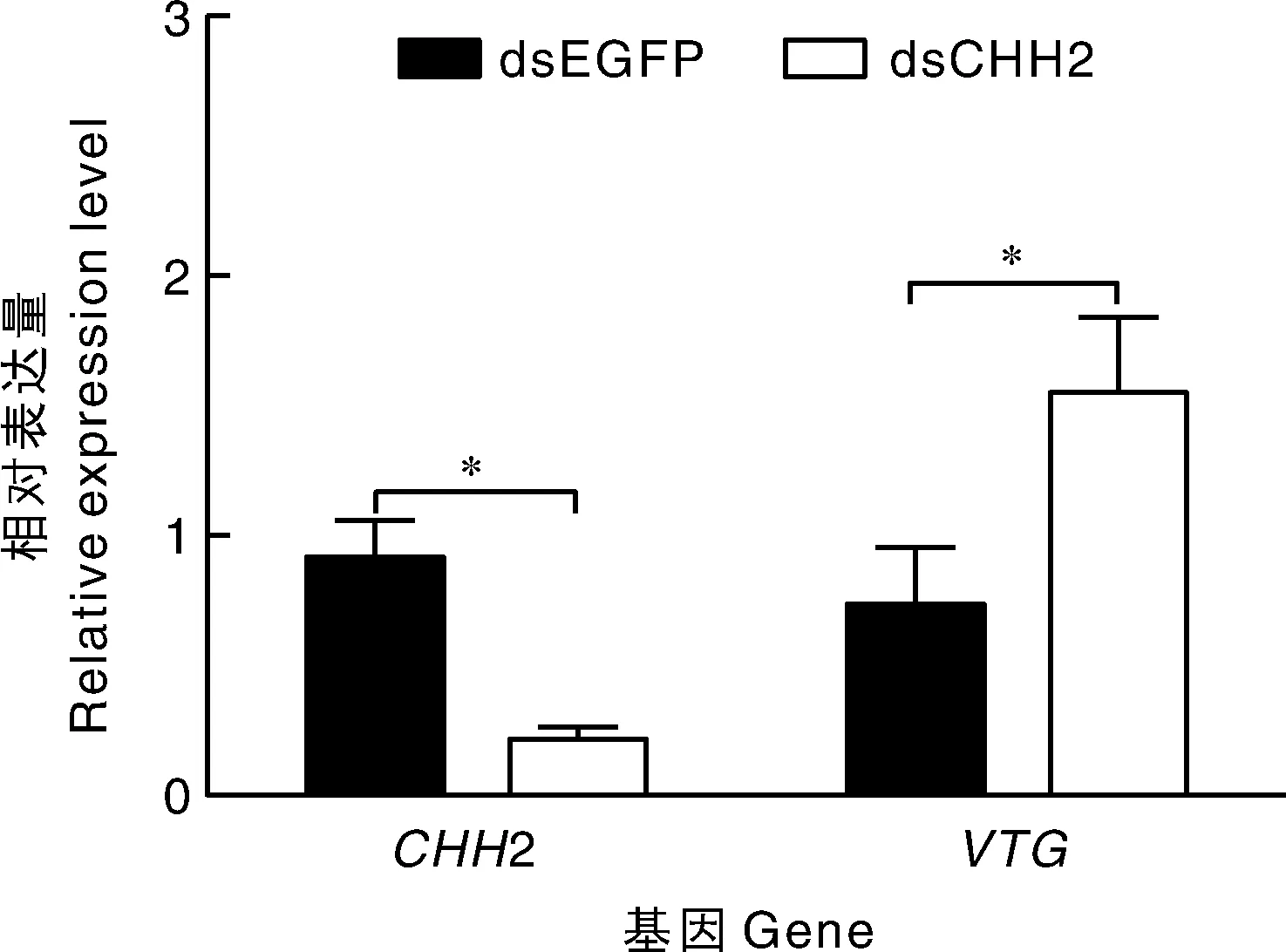
图6 CHH2基因沉默后CHH2和VTG的表达水平
3 讨论
CHH家族神经肽是眼柄神经节中含量最丰富的激素,参与甲壳类动物多种生理活动[19]。然而,CHH家族在甲壳动物卵巢发育过程中的作用仍未明确。本研究对已经上传至NCBI的CHH家族CHH2基因进行了生物信息学和初步功能分析。基因组结构组成分析发现,CHH2基因由2个外显子和1个内含子组成,有报道称绝大多数CHH基因编码区包含3个外显子和2个内含子,但也有报道存在个别基因不属于这种情况,包括克氏螯虾和斑节对虾,因此,红螯螯虾CHH2基因可能也属于特例[20]。本研究对CHH蛋白进行多重分析,发现所有CHH基因家族都含有保守的6个半胱氨酸残基,红螯螯虾6个保守的半胱氨酸残基分别位于C70、C86、C89、C102、C106和C115,这6个保守的半胱氨酸组成3对分子内二硫键,这已成为高血糖激素家族的标志[2]。另外,来源于甲壳类动物的CHH蛋白通过多重序列比对显示出极高的同源性,表明它们可能具有高度保守的生物学功能。红螯螯虾CHH蛋白与同为螯虾科的龙虾类物种关系较近,包括挪威龙虾(Nephropsnorvegicus)、美洲螯龙虾(Homarusamericanus)、欧洲龙虾(HomarusGammarus),证实了它们的进化地位较为接近。
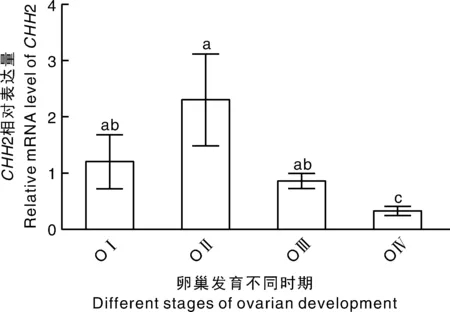
OⅠ,未发育期;OⅡ,发育期;OⅢ,快速发育期;OⅣ,成熟期。不同字母表示差异显著(P <0.05)。下同。
高血糖激素是一种多功能的激素,这与它广泛分布于各个不同组织中的结论相一致[9]。先前在甲壳动物中的研究表明,眼柄是CHH家族基因表达最为丰富的组织,包括斑节对虾、南美白对虾和罗氏沼虾[21-23]。本研究的焦点在于探索CHH2基因对于卵巢发育的影响,因此未检测其在眼柄组织中的表达丰度,CHH2在红螯螯虾性腺中的表达谱呈性别二态性表达模式,且卵巢中的表达水平显著高于其他组织。该结果与青虾中的报道正好相反,但与脊尾白虾中的报道相似[24]。基因的组织分布与其在生理过程中的作用息息相关,CHH2基因与卵巢发育有密切关系;CHH2基因受外源刺激后表达水平急剧下降,相反卵黄蛋白原VTG基因表达水平明显上升,由此推测,CHH2对红螯螯虾卵巢发育可能有抑制作用[25]。已知CHH基因在转录过程中通过不同的剪接形式产生不同的构型,进而翻译出不同构型的CHH多肽,在不同组织中行使多种生理功能,这也许能解释CHH基因在不同甲壳动物中具有不同作用的原因。
先前的研究表明,眼柄切除具有促进雌性甲壳类动物性腺成熟和繁殖的作用,主要原因是眼柄切除干扰了性腺抑制激素的合成和释放[26]。有研究者在甲壳类动物中通过RNAi技术沉默CHH家族基因以代替眼柄切除促进性腺发育[27]。卵黄蛋白原基因VTG是卵生动物卵巢发育相关研究中的一个重要生物标志物。本研究中,靶向沉默CHH2后,VTG的表达水平明显上升,这表明CHH2基因可能对红螯螯虾的卵巢发育起负调控作用。
综上所述,本研究在已报道红螯螯虾高血糖素CHH2基因mRNA序列的基础上,基于实验室组装的高质量全基因组序列分析了CHH2基因的基因组结构,并利用生物信息学和qRT-PCR等方法系统研究了CHH2基因的序列特征、组织表达特异性、外源刺激物对基因表达的影响,最后利用RNAi技术验证了CHH2基因参与调控红螯螯虾繁殖生理学过程,对于红螯螯虾的卵巢发育主要起负调控作用。研究结果为进一步研发促雌虾性成熟的RNAi技术提供了理论基础。
