干旱胁迫下红砂幼苗非结构性碳水化合物动态变化特征
2023-02-21师亚婷单立山解婷婷王红永
师亚婷,单立山,解婷婷,马 静,杨 洁,王红永
(甘肃农业大学 林学院,兰州 730070)
近年来,全球气候变暖、水资源短缺、土地荒漠化等生态环境问题日益突出,干旱对植物生理特性的影响越来越严重,并进一步限制了植物的正常生长发育。中国是世界上沙漠面积较大和荒漠化严重的国家之一,这种日益严峻的荒漠化趋势对中国北方干旱区生态环境造成了严重影响,荒漠化防治已成为了中国环境治理的重要方面[1]。水分作为限制荒漠植被生长的基本要素,通过影响各器官碳分配过程决定其生长与存活。非结构性碳水化合物(non-structural carbohydrates,NSC)是光合作用和呼吸作用之间主要的中间物质,主要由可溶性糖和淀粉组成[2],其含量可以直观地反映可供给植物生长存活的物质水平,也可以体现出碳吸收与碳消耗二者之间的平衡关系[3]。因此,加强干旱胁迫对荒漠植物非结构性碳水化合物影响的研究,有助于了解植物适应干旱胁迫的生理生态机制,对干旱、半干旱区荒漠植物的保护、恢复和重建等工作具有重要意义。
干旱胁迫通常会影响植物各器官NSC分配格局,进而调控植物的生长和死亡[4]。有研究发现,随着干旱胁迫加剧,植物将NSC优先投资于地上部分器官生长[5];但也有学者发现,干旱胁迫下植物根中NSC含量没有降低[6],甚至有些植物地下器官NSC分配比例增大[7];且有的植物分配淀粉到粗根中储存用于后期抵抗干旱,可溶性糖分配至细根中促进水分吸收[8]。可见,随干旱胁迫的加剧,NSC分配在植物不同器官内的变化规律具有极强的不确定性和差异性。也有研究指出干旱胁迫持续时间会对植物体内NSC含量变化产生影响,王宗琰等[9]研究发现胁迫初期NSC含量表现为胁迫处理显著高于适宜处理,胁迫后期却表现相反;而Piper等[10]研究指出植物体内NSC含量在整个试验过程中不受干旱影响。由此发现,关于干旱胁迫持续时间对于NSC含量的影响尚不明确。以往研究多集中于较短时间的干旱胁迫,且仅仅比较干旱胁迫开始前和干旱胁迫结束时的NSC变化规律,有关长期胁迫下NSC动态变化的研究相对缺乏。因此,结合干旱胁迫强度和胁迫持续时间开展植被体内NSC动态变化的研究,有助于更全面地了解植物的干旱适应策略,对深刻理解干旱诱导植物死亡的生理机制具有重要意义。
红砂(Reaumuriasoongorica)是中国荒漠区分布最广的植物种之一,在保护、改善和修复干旱区生态环境方面起到了重要作用[11]。目前,关于红砂干旱胁迫的研究主要集中在渗透调节物质[11]、种子萌发[12-13]、形态特征[14]、含水量[15]、叶绿素荧光[16]、转录组学特征[17]等方面,而有关干旱胁迫对NSC含量在其不同器官分配的研究较少。与成年植株相比,幼苗对干旱胁迫更敏感,其存活率对植被更新具有重要意义[18]。因此,本研究以红砂幼苗为研究对象,通过盆栽控水试验,测定其各器官(叶、茎和根)中NSC含量,考察不同干旱持续时间和不同胁迫强度下红砂幼苗NSC的动态变化及各组分差异,以揭示干旱胁迫影响NSC在红砂各器官中的分配机制,从而为荒漠地区红砂群落的保护、恢复提供一定的理论依据。
1 材料和方法
1.1 苗木培育
2019年3月底至4月初,在甘肃省白银市景泰县(36°43′N,104°43′E)的山前戈壁,分别选取具有代表性、大小均一(平均株高10 cm、冠幅10 cm)的单生红砂数株,带回甘肃农业大学校内试验基地(36°03′N,103°49′E)栽植至上径30 cm、下径18 cm、高38 cm花盆中,每盆栽植1株红砂幼苗,供试土壤取自红砂采样地自然生境中的土壤,装土前进行了过筛、除杂等处理,每盆装土10 kg。场内设有遮雨棚,周围无遮挡物,植株受光照充足均匀、通风良好,雨天及时对植物进行遮盖。待缓苗生长2个月后,于2019年6月对幼苗进行抗旱试验,此时不再每天充分浇水灌溉,并于7月6日开始控制其土壤含水量进行试验,每天18:00通过人工称重补水的方式维持处理土壤含水量。
1.2 实验设计
采用盆栽人工模拟干旱胁迫试验,参照王宗琰等[9]、杜尧等[19]和朱教君等[20]的试验方法,设置适宜水分(CK)、轻度(MD)、中度(SD)和重度胁迫(VSD)4个水分处理,控水方法采用植物水分梯度划分法,即各处理的土壤含水量以红砂采样地自然生境中的土壤田间持水量(17.41%)的80%、60%、40%和20%为基准,即实际土壤含水量分别是13.93%、10.45%、6.97%和3.45%。试验设计本底值12盆(4个处理×3个重复),在7月6日干旱胁迫之前取样。每个处理每次设3盆(3个重复),共计60盆植株(12盆基准值+4个处理×4次取样×每次3盆),分别在干旱胁迫后15 d(7月22日)、30 d(8月6日)、45 d(8月21日)和60 d(9月4日)时取样测定红砂幼苗不同器官非结构性碳水化合物的变化情况。
1.3 样品采集和指标测量
样品采集时,将红砂幼苗整株从盆中取出,尽可能地确保根系的完整性,用保鲜膜包裹根系以防止水分流失,迅速将样品带回实验室。将幼苗分为叶、茎、粗根(≥2 mm)和细根(<2 mm)4部分。将各部分组织用天平称重后装进标记好的信封中,放入120 ℃的烘箱内杀青30 min,之后将温度调至80 ℃烘干至恒重后取出,将样品粉碎后用于不同组织中非结构性碳水化合物含量的测定。本实验采用蒽酮比色法测定样品可溶性糖含量[21],苯酚浓硫酸法测定样品淀粉含量[22],NSC含量为可溶性糖与淀粉之和,其积累量为含量与干重的乘积。
1.4 数据处理
所有数据的统计分析都使用SPSSV.25.0(SPSS,Inc.,Chicago,USA)进行。采用双因素方差分析(Two-way ANOVA)来确定红砂幼苗在胁迫强度和胁迫持续时间及其两者相互作用下不同器官的可溶性糖、淀粉和NSC含量的差异显著性。采用单因素方差分析(One-way ANOVA)检验不同胁迫时间、不同胁迫强度以及不同器官中可溶性糖、淀粉和NSC含量的差异显著性。采用Duncan检验进行多重比较。Origin 2021用于绘图,各图数值均以平均值±标准差表示。
2 结果与分析
2.1 干旱胁迫强度和时间对红砂幼苗不同器官中可溶性糖含量的影响
从图1可知,红砂幼苗叶、粗根、细根的可溶性糖含量在各干旱胁迫强度和各胁迫时间下均不同程度地高于自身基准值(胁迫前,0 d),且各器官VSD处理的可溶性糖含量在各胁迫时间下均高于CK处理。其中,随胁迫时间的延长,叶可溶性糖含量在CK处理中持续增加,在MD、SD处理先上升后降低再上升,在VSD处理则先上升后降低,各处理均在干旱胁迫60 d时与自身基准值差异显著,CK、VSD处理还在胁迫45 d、SD处理在胁迫30 d时也与自身基准值差异显著;与CK处理相比,MD处理在胁迫60 d、SD处理在胁迫30 d、VSD处理在胁迫45 d时均显著增加,分别比自身基准值显著增加144.05%、67.79%、193.19%,分别比同期CK显著增加22.64%、28.66%和88.97%(图1,Ⅰ)。随胁迫时间的延长,茎可溶性糖含量在CK处理下呈现降低-上升-降低-上升的波动变化趋势,在MD、SD、VSD处理均先上升后降低再上升,CK、MD处理在胁迫60 d时显著高于自身基准值,SD处理在整个胁迫过程中均显著高于自身基准值,VSD处理在胁迫30 和60 d时显著高于自身基准值;与CK处理相比,MD、SD、VSD处理均在45 d时显著增加,此时分别比基准值显著增加19.44%、53.58%和29.73%,比同期CK分别显著增加45.30%、86.83%和57.81%(图1,Ⅱ)。随胁迫时间的延长,粗根可溶性糖含量在CK、MD、VSD处理下均先上升后下降,SD处理则持续增加,各处理均在胁迫30~60 d时与自身基准值差异显著;与CK处理相比,VSD处理在整个胁迫处理过程中均无显著变化,MD、SD处理在胁迫60 d时显著增加,此时分别比基准值显著增加1 356.34%和1 725.49%,分别比同期CK显著增加18.02%和47.97%(图1,Ⅲ)。随胁迫时间的延长,各处理细根可溶性糖含量均先上升后下降再上升,均在胁迫30~60 d时与自身基准值差异显著;与CK处理相比,MD、SD、VSD处理均在胁迫60 d时显著增加,此时分别比自身基准值显著增加1 188.95%、1 247.72%和1 411.45%,分别比同期CK显著增加25.63%、23.47%和38.47%(图1,Ⅳ)。
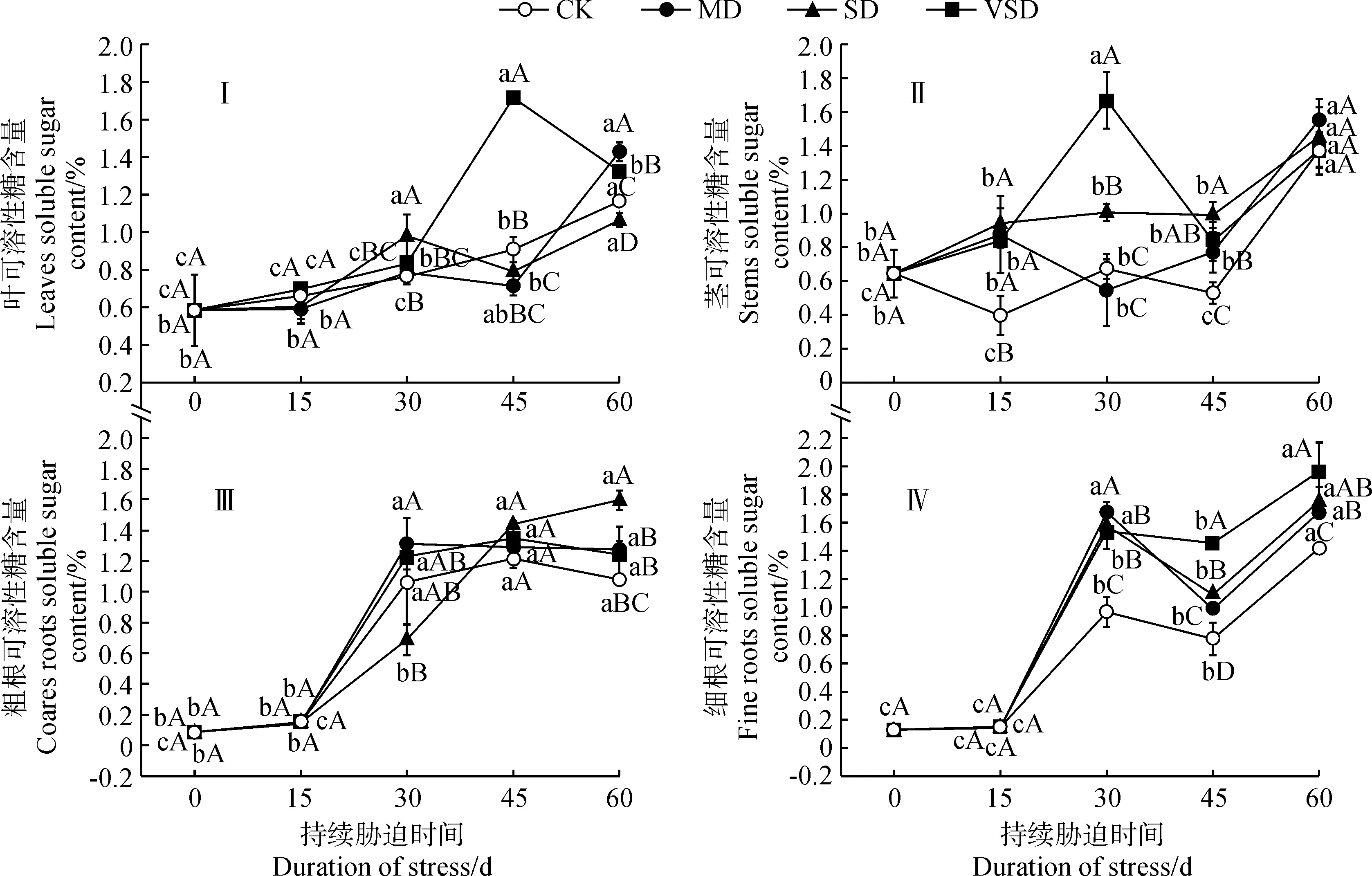
CK、MD、SD、VSD分别代表适宜水分、轻度干旱、中度干旱和重度干旱胁迫处理;不同小写字母表示同一处理不同时间之间差异显著(P<0.05),不同大写字母表示同一时间不同胁迫处理间差异显著(P<0.05);下同图1 不同干旱胁迫下红砂幼苗各器官可溶性糖含量变化特征CK,MD,SD and VSD stand for suitable water,mild drought stress,moderate drought stress and severe drought stress treatments,respectively.Different normal letters in the same drought stress intensity indicate the significant differences among different stress time points at 0.05 level (P <0.05),while the different capital letters at the same time point indicate the significant differences under different stress intensities,at 0.05 level (P <0.05).The same as belowFig.1 Variation characteristics of soluble sugar content in organs of Reaumuria soongorica seedlings under drought stress
2.2 干旱胁迫强度和时间对红砂幼苗不同器官中淀粉含量的影响
图2显示,随胁迫时间的延长,红砂幼苗叶淀粉含量在CK、MD、VSD处理下均先降低后上升,SD处理呈现波动变化趋势,CK处理在胁迫60 d时与自身基准值差异显著,MD、VSD处理在整个胁迫过程中均与自身基准值差异显著,SD处理在胁迫15 和60 d时与自身基准值差异显著,各干旱胁迫处理在胁迫60 d时均不同程度地高于自身基准值;与CK处理相比,MD、SD处理在胁迫45 d 时显著减少,VSD处理在整个胁迫过程中无显著差异(图2,Ⅰ)。
同时,随胁迫时间的延长,红砂幼苗茎淀粉含量在CK处理下先上升后降低再上升,并在胁迫30和60 d时与自身基准值差异显著,在MD、SD、VSD处理下均先降低后上升,SD处理在胁迫15、30和60 d时与自身基准值差异显著,MD、VSD处理在胁迫60 d时与自身基准值差异显著,各干旱胁迫处理均在胁迫45和60 d时不同程度地高于自身基准值;MD、SD、VSD处理均在胁迫30 d时比同期CK处理显著增加,增幅分别为91.23%、66.67%和144.38%(图2,Ⅱ)。
此外,粗根淀粉含量在CK、MD、VSD处理30~60 d、SD处理30 和60 d时不同程度地高于自身基准值;随胁迫时间的延长,红砂幼苗粗根淀粉含量在CK、MD、VSD处理下均先降低后上升再降低,在SD处理下则呈现波动变化趋势,前三者均在胁迫45和60 d、SD处理在胁迫60 d时才与自身基准差异显著;与CK处理相比,MD处理在整个胁迫过程中无显著变化,VSD处理在胁迫45 d时显著增加,此时比基准值和同期CK分别显著增加了1 558.46%和11.90%(图2,Ⅲ)。
另外,细根淀粉含量在CK、VSD处理45 和60 d时均不同程度地高于自身基准值,在MD、SD处理各时间段下均不同程度地高于自身基准值;随胁迫时间的延长,细根淀粉含量在CK、VSD处理下均先降低后上升再降低,在MD处理下先上升后降低,在SD处理下则持续增加,且CK、MD处理在胁迫45 和60 d、SD处理在胁迫60 d、VSD处理在胁迫30~60 d均与自身基准值差异显著;与CK处理相比,MD处理在整个胁迫过程中无显著变化,SD处理在胁迫45 d时显著减少,VSD处理在胁迫30 d时显著增加,此时比基准值和同期CK分别增加了181.72%和34.71%(图2,Ⅳ)。
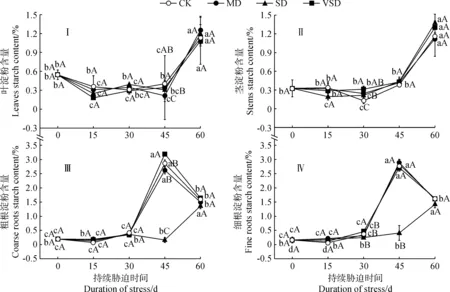
图2 不同干旱胁迫下红砂幼苗各器官淀粉含量变化特征Fig.2 Variation characteristics of starch content in organs of R. soongorica seedlings under drought stress
2.3 干旱胁迫强度和时间对红砂幼苗不同器官中NSC含量的影响
图3表明,随胁迫时间的延长,红砂幼苗叶NSC含量在CK、VSD处理下先下降后上升,在MD、SD处理呈现降低-上升-降低-上升的波动变化趋势,且在各干旱胁迫处理60 d时均显著地高于自身基准值;与CK处理相比,MD、SD、VSD处理分别在胁迫60 d、30 d和45 d时显著增加,此时它们分别比自身比基准值显著增加137.21%、21.45%和82.11%,比同期CK分别显著增加17.24%、28.62%和57.04%(图3,Ⅰ)。
同时,随胁迫时间的延长,红砂幼苗茎NSC含量在CK处理下先降低后上升,在MD、VSD处理下先上升后降低再上升,在SD处理下则持续增加,CK、SD处理在各胁迫时间下均与自身基准值差异显著,MD处理在胁迫15和60 d、VSD处理在胁迫30和60 d时与自身基准值差异显著;与CK处理相比,MD、SD、VSD均在胁迫45 d时显著增加,此时分别比基准值显著增加22.12%、46.90%和30.41%,分别比同期CK显著增加30.00%、56.38%和38.82%(图3,Ⅱ)。
另外,随胁迫时间的延长,粗根NSC含量在CK、MD处理下先降低后上升再降低,在SD处理下持续增加,在VSD处理下先上升后降低,且各处理在胁迫30~60 d时显著地高于自身基准值;与CK处理相比,MD处理在整个胁迫过程中均无显著差异,SD处理在胁迫30 和45 d时显著减少,VSD处理在胁迫45 d时显著增加,此时VSD处理比基准值和同期CK分别显著增加1 521.71%和11.64%(图3,Ⅲ)。
此外,随胁迫时间的延长,细根NSC含量在CK、VSD处理下先降低后上升再降低,在MD处理下先上升后降低,在SD处理下先上升后降低再上升,且各处理在胁迫30~60 d时显著地高于自身基准值,在胁迫60 d时增幅分别为1 016.05%、986.25%和1 131.15%;与CK处理相比,MD处理在胁迫15、30和60 d时显著增加,SD处理在胁迫15和30 d时显著增加,VSD处理在整个胁迫过程中均显著增加(图3,Ⅳ)。

图3 不同干旱胁迫下红砂幼苗各器官NSC含量变化特征Fig.3 Variation characteristics of NSC content in organs of R. soongorica seedlings under drought stress
2.4 干旱胁迫强度和时间对红砂幼苗不同器官中可溶性糖与淀粉比值的影响
从图4来看,随胁迫时间的延长,红砂幼苗叶可溶性糖与淀粉比值在CK、MD、SD处理下均先上升后降低,VSD处理则呈现波动变化趋势,CK处理在胁迫30~60 d、MD和VSD处理在胁迫15~60 d、SD处理在胁迫15 d时与自身基准值差异显著,而各处理均在胁迫15~45 d时不同程度地高于自身基准值;与CK处理相比,MD、SD、VSD处理均在胁迫45 d时显著增加,此时分别比基准值显著增加211.70%、141.99%和366.95%,比同期CK分别显著增加48.39%、15.21%和122.31%(图4,Ⅰ)。

图4 不同干旱胁迫下红砂幼苗各器官可溶性糖∶淀粉变化特征Fig.4 Variation characteristics of the ratios of soluble sugar to starch content in organs of R. soongorica seedlings under drought stress
同时,随胁迫时间的延长,茎可溶性糖与淀粉比值在CK处理下呈现波动变化趋势,在MD、SD、VSD处理下均先上升后降低,SD处理在胁迫15和30 d、VSD处理在胁迫30和60 d时与自身基准值差异显著,且各处理均在胁迫30 d时不同程度地高于自身基准值;与CK处理相比,MD、SD、VSD处理在整个胁迫过程中均无显著变化(图4,Ⅱ)。
此外,随胁迫时间的延长,粗根可溶性糖与淀粉比值在CK、MD、VSD处理下均先上升后降低再上升,在SD处理下先上升后降低,CK处理在胁迫45和60 d、MD和VSD处理在胁迫30 d、SD处理在胁迫45 d时与自身基准值显著差异,且各处理均在胁迫15、30和60 d时不同程度地高于自身基准值;与CK处理相比,SD处理在胁迫45和60 d时显著增加,分别比基准值显著增加1 565.93%和118.44%,比同期CK显著增加1 990.66%和69.03%(图4,Ⅲ)。
另外,随胁迫时间的延长,细根可溶性糖与淀粉比值在CK、VSD处理下先上升后降低再上升,在MD处理下呈现波动变化趋势,在SD处理下先降低后上升再降低,CK处理在胁迫15 d与自身基准值差异显著,MD、SD、VSD处理均在胁迫30 d时与自身基准值差异显著,而各处理均在胁迫30 和60 d时不同程度地高于自身基准值;与CK处理相比,MD处理在胁迫30 d、SD处理在胁迫30~60 d、VSD处理在胁迫60 d时均显著增加,MD、SD、VSD处理在胁迫60 d时比基准值增加31.88%、53.75%和50.19%,比同期CK分别显著增加20.23%、40.18%和36.94%(图4,Ⅳ)。
2.5 不同干旱处理下红砂幼苗各器官非结构性碳水化合物的分配特征
图5显示,红砂幼苗茎、粗根、细根的可溶性糖积累量占整株的比值(简称可溶性糖占比,以下类同)在CK处理下显著高于叶片,分别是叶的2.58、2.08和2.67倍;各器官的可溶性糖占比在MD处理下相近;粗根、细根的可溶性糖占比在SD处理下显著高于叶,分别是叶的1.50、1.67倍;细根的可溶性糖占比在VSD处理下显著高于叶、茎和粗根,分别是叶、茎、粗根的1.50、1.43和1.57倍。同时,红砂幼苗细根和粗根的淀粉占比在CK处理下均显著高于叶和茎,细根淀粉占比分别是叶、茎的1.43和1.43倍,粗根淀粉占比分别是叶、茎的1.38和1.38倍;各器官的淀粉占比在MD、SD、VSD处理下相近,均无显著变化。另外,细根的总NSC占比在CK处理下显著高于叶、茎和粗根,分别是叶、茎、粗根的2.67、1.19和1.14倍;各器官的总NSC占比在MD处理下相近,均无显著变化;细根的总NSC占比在SD处理下显著高于叶,是叶的1.40倍;细根的总NSC占比在VSD处理下显著高于叶、茎,分别是叶、茎的1.48和1.35倍。
3 讨 论
3.1 红砂器官中NSC含量对干旱胁迫强度的动态响应
当植物受水分短缺等逆境条件影响时,可通过调控自身可溶性糖、淀粉和NSC含量以维持生理特性及生长速率等来适应干旱环境[23]。环境胁迫会减少树木光合作用产生的碳,但树木体内储存的NSC为树木呼吸、生长和防御等提供了一定的碳资源[24]。可溶性糖作为植物逆境的主要渗透调节物质,其含量在受干旱环境胁迫时会迅速升高以维持细胞膨压,从而增加植物抵御干旱胁迫的能力;淀粉作为植物体内主要的能量储存物质,可溶性糖和淀粉在一定条件下可以互相转换以维持正常的生理活动[25]。本研究发现,红砂幼苗不同器官NSC及组分对不同干旱胁迫强度产生了不同的响应。首先,在本研究中,水分处理持续至45 d时,VSD处理下红砂幼苗叶、茎、粗根和细根中的NSC含量显著高于CK,说明重度干旱胁迫促进红砂幼苗各器官NSC含量的积累,储存在植物体内的NSC能够在严重胁迫时提高苗木的生存率。此研究结果与Hartmann等[26]的研究结果一致,他们的结果表明良好水分条件下树木所有组织的NSC含量普遍低于受干旱胁迫条件下的。同时,本研究还发现,水分处理持续至60 d时,MD、VSD处理红砂幼苗叶、茎、粗根和细根的可溶性糖含量均高于CK,说明与适宜水分条件相比,干旱胁迫可以诱导提高红砂幼苗各器官的可溶性糖含量。可能的原因是干旱胁迫导致叶片渗透势下降,光合产物向叶外运输受阻,蔗糖和其他糖类被积极水解,或者干旱胁迫对植物的伤害使相对的生理活动不能正常进行,从而导致可溶性糖的积累。有研究表明,糖含量的增加可以降低植物的水势,增加水分吸收[27]。另外,本研究还表明,水分处理持续至45 d时,MD、SD和VSD处理红砂幼苗叶片中的淀粉含量低于CK,但在茎中却相反。杜尧等[19]指出干旱胁迫可以将淀粉转化为可溶性糖。淀粉作为NSC的贮存物质,当干旱胁迫强度增加时,叶片中的淀粉会部分水解为可溶性糖以调节细胞的通透性,这进一步导致叶片中可溶性糖与淀粉的比例增加。这些都与本研究结果一致,即水分处理持续至45 d时,MD、SD、VSD处理下红砂叶片中可溶性糖与淀粉的比值都高于CK。可见,重度干旱胁迫致使红砂幼苗积累NSC含量的同时促进淀粉向可溶性糖的转化,以提高细胞渗透势,维持细胞活力,进而抵御极端干旱逆境。
3.2 红砂器官中NSC含量对干旱持续时间的动态响应
本实验结果表明,干旱胁迫持续时间对红砂幼苗体内不同器官中可溶性糖、淀粉、NSC的含量以及可溶性糖与淀粉的比值有显著影响。其中,在干旱胁迫初期(0~15 d),红砂叶片中可溶性糖含量增加缓慢,淀粉含量减少,NSC含量也减少;茎中可溶性糖含量增加,淀粉含量减少,NSC含量增加;粗根和细根中可溶性糖和淀粉含量波动不大,NSC含量保持稳定。出现以上结果的原因可能是由于干旱降低了红砂幼苗的光合作用能力,叶片在胁迫初期合成可溶性糖和淀粉的能力下降,因此叶片中NSC含量下降。同时,叶片作为碳源器官将少量的NSC向下转移到碳汇器官(茎、粗根、细根)以保证NSC在碳储存器官中含量的稳定和积累,这可以看作是幼苗的一种特殊的“储备”和“防范”策略[7]。研究表明,碳水化合物的储存可以提高植物的抗逆性和存活率,当植物在干旱胁迫过程中碳供应不足时,储存的NSC可以作为一种缓冲剂,暂时供给植物的生长和代谢[28]。也有研究认为,干旱条件下树木NSC含量保持不变或上升的原因可能是水分胁迫对树木碳利用活动的限制早于碳供应活动,导致树木碳利用活动对碳的消耗少于碳供应活动,从而导致NSC的积累[24]。
许多研究都表明,植物根中的NSC含量在干旱胁迫响应中显著降低[29]。本研究发现,在干旱胁迫45~60 d,红砂幼苗粗根和细根中的淀粉和NSC的含量都有所下降(SD除外);可溶性糖含量在细根中逐渐增加,而在粗根中逐渐减少,可溶性糖的增加和淀粉的减少导致细根中可溶性糖与淀粉的比例增加。这可能是由于在干旱胁迫后期,红砂幼苗遭受干旱胁迫时细根对可溶性糖的需求增加,而淀粉作为NSC的储备,细根中的淀粉转化为可溶性糖,维持细胞的水势和水分平衡,以调节渗透压,保证在极端环境中生存[30]。同时,干旱胁迫使粗根消耗一部分可溶性糖以促进自身的生长,从而提高对水和营养物质的运输能力。另一部分可溶性糖转移到细根中,使细根中的可溶性糖含量增加,以满足细根吸收和利用水分的需求[31],这表明在干旱胁迫后期红砂幼苗的地下部分可能出现 “碳饥饿”现象,这与王凯等[5]的研究结果一致。在此期间,红砂地上器官叶片和茎中的可溶性糖、淀粉和NSC的含量逐渐增加,说明在干旱胁迫后期茎中的可溶性糖和淀粉没有大量转移到叶片,而用于保证叶片的光合作用能力。一方面,这可能是因为干旱树木地上组织中的淀粉积累是淀粉降解酶活性下降的结果[32]。另一方面,作为碳源的叶片具有较强的碳同化能力,即使在干旱胁迫的后期仍能保持一定的NSC含量,NSC含量整体上呈现上升趋势,而茎作为靠近碳源的贮藏组织,比远离碳源的根系更容易获得一部分NSC进行贮藏。上述结果与Hartmann等[26]的研究结果一致,即与地上组织相反,根系中的NSC含量随时间推移而季节性下降,他们认为这可能是由于碳运输失败造成的地下部分根系与地上组织的脱钩。也有研究解释说,叶和茎中NSC含量持续增加的原因是树木在适应干旱后会产生“干旱记忆效应”[33],也就是说,为了避免在下一个生长季出现更严重的‘碳饥饿’,树木会主动将光合产物分配给NSC储存,与光合产物的生长形成竞争,最终导致树木生长受到碳供应的限制[23]。在这种情况下,虽然干旱降低了树木的生长速度,但其NSC含量却增加。
3.3 红砂幼苗非结构性碳水化合物的分配格局
植物NSC的分配格局是多种生理过程综合作用的结果,其在不同器官中的分配格局反映了植物对环境的适应策略[34]。可溶性糖是植物体中活跃的碳储存物质,其分配格局反映植物的生长状况。本研究结果发现,干旱胁迫末期的红砂幼苗各器官可溶性糖积累量在整株的占比于SD处理下表现为细根>粗根>茎>叶,在MD、VSD处理下表现为细根>茎>叶>粗根,说明此时细根是红砂幼苗可溶性糖的主要供应器官,这与张婷等[35]对刺槐幼苗的研究结果一致,可能是因为红砂幼苗通过增加细根中可溶性糖浓度来提高水分吸收能力,进而调节其渗透势,维持生理代谢,这可能是红砂适应干旱环境的一种生理机制。同时,淀粉作为植物内不活跃的储存物质,其分配格局反映植物能量物质的贮存策略。本研究发现,干旱胁迫末期的红砂幼苗各器官淀粉积累量在整株的占比在MD处理下表现为细根>粗根>叶>茎,在SD、VSD处理下表现为细根>粗根>茎>叶,说明此时细根是红砂幼苗淀粉的主要贮存器官,这可能是由于干旱胁迫末期红砂幼苗丧失了光合能力,叶和茎中淀粉合成减少,也可能是持续干旱对红砂幼苗的影响越来越明显,为了维持生理代谢活动,其叶和茎中淀粉水解为可溶性糖,运输到根系,以供根系生长消耗[36]。另外,本研究还发现干旱胁迫末期的红砂幼苗各器官总NSC积累量占整株的比值在各干旱胁迫强度下均表现为细根>粗根>茎>叶,说明在干旱胁迫末期红砂幼苗的NSC优先供给地下部分,一方面可能是因为红砂幼苗在持续干旱胁迫下充分发挥其利用水资源的本能,红砂幼苗叶、茎死亡在一定程度上减缓了水分蒸发,此时根系成为其生长和生存所需资源的唯一来源,源-库关系发生改变,NSC向根系转移以提高根系活力,从而实现对有限水资源的充分利用,尽可能地延长幼苗存活时间[37];另一方面可能是因为持续干旱胁迫促进新根生长,细根生物量在逆境中可能高于正常情况,此时在地上-地下生物量竞争中根系占优势[38],因而红砂幼苗NSC分配呈现出向地下输送的趋势,从而有效利用资源,这可能是红砂幼苗在持续干旱下的一种生存机制[39]。
4 结 论
干旱胁迫强度和胁迫持续时间对红砂幼苗不同器官的NSC及其组分有显著影响,其中胁迫持续时间对NSC动态变化的影响更为重要。红砂幼苗对干旱胁迫的响应主要依靠分解淀粉和增加叶片中可溶性糖的方式来调节细胞渗透势平衡,维持细胞活力。与适宜水分条件相比,严重干旱胁迫会导致红砂幼苗的器官产生更多的NSC。在干旱胁迫的早期,红砂幼苗根系的NSC含量一般保持稳定,但在胁迫后期呈下降趋势。与地下部分相反,NSC在干旱胁迫早期在叶片中的含量下降,但在干旱胁迫后期增加,而在茎中的含量在整个实验过程中呈上升趋势。
