NaCl胁迫下宁夏枸杞光合作用相关基因差异表达分析
2023-02-21胡进红梁旺利于雯静王玲霞梁文裕
胡进红,宋 繁,梁旺利,于雯静,王玲霞,梁文裕
(宁夏大学 生命科学学院,银川 750021)
土壤盐碱化是全球生态环境和农业生产面临的日益严峻的挑战。盐胁迫是植物面临的主要非生物胁迫之一,会导致植物遭受离子毒害、渗透胁迫和氧化损伤[1],对植物形态、细胞内稳态、代谢、酶活性以及离子运输、吸收和分配等产生不利影响,可降低植物生物量、叶肉导度、气体交换、蒸腾速率和光合能力[2-3]。而且盐胁迫下的Na+在叶绿体中快速、过度积累会导致叶绿体结构发生变化,影响光系统Ⅱ功能和电子通量密度[4]。因此,盐胁迫对植物光合机构和光合作用具有明显的影响。
宁夏枸杞(LyciumbarbarumL.)是茄科枸杞属的多年生落叶灌木,其果实枸杞子是著名药材,根、茎、叶和籽也都具有丰富的药用价值和营养保健价值[5]。此外,宁夏枸杞具有耐盐碱和繁殖能力强等优良特性[6],也是盐碱地改良和园林绿化的优选药用植物。虽然目前盐胁迫对宁夏枸杞的光合生理的影响有了初步的认识,如枸杞叶肉细胞形状改变,叶绿体结构变形,净光合速率、蒸腾速率、气孔限制值和气孔导度随NaHCO3胁迫浓度的升高而下降,但细胞间隙CO2浓度升高,水分利用率呈先升后降的趋势[7]。由于盐胁迫下植物光合作用相关基因的差异表达对光合速率和光合活性具有重要的调控作用[8],而宁夏枸杞在盐胁迫条件下光合机构及光合作用相关基因如何响应盐胁迫的机制并不明确。因此,本研究采用高通量测序技术及生物信息学方法对宁夏枸杞响应NaCl胁迫的光合作用相关差异表达基因进行筛选,采用 qRT-PCR 进一步分析重要基因差异表达规律,并对光合代谢相关生理指标进行检测,进而解析NaCl胁迫条件下宁夏枸杞光合相关基因差异表达规律,为深入认识宁夏枸杞耐盐碱的光合分子机理奠定基础,也为宁夏枸杞的开发利用和耐盐品种的培育提供理论和试验依据。
1 材料和方法
1.1 材 料
宁夏枸杞品种‘宁杞1号’由宁夏农林科学院枸杞工程技术研究所惠赠。宁夏枸杞幼苗基质培养1个月后进行Hoagland营养液水培(温度25±2 ℃、湿度42%、光周期16 h/8 h、光照强度60 μmol·m-2·s-1),培养至8~12叶期时,将长势一致、健康的幼苗在添加NaCl的Hoagland溶液中进行NaCl胁迫处理。试验共设置0 (对照组A)、100 (处理组B)、200 (处理组C)和300 (处理组D)mmol/L NaCl等4个处理。NaCl处理后第7天采集叶片样品(图1),每个处理分别随机剪取叶肉组织3 g混匀,液氮处理后,置于-80 ℃冰箱中备用。各处理设置3次生物学重复。
1.2 方 法
1.2.1 RNA提取及cDNA测序文库构建不同浓度NaCl胁迫处理的宁夏枸杞叶片总RNA利用(Tiangen)多糖多酚植物总RNA提取试剂盒进行提取。样品总RNA质量检测合格后构建cDNA测序文库。使用 Qubit2.0初步定量测序文库,稀释至1 ng/μL的文库插入片段采用安捷伦2100进行检测。使用定量聚合酶链式反应(Q-PCR)方法准确定量插入片段符合预期文库的有效浓度(文库有效浓度>2 nmol/L),以确保其质量达到送样要求。
1.2.2 Illumina HiSeq 测序、质控及从头组装通过高通量Illumina HiSeq PE150测序平台对已构建好的文库进行测序获得原始数据 (raw reads),将原始数据中带接头(adapter)的读段(reads)、无法确定碱基信息比例大于10%的读段和低质量读段进行过滤处理,获得干净读段(clean reads)。利用Trinity软件对干净读段(clean reads)进行从头组装获得后续分析的参考序列。

A.0 mmol/L NaCl;B.100 mmol/L NaCl;C.200 mmol/L NaCl;D.300 mmol/L NaCl;下同图1 不同浓度NaCl处理7 d后的宁夏枸杞幼苗A.0 mmol/L NaCl;B.100 mmol/L NaCl;C.200 mmol/L NaCl;D.300 mmol/L NaCl;The same as belowFig.1 The L. barbarum seedlings stressed under different concentrations of NaCl for 7 days
1.2.3 差异基因功能注释及差异基因筛选将获得的转录组序列在Nr、Pfam、Swiss-prot、KEGG、GO数据库进行blastx比对获得基因功能注释。采用DESeq2进行基因的差异表达分析,以P<0.05且[|log2(FoldChange)|>1]为标准筛选与光合作用相关代谢的差异表达基因。
1.2.4 光合作用相关基因的qRT-PCR分析选择与光合作用相关的部分重要差异表达基因进行qRT-PCR验证。qRT-PCR定量实验使用(Vazyme)诺唯赞生物科技有限公司(中国,南京)试剂盒完成。根据转录组测序结果中的转录本序列,用Premier 5.0设计目的基因扩增引物(表1),Actin为内参基因,用Roche LightCycler480型定量PCR仪进行反应。PCR扩增条件为95 ℃,10 min;95 ℃,30 s;60 ℃,1 min;共41个循环。每个反应3次重复,采用2-ΔΔCt法[9]对表达量进行分析。

表1 基因功能注释及引物序列Table 1 Gene function annotation and primer sequences
1.2.5 NaCl胁迫下宁夏枸杞叶片光合色素含量测定叶绿素a、叶绿素b和类胡萝卜素含量参照丙酮比色法测定[10]。称取0.2 g叶片,加适量碳酸钙、二氧化硅和3 mL 80%丙酮研磨至匀浆后,加10 mL 80%丙酮避光提取5 min后,将提取液倒入离心管中4 000 g离心10 min,将上清移至棕色容量瓶中并定容至25 mL。利用紫外分光光度计(TU-1810,PERSEE,China)在波长663、646和470 nm下测定吸光度并按样品鲜重质量计算盐胁迫下宁夏枸杞叶片叶绿素a、叶绿素b和类胡萝卜素含量。
1.2.6 NaCl胁迫下宁夏枸杞叶片净光合速率和核酮糖-1,5-二磷酸羧化酶活性的测定使用德国GFS-3000便携式光合仪测定宁夏枸杞叶片的净光合速率。测定时设置气体流速500 μmol·s-1,气体混匀器的风扇速度为7,叶室温度为29 ℃,相对湿度为60%,利用外置光源将PAR设定为1 800 μmol·m-2·s-1,各处理组选取长势一致的独立植株的中部叶片进行活体测定。核酮糖-1,5-二磷酸羧化酶(Rubisco)活性采用苏州梦犀生物医药科技有限公司试剂盒进行测定,按样品蛋白浓度计算其活性。
1.3 数据处理
所有试验均进行3次生物学重复。所得实验数据用SPSS Statistics 26.0、Origin和Excel进行方差分析、检验结果的差异显著性分析和作图。
2 结果与分析
2.1 测序数据质量评估
样本测序数据中,每个样本的错误率 ≤ 0.03%,测序碱基质量值大于20的碱基占总体碱基的百分比在97.28%以上、大于30的碱基在91.79%以上。GC含量占总碱基的44%左右,测序数据具有较高的准确性。对4个不同盐胁迫处理的宁夏枸杞样本进行相关性检测,样本间的相关系数均大于0.771(图2),表明测序数据可靠、样本间重复性良好且变异不大。

图2 样本间皮尔逊相关系数Fig.2 Pearson correlation between samples
2.2 NaCl胁迫下宁夏枸杞光合作用相关基因的差异表达
对NaCl胁迫下宁夏枸杞所有差异表达基因进行KEGG pathway显著性富集分析,筛选富集到与光合作用相关的代谢途径的64个差异表达基因(P<0.05)(表2),主要分布在卟啉和叶绿素代谢、类胡萝卜素生物合成、光反应和卡尔文循环代谢通路。
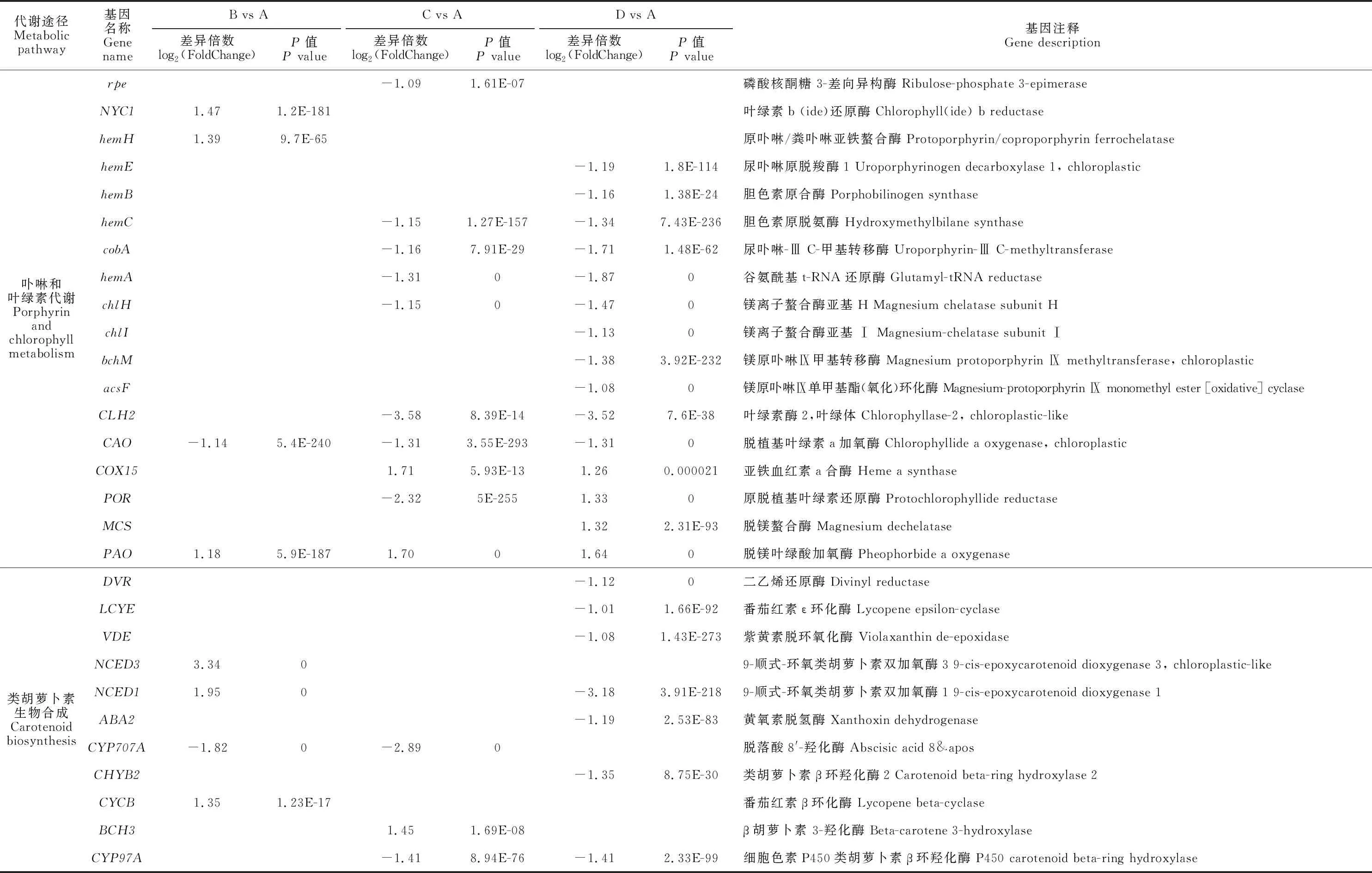
表2 NaCl胁迫下宁夏枸杞参与光合作用的差异表达基因Table 2 Differentially expressed genes involved in photosynthesis of L. barbarum under NaCl stress
其中,以0 mmol/L NaCl处理组(A)为对照,100 mmol/L NaCl处理组(B)宁夏枸杞光合作用相关的差异表达基因共有14个,上调差异表达基因为8个,下调差异表达基因有6个;200 mmol/L NaCl处理组(C)宁夏枸杞光合作用相关的差异表达基因共有26个,上调差异表达基因有7个,下调差异表达基因19个;300 mmol/L NaCl处理组(D)宁夏枸杞光合作用相关的差异表达基因共有55个,上调差异表达基因有5个,下调差异表达基因共有50个(图3)。可见,与光合作用相关的差异表达基因数目随着NaCl胁迫程度的增加而增加,且下调基因数远多于上调基因。
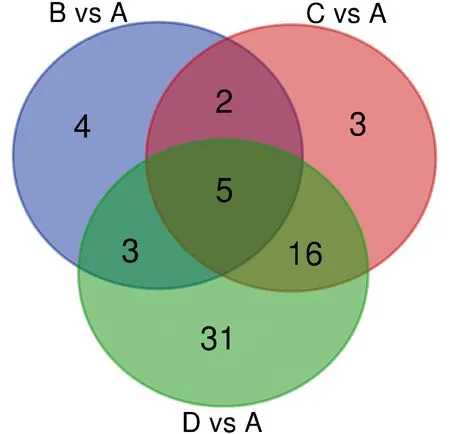
图3 NaCl 胁迫下宁夏枸杞光合作用相关差异表达基因韦恩图Fig.3 Venn diagram of photosynthesis-related differential genes in L. barbarum under NaCl stress
2.3 NaCl胁迫下宁夏枸杞光合作用相关基因差异表达验证分析
随机挑选NaCl胁迫下宁夏枸杞的3个光合作用相关差异表达基因ATPε、CLH2、Lhcb3进行qRT-PCR分析。结果(图4)表明,随着NaCl胁迫程度的加深,ATP合酶ε亚基基因(ATPε)表达量呈显著下降的趋势(P<0.05),但100、200和300 mmol/L NaCl处理组之间无显著差异;叶绿素酶2基因(CLH2)表达量随着NaCl胁迫程度的加深呈显著下降的趋势,并且各处理组间均差异显著(P<0.05);捕光色素复合体Ⅱ叶绿素a/b结合蛋白3基因(Lhcb3)在NaCl胁迫条件下总体呈显著下降趋势,并且各处理组间也均差异显著(P<0.05)。可见,qRT-PCR结果与RNA-seq测序结果基本一致。
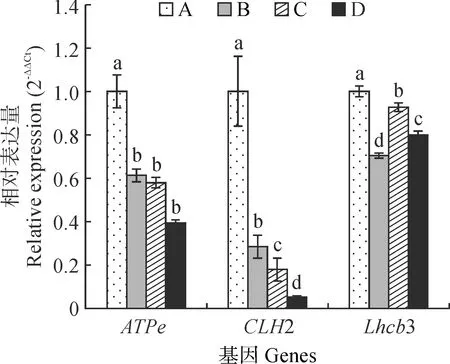
不同小写字母表示处理组之间在0.05水平差异显著(P<0.05);下同图4 不同NaCl胁迫下宁夏枸杞光合相关基因的qRT-PCR分析Different normal letters indicate that there are significant differences between treatment at 0.05 level (P<0.05);The same as belowFig.4 Analysis of qRT-PCR data of photosynthesis-related genes in leaves of L. barbarum under NaCl stress

续表2 Continued Table 2
2.4 NaCl胁迫下宁夏枸杞光合色素含量的变化
图5显示,宁夏枸杞叶片叶绿素a含量随NaCl胁迫程度的增加呈显著降低的趋势,而100、200、300 mmol/L NaCl处理间无显著差异,它们均显著低于对照;叶绿素b含量也随NaCl胁迫程度增加呈逐渐降低的趋势,且200和300 mmol/L NaCl处理与对照差异显著,但在100、200、300 mmol/L NaCl处理间无显著差异;类胡萝卜素含量随NaCl胁迫程度的增加无显著变化。

图5 NaCl胁迫下宁夏枸杞叶片光合色素含量变化Fig.5 Changes of photosynthetic pigment contents in leaves of L. barbarum under NaCl stress
2.5 NaCl胁迫下宁夏枸杞叶片净光合速率和核酮糖-1,5-二磷酸羧化酶活性的变化
宁夏枸杞叶片的净光合速率和核酮糖-1,5-二磷酸羧化酶(Rubisco)活性均随着NaCl胁迫程度的加深呈现逐渐显著下降的趋势(P<0.05),各NaCl胁迫处理均显著低于对照,200 和300 mmol/L NaCl处理又均低于100 mmol/L NaCl处理,而200 和300 mmol/L NaCl处理相比均无显著差异(图6)。
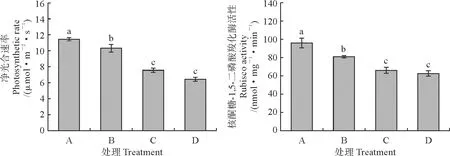
图6 NaCl胁迫下宁夏枸杞叶片净光合速率和核酮糖-1,5-二磷酸羧化酶活性变化Fig.6 Changes of net photosynthetic rate and Rubisco activities in leaves of L. barbarum under NaCl stress
3 讨 论
3.1 NaCl胁迫对宁夏枸杞光合色素相关基因差异表达的影响
植物对外界环境变化响应的重要途径之一是调控叶绿素总含量及类胡萝卜素含量变化[11]。叶绿素代谢是一个动态平衡的过程,盐胁迫会打破这种平衡,使植物细胞色素代谢紊乱,从而直接降低了植物的光合能力[12]。本研究发现,随着NaCl胁迫程度的增加宁夏枸杞叶片的叶绿素含量显著下降,说明高浓度NaCl显著影响了叶绿素的合成或分解。PAO、MCS和CLHs是叶绿素降解途径的关键酶,POR、CAO等是叶绿素合成途径的关键酶[13]。NaCl胁迫下宁夏枸杞叶片PAO和MCS基因上调表达,而CLH2、CAO、POR基因下调表达,表明NaCl胁迫促进了宁夏枸杞叶绿素降解而抑制了叶绿素合成,进而导致叶绿素含量下降。因此,NaCl胁迫可导致宁夏枸杞通过诱导叶绿素合成相关基因下调表达和降解相关基因上调表达,进而调控叶绿素含量下降。
类胡萝卜素具有捕获光能、传递电子、防御光破坏、清除活性氧等作用[14]。番茄红素ε-环化酶(LCYE)将ε环连接到番茄红素上生成δ-胡萝卜素,随后在番茄红素β-环化酶(CYCB)的催化下将β环连接到δ-胡萝卜素的末端生成α-胡萝卜素;CYCB在番茄红素的2个末端各增加一个β环来催化产生β-胡萝卜素[15]。α-胡萝卜素在ε-胡萝卜素羟化酶(CYP97C)和β-胡萝卜素羟化酶(BCH3)的共同作用下最终生成叶黄素[16]。在烟草中过表达番茄红素环化酶基因Ntb-LCY1不仅增加了β-胡萝卜素、叶黄素等类胡萝卜素的含量,同时也提高了清除活性氧的能力,从而提高烟草耐盐和抗旱能力[17]。本研究发现宁夏枸杞叶片CYCB和BCH3基因在NaCl胁迫下上调表达,LCYE基因在高浓度NaCl胁迫下下调表达,而在低NaCl浓度下表达没有显著差异,而且类胡萝卜素含量没有随着NaCl胁迫程度的增加发生显著变化,表明宁夏枸杞在NaCl胁迫下可通过诱导CYCB、BCH3和LCYE基因差异表达进而调控类胡萝卜素含量保持稳定,从而参与调控光合活性或维持ROS代谢平衡。
3.2 NaCl胁迫对宁夏枸杞光反应相关基因差异表达的影响
光合电子传递发生在叶绿体类囊体膜上,由捕光色素复合体(LHC)捕获和传递光子,在放氧蛋白复合体的作用下将水分子氧化放氧。同时,Lhcb3、Lhcb4和Lhcb6在维持光系统的结构稳定和功能上也起重要作用[18]。有研究表明宁夏枸杞在300 mmol/L NaCl胁迫下叶绿体内类囊体膜发生解体,基粒片层数目减少或膨胀,排列疏松,同时双层膜受到破坏,出现大的空泡现象[19]。本研究发现,宁夏枸杞叶片光反应中的捕光色素复合体LHC相关基因Lhca2、Lhca5、Lhcb1、Lhcb3、Lhcb4、Lhcb5、Lhcb6在高浓度NaCl胁迫下均下调表达,而在低浓度NaCl胁迫下表达无显著差异,表明低浓度NaCl胁迫下虽然宁夏枸杞净光合速率和核酮糖-1,5-二磷酸羧化酶活性有下降现象,但其叶绿体结构完整[19],且LHC相关基因正常表达,可维持正常的光合作用和生理代谢,但高浓度NaCl胁迫导致宁夏枸杞叶绿体结构破坏,抑制了捕光色素复合体基因的表达,降低了捕获和传递光子能力,进而显著影响了光合活性。
光系统Ⅱ是一个高度动态的多蛋白复合体,参与各种调节和修复过程。盐胁迫产生的离子胁迫和渗透胁迫会使PSⅡ反应中心受到损伤,从而导致植物的光合电子传递效率和PSⅡ的光合活力降低[20]。PSⅡ相关蛋白CP47(PsbT)和CP43能够结合近30个叶绿素分子从而发挥内在光捕获功能[21]。PsbP和PsbQ是PSⅡ超复合体的外部亚基,负责协调PSⅡ的供体侧和受体侧的活性以及稳定PSⅡ-LHCⅡ超复合物方面具有特定且重要的作用[22],也是维持水的光解反应所必需的。Psb28可能参与了PSⅡ损伤修复,影响PSⅡ-LHCⅡ超级复合物的组装和稳定性[23]。Psb27是PSⅡ重要的组装修复因子之一,可使Mn与PSⅡ放氧复合体OEC更容易结合[24]。在本研究中,PSⅡ相关蛋白基因PsbT、PsbP、PsbQ、Psb27、Psb28在高浓度NaCl胁迫下均下调表达,而在低浓度NaCl胁迫下表达无显著差异,表明高浓度NaCl胁迫影响了PsbT、PsbP、PsbQ、Psb27、Psb28的表达,降低了PSⅡ电子传递效率,进而降低了光合速率。而低浓度NaCl胁迫对PSⅡ相关蛋白基因的影响不明显。
PSⅠ中的PsaN是真核绿藻和植物PSⅠ所特有,也是PSⅠ唯一位于类囊体腔侧的膜外在亚基。PsaD对于PSⅠ-LHCⅠ复合物的正确组装非常必要,如拟南芥中PsaD含量降低会导致PSⅠ复合物成比例的下降[25]。铁氧还蛋白系统是叶绿体光驱动电子传输、将还原力输出到细胞质和NADP+生成的调节器[26]。叶绿体类囊体膜上的F型ATP合酶在质子电化学梯度的作用下,利用底物ADP和Pi合成ATP。在本研究中,PSⅠ相关蛋白基因PsaN和PsaD、铁氧还蛋白基因petF以及F型ATP合酶基因ATPδ、ATPγ和ATPε在高浓度NaCl胁迫下均下调表达,但在低浓度NaCl胁迫下表达无显著差异。这表明高浓度NaCl胁迫可显著影响PSⅠ相关蛋白基因的表达,降低了PSⅠ电子传递效率,而低浓度NaCl胁迫对PSⅠ相关蛋白基因的影响不明显。
3.3 NaCl胁迫对宁夏枸杞卡尔文循环相关基因差异表达的影响
叶绿体中依赖NADP的苹果酸脱氢酶(MDH)能够平衡叶绿体中ATP/NADPH比例的稳定[27]。叶绿体型果糖-1,6-二磷酸酶(FBP)是卡尔文循环中的关键酶之一,参与CO2接受体再生的反应,催化果糖-1,6-二磷酸生成果糖-6-磷酸,并且也参与叶绿体中淀粉的合成[28]。3-磷酸甘油醛脱氢酶(GAPDH)活性水平与卡尔文循环的运转速率有关[29],宁夏枸杞叶片中GAPDH的活性也随着NaCl胁迫程度的增加而显著下降[30]。Rubisco是卡尔文循环中最重要的限速酶,可催化植物光合作用中CO2的固定,逆境胁迫引起的Rubisco活性下降会使1,5-二磷酸核酮糖和3-磷酸甘油的含量下降并抑制无机磷的再生,进而影响光合作用[31]。本研究发现,NaCl胁迫可诱导宁夏枸杞MDH、FBP、rbcS和GAPDH下调表达,而且Rubisco活性和叶片净光合速率逐渐下降。由于高浓度NaCl胁迫破坏了宁夏枸杞叶绿体结构[19],可能通过影响光合色素平衡和光反应系统的稳定,诱导卡尔文循环相关基因下调表达,相关蛋白(酶)表达量下降,卡尔文循环代谢活性降低,进而影响光合作用。
综上所述,NaCl胁迫条件下,宁夏枸杞叶片中的叶绿素含量下降,净光合速率和Rubisco活性亦下降,大部分光合作用相关差异基因下调表达。宁夏枸杞通过光合作用相关基因的差异表达,参与调控光合活性以响应NaCl胁迫(图7)。
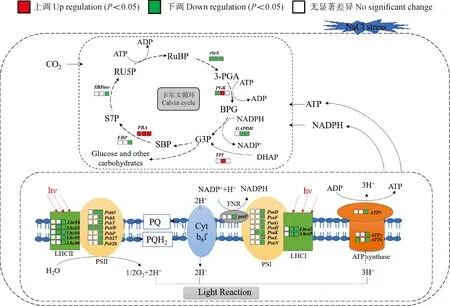
图7 宁夏枸杞响应NaCl胁迫的光合作用相关基因差异表达调控网络Fig.7 Regulatory network of photosynthesis-related differential genes in L. barbarum under NaCl stress
