盐胁迫对甜樱桃砧木生理特性及光合荧光参数的影响
2023-02-21李焕勇廖方舟刘景超王芝学杨丽芳
李焕勇,廖方舟,刘景超,王芝学,杨丽芳
(天津市农业科学院 林业果树研究所,天津 300384)
土壤盐渍化已经成为全球重要的资源与环境问题,对农业生产和生态环境造成不同程度的影响,严重威胁着全球粮食安全。目前,全球土壤盐渍化程度呈上升趋势,中国各类盐碱土总面积约为3.69×107hm2,占可用耕地面积的4.88%,主要分布在东北、西北、华北内陆以及沿海地区等,合理地开发利用盐碱地资源,对中国农业生产以及生态环境可持续发展具有重要意义[1]。
盐渍环境中的土壤水势降低,会导致其中的植物吸收水分困难或水分外排,造成渗透胁迫[2]。但植物在盐渍条件下可以通过有机渗透调节物质的代谢来降低自身水势,进而减轻盐渍环境对自身造成的损伤[1]。盐胁迫还可造成植物膜脂过氧化现象,影响细胞膜通透性,进而妨碍植物生长发育和形态建成[3-4]。耐盐植物在长期进化过程中形成了复杂且有效的抗氧化体系,主要包括以抗坏血酸(AsA)、类胡萝卜素(Car)为主的非酶促抗氧化系统,以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等为主的酶促抗氧化系统[5-7]。叶绿体作为植物对逆境最敏感的细胞器,在盐胁迫条件下会受到一定程度的损伤,进而影响到植物的光合作用。盐胁迫造成的渗透胁迫破坏了植物PSⅡ系统反应中心,降低了植物的光合电子传递效率和PSⅡ的光合作用活力[8-9]。
甜樱桃(Cerasusavium)为蔷薇科(Rosaceae)樱桃属(Cerasus)落叶果树,在北方素有“春果第一枝”的美称。甜樱桃对盐分敏感,通过嫁接可以提高其耐盐性,选育优质抗逆砧木可以提高甜樱桃的抗逆性。当前已对甜樱桃砧木响应盐胁迫的光合特性进行了一定研究[10-12],但对其在盐胁迫下的渗透调节物质、抗氧化酶活性及叶绿素荧光特性等鲜见报道。本研究以栽培中常用甜樱桃砧木‘吉塞拉6号’(Gisela 6)和‘考特’(Colt)为试验材料,研究不同浓度NaCl处理对两个甜樱桃砧木叶片中主要渗透调节物质、抗氧化酶活性及光合荧光特性的影响,探讨甜樱桃砧木耐盐生理机制,为甜樱桃砧木耐盐机制研究及优良砧木的开发利用提供理论依据。
1 材料和方法
1.1 试验材料
供试材料为生长状况一致且长势良好的1年生‘吉塞拉6号’(G6)和‘考特’(KT)砧木苗,每个品种选择30株定植于装有混合基质(蛭石、珍珠岩和草炭土体积比1∶1∶3)的花盆中,在室外避雨棚下培养,苗木正常生长1个月后进行盐胁迫处理。
1.2 材料处理
采用完全随机区组设计,共设置0、50、100、150 mmol·L-1NaCl等4个浓度盐胁迫处理水平,每个处理设置3次重复,每个重复10株幼苗。为防止盐分流失,花盆底部放置塑料托盘,每次浇水后将流出的溶液及时倒回花盆内。盐胁迫处理14 d后采集叶片样品保存于液氮中用于生理指标检测,并对植株进行光合气体交换参数和叶绿素荧光参数的测定。
1.3 测定指标及方法
1.3.1 生理指标叶片可溶性糖含量测定采用蒽酮法,可溶性蛋白含量测定采用考马斯亮蓝染料结合法,脯氨酸含量测定采用茚三酮法,丙二醛含量测定采用硫代巴比妥酸法,超氧化物歧化酶(SOD)活性测定采用氮蓝四唑光还原法,过氧化物酶(POD)活性的测定采用愈创木酚还原法[13-14]。
1.3.2 光合气体交换参数和绿叶素荧光参数采用Li-6800便携式光合-荧光测量仪(Li-COR,USA)进行叶片的光合气体交换参数和叶绿素荧光参数的测定,测定控制光强度为1500 μmol·m-2·s-1,CO2浓度为400 μmol·mol-1,相对湿度为65%,每个处理测量5次。将所测幼苗叶片在夜间进行充分暗适应后,测定暗适应初始荧光(Fo)和最大荧光(Fm);白天充分光照后,测定净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等;同步执行饱和脉冲测量记录光适应下初始荧光(Fo′)、光适应下最大荧光(Fm′)和稳态荧光(Fs),并计算光系统Ⅱ最大光化学效率(Fv/Fm)、光化学淬灭系数[qP=(Fm′-Fs)/(Fm′-Fo)]和非光化学淬灭系数[NPQ=(Fm-Fm′)/Fm′]。
1.4 数据处理
利用Microsoft Excel 2016对原始数据进行整理、标准差分析及图形的绘制,利用SPSS 19.0软件进行单因素方差分析,采用LSD法进行多重比较,方差分析在P<0.05时认为差异显著。
2 结果与分析
2.1 盐胁迫对两个甜樱桃砧木幼苗表观性状的影响
随着NaCl处理胁迫浓度的升高,两个甜樱桃砧木‘吉塞拉6号’(G6)和‘考特’(KT)的生长状况均逐渐变差,侧枝减少,叶片表现出焦边、卷曲、落叶等症状,其受盐害程度逐渐加重,不同NaCl处理之间性状差异明显(图1)。
2.2 盐胁迫对两个甜樱桃砧木叶片渗透调节物质含量的影响
2.2.1 可溶性糖含量随着NaCl处理浓度的升高,甜樱桃砧木叶片中可溶性糖含量在‘吉塞拉6号’中呈现先增加后减少的趋势,而在‘考特’中却呈逐渐增加趋势(图2,A);在盐胁迫条件下,‘吉塞拉6号’叶片中可溶性糖含量迅速增加并维持在较高水平,在100 mmol·L-1NaCl处理时达到最大值(77.98 mg·g-1),并与其他处理之间差异显著(P<0.05);‘考特’叶片可溶性糖含量在150 mmol·L-1NaCl处理达到最大(72.92 mg·g-1),也与其他处理存在显著差异。
2.2.2 可溶性蛋白含量图2,B显示,‘吉塞拉6号’和‘考特’叶片中可溶性蛋白的含量均随着NaCl处理浓度的升高而逐渐增加,在150 mmol·L-1NaCl处理时达到最大,分别达到2.93 mg·g-1和3.06 mg·g-1,分别比对照显著增加了51.7%和19.1%,其余浓度NaCl处理也与对照之间均存在显著差异(P<0.05)。随着NaCl处理浓度的升高,‘吉塞拉6号’叶片可溶性蛋白的增加量明显高于‘考特’。

A.吉塞拉6号(G6);B.考特(KT);0、50、100、150分别表示0、50、100、150 mmol·L-1NaCl处理图1 盐胁迫下两个甜樱桃砧木植株形态和叶片表型变化A.Gisela 6 (G6);B.Colt (KT);0,50,100 and 150 indicate 0,50,100,and 150 mmol·L-1NaCl treatment,respectivelyFig.1 Plant morphological changes and leaf phenotypic changes of two sweet cherry rootstocks under salt stress
2.2.3 脯氨酸含量由图2,C可知,两个甜樱桃砧木叶片中脯氨酸含量也均随着NaCl处理浓度的升高而逐渐增加,且各浓度盐胁迫处理之间及其与对照之间均存在显著性差异(P<0.05);在相同盐胁迫浓度下,‘考特’叶片的脯氨酸含量均不同程度高于‘吉塞拉6号’,它比对照的增加幅度也大于‘吉塞拉6号’。其中,在150 mmol·L-1NaCl处理浓度下,‘吉塞拉6号’和‘考特’叶片的脯氨酸含量与对照相比分别增加了2.14倍和2.87倍。

G6.吉塞拉6号;KT.考特;不同小写字母表示同一品种不同处理间差异显著(P<0.05),下同图2 盐胁迫下两个甜樱桃砧木叶片渗透调节物质含量的变化G6.Gisela 6;KT.Colt;Different normal letters indicate significant differences among different treatments of the same variety at the level of 0.05 (P<0.05);the same as below Fig.2 The contents of osmotic adjustment substance in leaves of two sweet cherry rootstocks under salt stress
2.3 盐胁迫对两个甜樱桃砧木叶片MDA含量及SOD和POD活性的影响
2.3.1 丙二醛含量由图3,A可知,两个甜樱桃砧木叶片丙二醛含量均随着NaCl处理浓度的升高而增加,且在不同浓度NaCl处理间存在显著差异;与对照相比,‘吉塞拉6号’和‘考特’叶片丙二醛含量分别在50和100 mmol·L-1浓度开始存在显著差异(P<0.05),在150 mmol·L-1NaCl处理时分别显著增加了26.3%和15.4%。在相同浓度NaCl处理下,‘吉塞拉6号’叶片丙二醛含量均明显高于相应‘考特’,且比对照增幅也高于‘考特’。
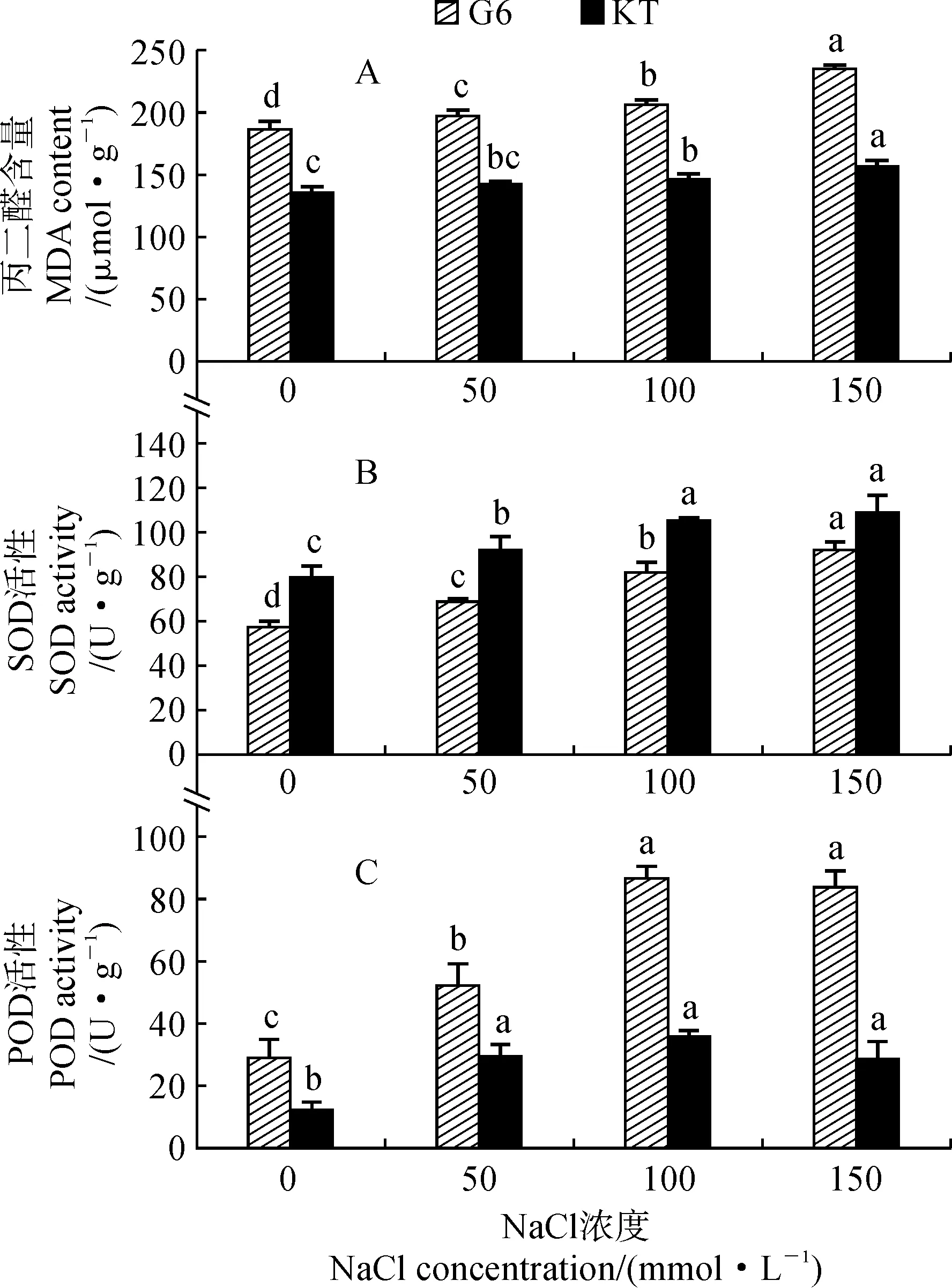
图3 盐胁迫下两个甜樱桃砧木叶片丙二醛含量及SOD和POD活性的变化Fig.3 The MDA content and SOD and POD activities in leaves of two sweet cherry rootstocks under salt stress
2.3.2 SOD活性两个甜樱桃砧木叶片中SOD活性随着NaCl处理浓度的增加均呈现持续增加的变化趋势,在150 mmol·L-1NaCl处理时分别达到92.11和109.01 U·g-1,分别比对照显著增加了60.5%和36.3%,‘吉塞拉6号’的增加幅度明显大于‘考特’(图3,B)。‘吉塞拉6号’叶片中SOD活性在不同浓度处理之间均存在显著性差异(P<0.05),而‘考特’叶片中SOD活性在50 mmol·L-1NaCl处理时与对照相比无显著变化,在100和150 mmol·L-1NaCl处理时显著高于对照和50 mmol·L-1NaCl处理,但它们之间没有显著性差异。
2.3.3 POD活性随着NaCl处理浓度的增加,两个甜樱桃砧木叶片中POD活性均呈现出先升高后下降的变化趋势,并均显著高于相应对照,且均在100 mmol·L-1NaCl处理时达到最大值,此时分别比对照增加了2倍和1.97倍(图3,C)。在相同处理条件下,‘吉塞拉6号’叶片的POD活性均明显高于‘考特’;‘吉塞拉6号’叶片的POD活性表现为100和150 mmol·L-1浓度NaCl处理均显著高于50 mmol·L-1NaCl处理(P<0.05),而‘考特’在3个浓度处理之间不存在显著差异。
2.4 盐胁迫对两个甜樱桃砧木叶片光合气体交换参数的影响
2.4.1 净光合速率两个甜樱桃砧木叶片净光合速率(Pn)随着NaCl处理浓度的升高而逐渐降低,且各盐胁迫处理均与对照差异显著;在150 mmol·L-1NaCl处理时,‘吉塞拉6号’和‘考特’的Pn与对照相比分别降低了85.7%和74.2%,‘吉塞拉6号’的下降幅度显著大于‘考特’(图4,A)。在相同处理条件下,‘吉塞拉6号’的Pn均明显高于相应处理的‘考特’。‘吉塞拉6号’的Pn在各处理之间均存在显著性差异(P<0.05),而‘考特’的Pn在100与150 mmol·L-1NaCl处理之间差异不显著。
2.4.2 气孔导度随着NaCl处理浓度的增加,两个甜樱桃砧木叶片的气孔导度(Gs)变化趋势与Pn趋势相似。两个甜樱桃砧木叶片的Gs在不同浓度NaCl处理下均明显低于对照;‘吉塞拉6号’和‘考特’的Gs在150 mmol·L-1NaCl处理下分别比对照显著降低了41.7%和63.7%,‘考特’的Gs下降幅度显著大于‘吉塞拉6号’,且‘考特’的Gs在各处理条件下均低于相应的‘吉塞拉6号’(图4,B)。‘考特’的Gs在各盐浓度处理下与对照相比均存在显著性差异(P<0.05),而‘吉塞拉6号’的Gs仅在100和150 mmol·L-1NaCl处理时与对照有显著性差异。
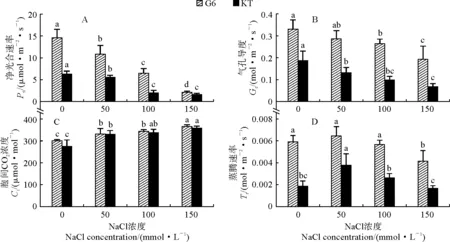
图4 盐胁迫下两个甜樱桃砧木叶片光合气体交换参数的变化Fig.4 The photosynthetic gas exchange parameters in leaves of two sweet cherry rootstocks under salt stress
2.4.3 胞间CO2浓度图4,C显示,随着NaCl处理浓度的增加,两个甜樱桃砧木叶片的胞间CO2浓度(Ci)表现出逐渐升高的趋势,‘吉塞拉6号’和‘考特’在150 mmol·L-1NaCl处理下分别比对照显著增加了21.7%和30.6%;两个砧木叶片的Ci在盐胁迫处理下增加幅度均不大,但各处理与对照之间均存在显著性差异(P<0.05)。
2.4.4 蒸腾速率由图4,D可知,两个甜樱桃砧木叶片的蒸腾速率(Tr)均随着NaCl处理浓度的增加呈现出先升高后降低的变化趋势,并均在50 mmol·L-1NaCl处理时达到最大值,期间‘吉塞拉6号’始终明显高于相同条件下的‘考特’;与对照相比,仅‘吉塞拉6号’的150 mmol·L-1NaCl处理、‘考特’的50 mmol·L-1NaCl处理有显著差异,两品种其他盐胁迫处理与对照之间均不存在显著性差异。
2.5 盐胁迫对两个甜樱桃砧木叶片叶绿素荧光参数的影响
首先,初始荧光(Fo)表示的是光系统Ⅱ(PSⅡ)反应中心处于完全开放时的荧光水平。由图5,A可知,两个甜樱桃砧木叶片的Fo随着NaCl处理浓度的升高整体均呈现上升的趋势,但‘吉塞拉6号’仅在150 mmol·L-1NaCl时比对照增加显著,‘考特’在100和150 mmol·L-1NaCl时增加显著;与对照相比,‘吉塞拉6号’和‘考特’的Fo在150 mmol·L-1NaCl时分别显著增加29.0%和68.7%,‘考特’增幅明显大于‘吉塞拉6号’。两个甜樱桃砧木的Fo在对照处理和50 mmol·L-1NaCl处理时表现为‘吉塞拉6号’高于‘考特’,而在其余处理下则表现相反。最大荧光(Fm)反映了PSⅡ反应中心处于完全关闭时的荧光水平。两个甜樱桃砧木叶片的Fm随着NaCl处理浓度的增加呈现不规律的变化趋势,但各浓度盐处理之间及其与对照之间均无显著差异(图5,B)。
其次,Fv/Fm反映了暗适应下植物PS Ⅱ 潜在最大光化学效率。随着NaCl处理浓度的升高,‘吉塞拉6号’和‘考特’叶片的Fv/Fm基本上均呈现降低的趋势,但均仅在150 mmol·L-1NaCl处理时与对照达到显著差异水平(P<0.05),降幅分别为9.0%和15.0%,且‘吉塞拉6号’高于‘考特’(图5,C)。
再次,非光化学淬灭系数(NPQ)主要反映天线色素所吸收光能中以热能形式耗散掉的能量部分,而光化学淬灭系数(qP)反映了天线色素捕获的光能中用于光化学反应的能量部分。随着NaCl处理浓度的升高,两个甜樱桃砧木的NPQ呈现逐渐升高的趋势,而qP呈现逐渐降低的趋势;与对照相比,‘吉塞拉6号’的NPQ和qP在各浓度盐胁迫下均差异显著,而‘考特’则分别仅在100~150 mmol·L-1和150 mmol·L-1NaCl处理时差异显著;在150 mmol·L-1NaCl处理时,‘吉塞拉6号’和‘考特’的NPQ与对照相比分别显著增加了73.2%和117.9%,而两品种的qP则比对照分别显著减少了61.1%和62.0%,即‘考特’的NPQ变化幅度明显大于‘吉塞拉6号’(图5,D、E)。

图5 盐胁迫下两个甜樱桃砧木叶片叶绿素荧光参数的变化Fig.5 The chlorophyll fluorescence parameters in leaves of two sweet cherry rootstocks under salt stress
另外,光合电子传递效率(ETR)主要反映了实际光强条件下的表观电子传递效率。图5,F显示,随着NaCl处理浓度的升高,‘吉塞拉6号’的ETR呈现逐渐降低的趋势,且在各处理及对照间均存在显著差异,其在150 mmol·L-1NaCl时比对照显著减少了79.1%(P<0.05);而‘考特’的ETR随着NaCl处理浓度的升高呈现出先升高后降低的变化趋势,且在各处理及对照间均存在显著差异,其在50 mmol·L-1NaCl时最大并显著高于对照,而在其余浓度盐胁迫下显著低于对照(P<0.05)。
可见,随着NaCl处理浓度的升高,两个甜樱桃砧木叶片的Fo、NPQ均呈现上升的变化趋势,而Fv/Fm、qP和ETR则表现出逐渐降低的变化趋势。
3 讨 论
植物在盐渍条件下可以通过调整体内各种新陈代谢途径,控制各种有机代谢产物的合成和降解及氧化酶活性等来维持细胞内水势平衡,进而可以调控自身生产及渗透调节。在盐胁迫条件下,植物体内可溶性糖、可溶性蛋白及脯氨酸等物质参与渗透调节维持渗透平衡[1]。可溶性糖在盐胁迫条件下还可作为能量物质,并对维持膜的稳定具有重要作用[15-16]。研究表明,盐胁迫条件下小果白刺[1]、流苏[17]、耐盐花生[18]幼苗中可溶性糖含量均逐渐增加。本研究也发现,NaCl处理促进了两个甜樱桃砧木叶片中可溶性糖含量的积累,而‘吉塞拉6号’在高浓度NaCl处理时出现下降趋势,可能是高盐胁迫下能量消耗加剧所致,这与胡爱双等对八棱海棠的研究结果相似[19]。可溶性蛋白作为一种亲水性物质,盐胁迫促进可溶性蛋白的积累可以增加水分的束缚,降低细胞渗透势[20]。本研究中随着NaCl处理浓度的升高两个甜樱桃砧木叶片中可溶性蛋白含量均逐渐增加,可能是由于盐胁迫促进了甜樱桃砧木的蛋白质合成代谢,造成可溶性蛋白的逐渐积累,从而降低细胞渗透势来适应盐胁迫环境。这与张娅等对小麦的耐盐性研究结果相一致[21]。盐胁迫下植物体内脯氨酸含量的增加可以调节体内渗透势,防止因盐胁迫造成过度失水而对细胞造成伤害。本研究发现,两个甜樱桃砧木叶片中脯氨酸含量随着NaCl处理浓度的升高而呈现出逐渐增加趋势,脯氨酸的积累量与NaCl处理浓度之间呈现正相关的关系,这与小果白刺[1]及八棱海棠等[19]研究结果一致,这是由于在盐胁迫下甜樱桃砧木体内通过脯氨酸积累来调节体内微环境,从而可增强对盐胁迫的适应能力。
同时,在盐胁迫条件下,植物体内活性氧积累,会对植物造成氧化损伤[22],而植物体内SOD、POD等抗氧化酶可以通过清除活性氧来减少膜系统的伤害,降低其对植物体造成的损伤[23]。丙二醛作为膜脂过氧化的产物之一,其含量的多少反映了植物对盐胁迫抵抗能力的强弱[24]。本研究表明,随着NaCl处理浓度的升高,甜樱桃砧木叶片中丙二醛含量逐渐增加,这是由于随着胁迫浓度的加强,甜樱桃砧木发生膜脂过氧化作用,破坏了膜结构的完整性,从而导致丙二醛含量增加。这与盐胁迫下葡萄、榆树等丙二醛含量变化趋势相一致[25-26]。同时,甜樱桃砧木叶片中SOD活性随着处理浓度的升高而增加,这说明在盐胁迫下甜樱桃砧木的抗氧化能力增强,可以清除大量过剩的活性氧,降低活性氧对甜樱桃砧木细胞膜的损伤;甜樱桃砧木叶片中POD活性随着NaCl处理浓度的升高而表现出先升高后降低的变化趋势,且‘吉塞拉6号’的POD活性明显高于‘考特’,这与对苹果砧木及梅花的研究结果一致[27-28],这可能是由于‘吉塞拉6号’具有较强的抗盐性,可以通过提高POD的活性来减轻盐胁迫对植物的伤害,而盐胁迫浓度过高时已超出了甜樱桃砧木的耐受能力,其POD活性随之降低,自身调节能力也同时降低。
光合作用为植物获取能量的重要途径,盐胁迫对植物自身光合作用效率会产生显著影响。许多研究发现,盐胁迫条件下植物叶片Pn、Gs和Tr会发生不同程度的降低[29-30]。盐胁迫影响植物叶片Pn下降的主要原因是受气孔或非气孔因素的限制,如果Pn和Ci均降低时,认为气孔开度变小为Pn降低的主要原因,光合作用受气孔限制因素影响;当Pn降低而Ci升高时,认为光合作用下降受非气孔因素影响,是由于盐胁迫破坏了光合机构,影响了电子传递速率[31]。本研究发现,盐胁迫对两个甜樱桃砧木叶片的Pn、Gs、Ci和Tr均具有显著影响,随着NaCl处理浓度的升高,甜樱桃砧木叶片的Pn、Gs逐渐降低,而Ci逐渐升高。据此认为,非气孔限制可能是盐胁迫下两种甜樱桃砧木叶片Pn下降的主要因素,可能是由于盐胁迫导致甜樱桃砧木叶片光合机构受损,影响了RuBP羧化酶效率降低和光合作用表观量子效率[32]。已有研究发现,盐胁迫降低了黄连木及葡萄砧木叶片的Gs[33-34],同时本研究中甜樱桃砧木叶片Gs也受盐胁迫影响而下降,这可能是由于盐胁迫造成渗透胁迫,水分向地上部分运输受阻,叶片保卫细胞失水导致气孔逐渐闭合。
叶绿素荧光参数包含丰富的光合信息,可反映植物在逆境条件下光系统对光能的吸收、分配、传递和耗散等情况,逆境胁迫对光合作用的影响程度都可依据叶绿素荧光参数的变化来显示,是检测盐胁迫对植物光合机构伤害程度的重要指标[35-38]。Fv/Fm能够反映植物PSⅡ潜在最大光化学效率,表示植物叶片的光抑制程度。研究发现正常生长植物叶片Fv/Fm经过充分暗适应后比较恒定,一般处于0.80~0.85之间,当Fv/Fm<0.8时,PSⅡ反应中心可能由于胁迫造成一定损伤[37-40]。本研究发现,甜樱桃砧木叶片的Fv/Fm经NaCl处理后总体呈现降低的变化趋势,但在低浓度(≤50 mmol·L-1NaCl)处理时Fv/Fm值在恒定范围内,在高浓度(≥100 mmol·L-1NaCl)处理时Fv/Fm<0.80,这表明低浓度NaCl处理对甜樱桃叶片的PSⅡ反应机构影响不大,而在高浓度NaCl处理导致植物细胞结构受损,破坏了细胞的光合机构,电子传递速率和光化学量子效率遭到光抑制,降低了植株对光能的利用率,进一步证明了光合作用效率下降是受非气孔因素影响,这与甜樱桃、葡萄等相关研究结果一致[41-42]。随着NaCl处理浓度的升高,甜樱桃砧木叶片中NPQ表现出升高的变化趋势,而qP和ETR均呈现下降的变化趋势,说明盐胁迫下甜樱桃砧木通过降低PSⅡ原初光能转换效率和抑制电子传递效率,以减少用于光化学电子传递的份额,减轻光合器官受到损伤程度;同时PSⅡ反应中心会启动保护性调节机制,通过增加热耗散来消耗过多激发能,从而实现自我保护[43],盐胁迫下辣椒[34]、葡萄砧木[44]及八棱海棠等[45]均表现出相似的保护机制。
综上所述,盐胁迫条件下,甜樱桃砧木通过增加叶片可溶性糖、可溶性蛋白及脯氨酸等渗透调节物质含量,缓解渗透胁迫对其造成的伤害;另外还通过提高SOD和POD活性,提高抗氧化能力,清除体内过剩活性氧,减轻盐胁迫造成的氧化损伤。同时,盐胁迫抑制了甜樱桃砧木的光合作用,其主要受限制因素为非气孔因素;盐胁迫下甜樱桃砧木叶片细胞光合机构受损,电子传递速率和光化学量子效率受到光抑制,降低了植株对光能的利用率,导致光合速率降低。
