青稞HD-Zip基因家族鉴定及其在非生物胁迫下的表达特性
2023-02-21祁存英杨成兰马银花段瑞君
祁存英,李 媛,杨成兰,马银花,段瑞君
(青海大学 生态环境工程学院,西宁 810016)
同源异型域-亮氨酸拉链蛋白(homedomain-leucine zipper,HD-Zip)是一类高等植物特有的转录因子,在植物的生长发育抗胁迫过程中发挥重要的作用[1]。该转录因子主要包括两个保守结构域,分别是负责序列特异性DNA结合的同源结构域(homeodomain,HD)和促进蛋白质与蛋白质相互作用的亮氨酸拉链结构域(leucine zipper,LZ)[2]。根据氨基酸序列、保守基序和蛋白功能的不同,植物HD-Zip转录因子分为4大亚类(HD-Zip Ⅰ-Ⅳ)[3]:Ⅰ亚家族仅含HD和LZ 结构域,Ⅱ亚族额外有一个N 端保守区域(N-term)[4];Ⅲ亚族较复杂,除HD 和LZ 结构域之外,还包含保守的START结构域及与之相邻的SAD结构域和 MEKHLA 结构域;亚族Ⅳ蛋白除缺少MEKHLA结构域外,与亚族Ⅲ结构上类似,但识别的蛋白序列有较大差异[5]。
最近研究表明,HD-Zip转录因子广泛参与了植物的生长发育、新陈代谢、激素调节以及生物和非生物胁迫响应的各个阶段[6],其中HD-Zip亚族Ⅰ成员主要参与植物对各种非生物胁迫因子的应答反应、激素、器官发育调控和光信号应答过程[7];亚家族Ⅱ成员除受干旱、高盐、冷害等非生物胁迫因素诱导外[8],在植物光响应、生长素信号转导及避荫反应中也发挥重要作用[6];亚族Ⅲ成员在拟南芥发育过程中调控胚胎形态发生、顶端分生组织形成、叶片极性建立和维管组织细胞分化[9],同时在植物不同组织不同发育时期发挥协同或拮抗作用[10];Ⅳ亚家族成员主要调控花青素积累、表皮细胞分化、根的生长和毛状体的形成[11],同时也参与植物表皮细胞层的发育和维持、脂质转运和非生物胁迫响应[12]。
青稞(HordeumvulgareL.var.nudumHook.f.)又称裸大麦,是中国藏区同胞不可替代的主粮,主要分布在海拔3 000~5 000 m的高寒地带[13],用途广泛且具有多种优异栽培种性[14]。干旱等非生物胁迫是制约青稞生产的主要限制因子,发掘改良其抗逆性的关键调控基因对青稞改良具有重要意义。棉花[5]、拟南芥[15]、水稻[16]、小麦[17]、玉米[18]、蒺藜苜蓿[19]和大麦[20]等许多植物中,对HD-Zip转录因子的基因家族分析及基因功能研究表明其在植物抗逆中发挥着重要作用,但在青稞中尚未有相关分析及研究。因此,本研究利用已公布的青稞基因组信息[21-22],通过生物信息学方法鉴定青稞HD-Zip基因家族成员,分析其基因结构、启动子顺式元件分布特征以及在非生物胁迫下不同组织中的表达特点,为进一步开展高原作物青稞HD-Zip基因家族的基因功能研究及其在青稞抗逆改良中的应用奠定基础。
1 材料和方法
1.1 材料与处理
实验材料为青稞(HordeumvulgareL.var.nudumHook.f.)品种‘肚里黄’,由青海省青稞遗传育种重点实验室提供。
将14日龄青稞水培(改良霍格兰营养液)幼苗用含有200 mmol/L NaCl(盐)、18%终浓度PEG-6000(模拟干旱)的改良霍格兰营养液及4 ℃低温(冷)处理48 h,之后解除胁迫恢复正常培养48 h。采集各时间节点根和叶组织样品,试剂盒法提取RNA(TaKaRa,Code No.9769)。
1.2 实验方法
1.2.1HvvHD-Zip基因家族成员鉴定及其理化性质分析青稞基因组数据从http://www.ibgs.zju.edu.cn/ZJU_barleygenome.Htm网站和NCBI数据库(https://ftp.ncbi.nlm.nih.gov/genomes/genbank/plant/Hordeum_vulgare/all_assembly_versions/GCA_004114815.1_Hulless_Barley_ass.V2/)下载获得;通过植物转录因子数据库Plant TFDB V5.0和Tair数据库下载拟南芥(Arabidopsisthaliana)HD-Zip蛋白序列;通过Pfam 35.0数据库(http://pfam.xfam.org/)分别下载HD和LZ结构域的隐马尔科夫模型(HMM)PF00046和PF02183,使用HMMER搜索工具对青稞基因组数据进行初步搜索鉴定;同时以拟南芥HD-Zip蛋白序列作为查询序列,采用本地Blast的Blastp程序检索(设置参数e<1×e-10,相似性>40%),获得与拟南芥相似性较高的青稞HD-Zip序列,整合以上两步所得候选序列;利用Pfam 35.0数据库、InterPro数据库(https://www.ebi.ac.uk/interpro/)和NCBI-CDD在线工具(https://www.ncbi.nlm.nih.gov/cdd)进行家族成员验证分析,去除结构域不符或者残缺的候选序列,剩余基因鉴定为青稞HD-Zip基因家族成员(HvvHD-Zip)。
利用Expasy数据库(https://www.expasy.org/)分析青稞HD-Zip蛋白分子量等理化性质参数;亚细胞定位信息利用Plant-mPLoc数据库(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)预测。
1.2.2HvvHD-Zip基因染色体定位分析在青稞基因组数据库中搜索HD-Zip基因的染色体定位信息,利用MapChart 2.32软件(https://www.wur.nl/en/show/Mapchart.htm)生成染色体分布图。
1.2.3HvvHD-Zip基因多序列比对、系统发育、基因结构和蛋白保守基序分析使用MEGA11.0软件(https://www.megasoftware.net/)的Clustal W程序对青稞HD-Zip蛋白进行多序列比对,将比对结果载入GeneDoc软件(https://genedoc.software.informer.com/)进行同源序列比对作图与分析。
使用MEGA11.0软件的Clustal W程序进行青稞、大麦(HordeumvulgareL.)、拟南芥和水稻(Oryzasativa)(水稻RGAP数据库,Rice Genome Annotation Project,http://rice.uga.edu/)HD-Zip蛋白序列的多重比对;采用邻接法(neighbor-joining,NJ)构建系统进化发育树,Bootstrap值设为1000,其余参数保持默认。最后生成的图形使用Evolview v2(https://www.evolgenius.info/evolview-v2/)进行美化。
使用GSDS(http://gsds.cbi.pku.edu.cn/)在线预测HvvHD-Zip基因结构;利用MEME (http://memesuite.org/tools/meme)工具预测该基因家族的保守基序,最大基序数量为20,基序宽度设在6~100之间,其余参数设置为默认,最后用TBtools V1.0983 软件[23]进行可视化。
1.2.4HvvHD-Zip基因顺式作用元件分析提取HvvHD-Zip基因5′端上游2.0 kb长序列作为启动子序列,在Plant CARE在线网站(http://bioinformatics.psb.ugent.be/ webtools/plantcare/Html/)进行其顺式作用元件分析;利用TBtools筛选保留常见功能元件并绘制可视化图片。
1.2.5HvvHD-Zip基因非生物胁迫表达分析参考德国莱布尼兹植物遗传与作物研究所(IPK)数据库(https://www.ipk-gatersleben.de/)公布的大麦各组织表达量转录组数据,结合已发表的大麦HD-Zip基因家族成员组织表达及非生物胁迫特点研究[24],本研究筛选出22个青稞HD-Zip基因家族成员进行后续qRT-PCR实验。
以青稞HvqActin基因作为内参基因,以不同胁迫处理条件下根和叶组织样品的cDNA为模板,利用NCBI在线引物设计网站(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)对选取的22个HvvHD-Zip基因进行qRT-PCR实验引物设计(表1);qRT-PCR反应体系参考荧光定量试剂盒(Tiangen,RealUniversal Color PreMix SYBR Green,FP201)进行;每个样品设置3个生物学重复,所得数据采用2-ΔΔCT法计算基因相对表达量,GraphPad prism 8.0软件(https://www.graphpad.com/)进行数据分析、作图及差异显著性分析。

表1 qRT-PCR引物Table 1 Primers used for qRT-PCR
2 结果与分析
2.1 HvvHD-Zip基因家族成员鉴定与理化性质分析
从青稞基因组中共鉴定出41个HvvHD-Zip家族成员,根据其在染色体上的位置依次命名为HvvHD-ZipⅠ-1~Ⅳ-13。HvvHD-Zip家族基因编码氨基酸长度范围在197~885 aa;分子量范围在19 914.36~94 014.87 Da;等电点介于4.62~9.97之间,其中有26个基因等电点<7.0,约占总数的63.4%,推测大部分蛋白为酸性蛋白;除HvvHD-ZipⅣ-7外(不稳定指数为39.57<40),其余均为不稳定蛋白;且所有HvvHD-Zip蛋白均表现为亲水性(GRAVY<0);亚细胞定位预测结果表明,HvvHD-Zip家族蛋白均定位在细胞核中,符合一般转录因子生物学特性(表2)。
2.2 HvvHD-Zip基因染色体定位分析
HvvHD-Zip基因的染色体物理定位结果(图1)显示,除因基因组差异导致的12个基因无染色体位置信息外(表2),其余29个基因分布在7条染色体上,且分布不均匀,其中5号染色体上分布最多(10个),2号和6号染色体分布较多(5个),3和7号染色体各分布1个基因(HvvHD-ZipⅢ-5、HvvHD-ZipⅡ-3)。
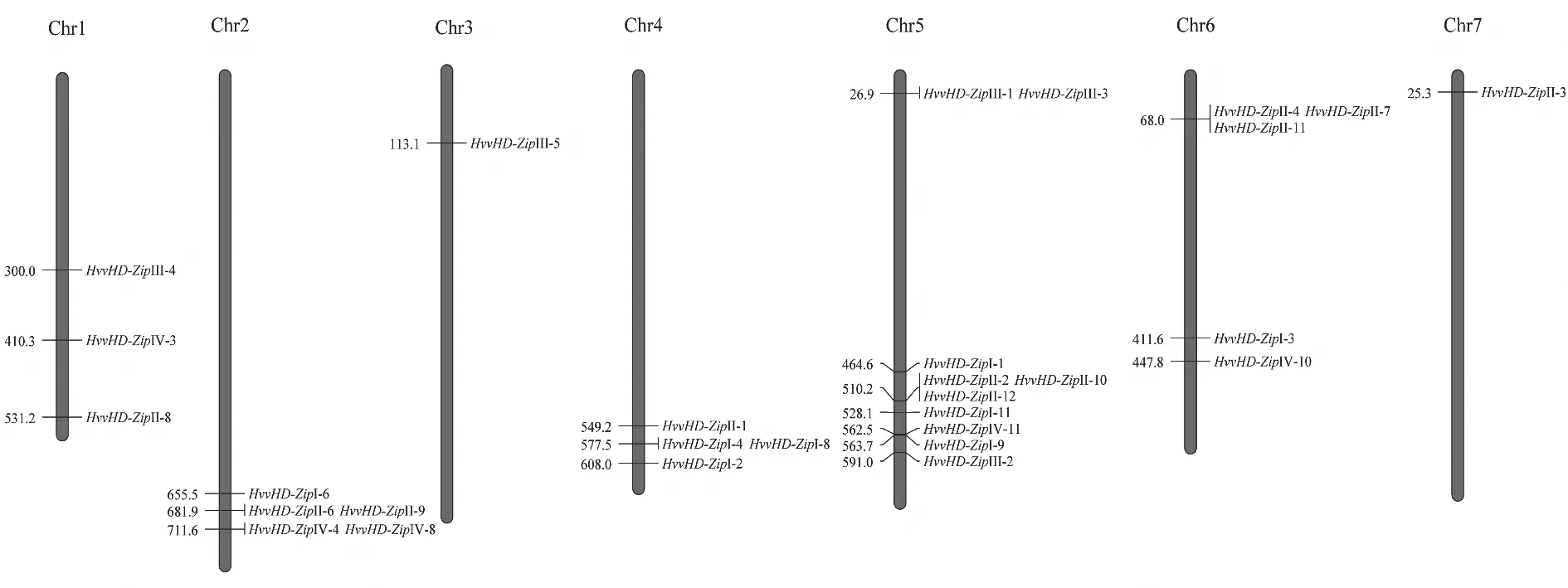
图1 HvvHD-Zip基因染色体定位Fig.1 Chromosome location of HvvHD-Zip genes

表2 HvvHD-Zip基因家族理化性质分析Table 2 Analysis of physicochemical properties of HvvHD-Zip gene family
2.3 HvvHD-Zip蛋白的多序列比对、系统发育、保守基序和基因结构分析
基于青稞41个HvvHD-Zip蛋白多序列比对结果显示(图2),其氨基酸序列在HD和LZ结构域上具有较高的相似性;但各亚家族成员在LZ结构域内部存在较高的差异,尤其5个Ⅲ亚家族成员(HvvHD-Zip Ⅲ-1~Ⅲ-5)在氨基酸序列上与其他家族成员存在较明显的不同。
对选取的41个青稞、32个大麦、48个拟南芥和41个水稻HD-Zip蛋白序列构建系统发育树,结果表明(图3)162个HD-Zip蛋白可分为4亚家族(HD-Zip Ⅰ~Ⅳ);青稞HD-Zip各个亚家族分别含有11、12、5和13个成员,其中Ⅰ、Ⅱ、Ⅳ亚族数目与水稻相似,表明HD-Zip基因这3个亚家族成员在青稞基因组中差异不大,而Ⅲ亚族成员数相比于水稻明显减少,但与拟南芥一致;与大麦相比,Ⅰ、Ⅱ、Ⅳ亚家族成员数目相差较大(大麦Ⅰ、Ⅱ、Ⅳ亚家族成员数目分别为16、4、8个),但Ⅲ亚家族成员数仅差1个(大麦为4个)。

图3 不同植物HD-Zip基因家族的系统进化分析Fig.3 Phylogenetic analysis of the HD-Zip gene family of different plants
蛋白保守基序分析结果显示(图4,A),所有HvvHD-Zip基因均发现了编码HD和LZ结构域的保守基序,其中HD-Zip Ⅰ和HD-Zip Ⅱ亚家族成员包含较少的基序,且分布较为简单,而Ⅲ和Ⅳ亚家族具有多基序复杂结构;进一步分析HvvHD-Zip家族成员基因结构(图4,B)发现,41个成员在外显子-内含子排列上存在较大差异,但仍与4个亚家族的分类相一致。Ⅰ、Ⅱ亚家族中,各成员具有1~4个外显子,基因结构相对简单;Ⅲ、Ⅳ亚家族成员具4~18个外显子数,尤其以Ⅲ亚家族成员含有更多的外显子,基因结构最为复杂。
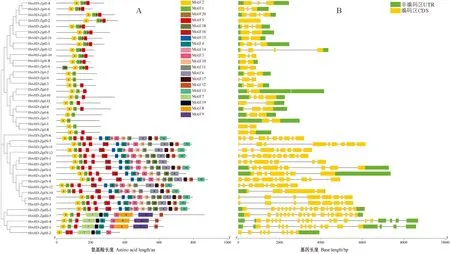
图4 HvvHD-Zip基因的保守基序(A)和基因结构(B)Fig.4 Conserved motif (A) and gene structure (B) of HvvHD-Zip genes
2.4 HvvHD-Zip基因顺式作用元件分析
对HvvHD-Zip家族成员上游2 000 bp的启动子进行顺式作用元件分析,共鉴定到11种与植物激素和胁迫响应有关的启动子顺式作用元件(图5)。其中,与激素类有关的响应元件有脱落酸响应元件(ABRE)、茉莉酸甲酯响应元件(CGTCA-motif、TGACG-motif)、赤霉素响应元件(P-box、TATC-box)、水杨酸响应元件(TCA-element)和生长素反应原件(TGA-element、AuxRR-core)等5种,其中,含有茉莉酸甲酯响应元件的HvvHD-Zip基因占73.17%;与胁迫响应相关元件有6种,分别为无氧诱导响应元件(ARE)、参与防御和应激反应的顺式作用元件(TC-rich repeat)、低温响应诱导元件(LTR)、光响应元件(TCCC-motif、Sp1、GA-motif、G-Box、Box 4)、缺氧特异性诱导元件(GC-motif)和干旱响应诱导元件(MBS),其中,含低温响应和干旱响应元件的HvvHD-Zip基因分别占41.46%和46.34%,含有光响应元件的占100%。这表明HvvHD-Zip基因广泛参与青稞的胁迫响应和激素信号转导。
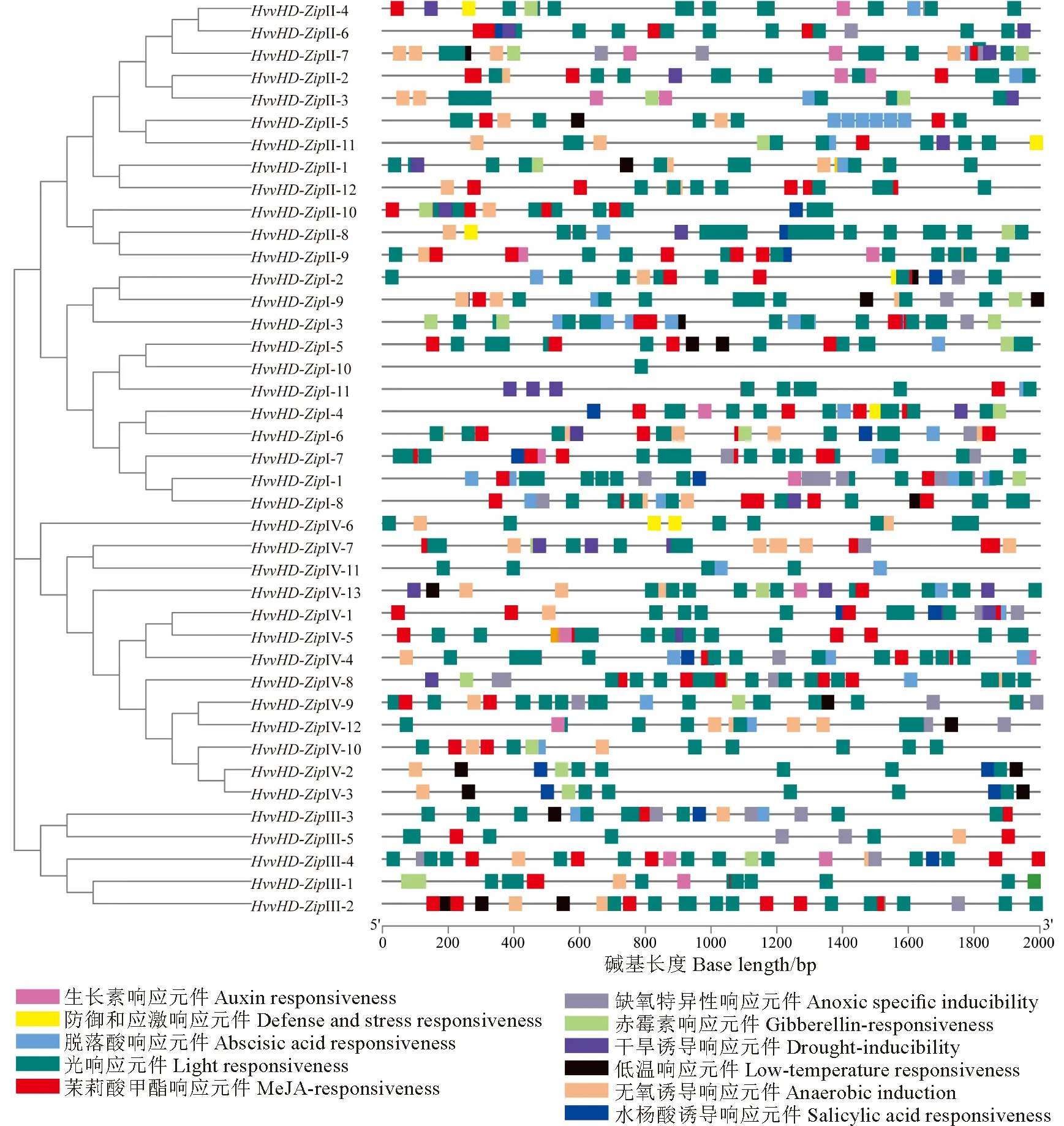
图5 HvvHD-Zip基因顺式作用元件分布Fig.5 cis-acting elements distribution map of HvvHD-Zip genes
2.5 HvvHD-Zip基因的非生物胁迫表达分析
通过对青稞幼苗进行短期冷、旱、盐等非生物胁迫和解除胁迫处理,采集各时间节点幼苗根和叶组织样品,对组织中的22个HvvHD-Zip基因表达进行相对定量分析。结果(图6)得知:冷胁迫下,有4个基因(HvvHD-ZipⅡ-4、HvvHD-ZipⅣ-7、HvvHD-ZipⅣ-8和HvvHD-ZipⅣ-10)在根组织中上调表达,其中HvvHD-ZipⅣ-7基因在胁迫后显著高表达;在叶组织中有5个基因(HvvHD-ZipⅣ-1、HvvHD-ZipⅣ-4、HvvHD-ZipⅣ-7、HvvHD-ZipⅣ-8和HvvHD-ZipⅣ-10)显著高表达。旱胁迫后,在根组织中有10个基因上调表达(HvvHD-ZipⅠ-8、HvvHD-ZipⅡ-1、HvvHD-ZipⅡ-2、HvvHD-ZipⅡ-4、HvvHD-ZipⅡ-5、HvvHD-ZipⅡ-11、HvvHD-ZipⅢ-3、HvvHD-ZipⅢ-4、HvvHD-ZipⅢ-5和HvvHD-ZipⅣ-8),其中HvvHD-ZipⅠ-8、HvvHD-ZipⅡ-1、HvvHD-ZipⅢ-3和HvvHD-ZipⅣ-8等4个基因显著高表达;有13个基因在叶组织中上调表达,其中有12个基因显著高表达。盐胁迫后,根组织中有3个基因显著高表达;HvvHD-ZipⅠ-1、HvvHD-ZipⅠ-8、HvvHD-ZipⅡ-1、HvvHD-ZipⅢ-4、HvvHD-ZipⅣ-7、HvvHD-ZipⅣ-8和HvvHD-ZipⅣ-10等7个基因在叶组织中上调表达,其中HvvHD-ZipⅣ-10基因在胁迫后显著高表达。
冷胁迫后,在根或叶组织中,上调表达基因多为Ⅱ、Ⅳ亚家族成员(HvvHD-ZipⅡ-4、HvvHD-ZipⅣ-7、HvvHD-ZipⅣ-8和HvvHD-ZipⅣ-10),Ⅰ亚家族成员下调表达(如HvvHD-ZipⅠ-8)或无表达;旱胁迫后,4个亚家族中的多数基因上调或下调表达;盐胁迫后,除基本无表达基因外,上调或下调表达基因多为Ⅰ、Ⅱ、Ⅳ亚家族基因。
冷胁迫解除后,根组织中各基因表达情况与冷胁迫时大致相似,表达上调基因有4个;叶组织中上调和下调表达基因各有7和3个,其余基因基本无表达。旱胁迫解除后,根组织中表达上调基因有11个,其余基因下调表达或基本无表达;在叶组织中有8个表达上调基因。解除盐胁迫后,根组织和叶组织中表达上调较少,都为3个。
总的来说,胁迫处理后,不同亚家族成员响应胁迫的水平不一致,尤其是Ⅰ、Ⅱ、Ⅳ亚家族成员对胁迫响应较明显;在胁迫或者胁迫解除条件下,HvvHD-Zip家族基因在叶组织中响应明显(上调或下调);且在3种非生物胁迫下,HvvHD-Zip各基因对旱胁迫下响应较强。有趣的是,在旱胁迫下,Ⅲ亚家族基因3个基因在根中响应胁迫,表达量都有所上调。
3 讨 论
植物在生长发育过程中受多种转录因子的调控,同源异型域-亮氨酸拉链(HD-Zip)转录因子影响植物发育各个阶段的生物学功能[25];本研究共鉴定到41个青稞HD-Zip基因,与拟南芥(48个)、水稻(48个)在数目上有差距,但相差不大;但值得探讨的是,已发表的大麦HD-Zip基因家族成员有32个[20],与青稞稍有出入;且在青稞HD-Zip各亚家族中,Ⅲ亚家族成员数最少仅有5个,这与早先报道一致,即HD-Zip Ⅲ亚家族是各个物种中最为保守的亚家族,成员数少,且结构复杂[18,26]。系统进化分析发现单双子叶植物在进化关系中仍存在一定差异:单子叶植物青稞和水稻很多旁系同源基因基本上是对应的,但与双子叶植物拟南芥在一定程度上有分歧,该结果与大麦HD-Zip基因家族分析基本一致[20],此结果也验证了单双子叶植物在进化进程中的区别。
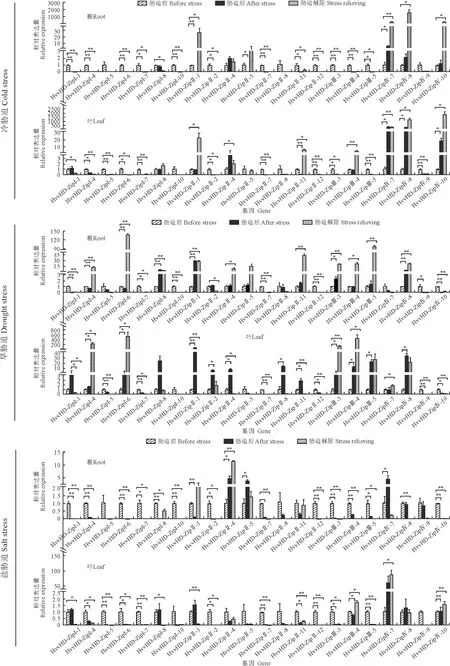
*和**分别代表不同处理间在0.05(P<0.05)和0.01水平(P<0.01)差异显著图6 HvvHD-Zip基因在不同非生物胁迫下的相对表达特征* and ** represent significant differences between different treatments at (P <0.05) and 0.01 (P <0.01) level,respectivelyFig.6 Relative expression characteristics of HvvHD-Zip genes under different abiotic stresses
对青稞HD-Zip家族基因进行顺式作用元件分析,发现个别特定类型的顺式作用元件只存在于某些亚家族中,例如,TGA-element、AuxRR-core(生长素反应元件)只存在于青稞HD-Zip Ⅰ、Ⅲ和Ⅳ亚家族基因中,这不仅与龙眼中发现的某些顺式元件只存在于个别家族成员启动子内情况相似[27],还与玉米中顺式作用元件AuxRR-core(生长素反应元件)仅分布在某些Ⅲ和Ⅳ类HD-Zip基因的启动子中表现一致[28];这一结果表明青稞HD-Zip各个亚家族成员可能在其生理生化调控过程发挥了不同的作用。结合HvvHD-Zip家族基因进行顺式作用元件与非生物胁迫表达特性分析,发现许多基因启动子中存在许多与胁迫反应、激素反应相关的顺式作用元件,且多数基因均响应冷、旱和盐等非生物胁迫。研究表明,植物胁迫响应机制的一个关键和重要组成部分是植物基因通过植物转录因子的作用对环境胁迫作出反应的转录调控[29],由于结构上的相似性,HD-Zip转录因子同一亚家族成员往往表现出功能保守性,他们通过与某些顺式元件结合来调节基因对激素信号或生物和非生物胁迫的表达[30]。据报道,许多HD-Zip Ⅰ亚家族基因参与调控对干旱、盐碱和寒冷胁迫等非生物胁迫条件的发育适应[7,31],比如拟南芥HD-Zip Ⅰ亚家族的ATHB7基因是由干旱或脱落酸诱导[32],向日葵中的HAHB4基因由茉莉酸甲酯诱导[33],富含各种胁迫响应顺式调控元件的水稻HD-Zip Ⅰ亚家族基因的干旱响应启动子,有利于特定胁迫响应基因的过度表达[34];过表达苹果类MdHB7基因提高了转基因植株的抗盐胁迫能力[35];对水稻进行干旱处理发现,HD-Zip Ⅰ亚家族Oshox4基因表达受到干旱抑制,而Oshox22表达则被诱导[36];在PEG(旱)、热、冷、NaCl(盐)胁迫下黄瓜HD-Zip Ⅰ亚家族的CsHD-Zip基因被显著诱导[37]。本研究中,在青稞HD-Zip Ⅰ、Ⅱ亚家族中发现了较多的脱落酸响应元件(ABRE)和参与防御和应激反应的顺式作用元件(TC-rich repeat),同时在短期冷、旱、盐胁迫处理后,HvvHD-Zip Ⅰ、Ⅱ、Ⅳ亚家族基因对旱胁迫响应较强,这与Li等[17]所阐述的在小麦(TriticumaestivumL.)中Ⅰ亚家族和Ⅱ亚家族基因由干旱胁迫诱导所得结论一致,表明HD-Zip Ⅰ、Ⅱ亚家族成员在青稞非生物胁迫反应中具有潜在重要性。此外,关于HD-Zip Ⅳ转录因子的现有研究表明,它们参与了植物器官外层细胞层的发育和维持调控,这可能在植物抵御病原体和保护非生物胁迫中发挥重要作用[38];在刺梨中,光响应元件是影响Ⅳ亚家族基因参与植物生理生化活动最重要的因素[39],超量表达拟南芥HD-Zip Ⅳ亚家族HDG11基因有助于提高植株(水稻、甘薯和烟草等)抗旱性[40]。在本研究中,HvvHD-Zip Ⅳ亚家族基因不仅含有较多的光响应元件,对冷、旱和盐等非生物胁迫均有响应,与番茄中13个HD-ZipⅣ基因对多种植物激素和非生物胁迫处理都有响应的结果[41]基本一致。
此外,还有较为重要的一点是,据报道不同的启动子顺式元件及其表观遗传变化会影响基因调控[42],从而导致不同的基因表达水平,并进一步影响对环境的适应[43],如Duo等[44]比较发现大麦和青稞的LTP基因序列基本相同,但启动子和逆境表达模式不同,两者LTP基因上游顺式元件的不同改变了其调控模式,从而引起了不同的非生物胁迫反应,导致青稞适应极端高原气候;本研究中青稞HD-Zip基因家族成员中含干旱和低温启动子-顺式元件占总成员数接近一半,猜想这为青稞更好地适应高原不良环境创造了条件。
综上所述,本研究对青稞HD-Zip基因进行了比较全面的基因组分析,明确了不同非生物胁迫下HvvHD-Zip基因在不同组织中的表达特性,为后续研究青稞HD-Zip基因的非生物胁迫功能提供基础资料,也为进一步青稞优良抗性品种选育提供理论指导。
