固定化培养中氮磷浓度对钝顶螺旋藻生长及其代谢产物和叶绿素荧光参数的影响
2023-02-21刘海燕李武阳王丽娟罗光宏
崔 岩,刘海燕,李武阳,2,王丽娟,罗光宏*
(1 河西学院,甘肃省微藻技术创新中心,甘肃省河西走廊特色资源利用重点实验室,甘肃张掖 734000;2 兰州交通大学 生物与制药工程学院,兰州 730070)
螺旋藻作为国内外研究与开发规模最大的经济微藻,生长速度快且可以在碱性环境中高效利用CO2或碳酸盐。螺旋藻还含有丰富的β-胡萝卜素、叶绿素、蛋白质和多糖等活性物质,是集营养和药用于一身的最佳天然绿色保健食品,被联合国粮农组织(FAO)誉为“21世纪人类最理想的天然保健食品”[1-2]。中国螺旋藻产业发展迅速,自20世纪80年代初开展螺旋藻养殖技术研究,90年代初期进入产业化推广阶段,至90年代中期,中国螺旋藻养殖面积达到200万m2,年产能达2 000 t。目前,中国螺旋藻生物质年生产能力约1万t[3-4],主要采用传统的液体悬浮式培养,包括开放式跑道池和密闭光生物反应器[5]。开放式跑道池的建造和运行成本较低,但细胞生长速度与培养密度均较低,且占地面积大,系统还存在着易受污染、培养条件不稳定等难以克服的弱点。密闭光生物反应器可以有效控制培养条件,显著提高藻细胞生长速度与培养密度,但造价昂贵、运行成本高、难以放大用于规模培养[6]。近年来,固定化生物膜的培养方式获得了越来越多的关注。区别于悬浮式培养,该培养方式通过将细胞固定在材料表面并形成连续生长的生物膜,可以极大地降低耗水量和采收能耗。同时,研究表明生物膜中细胞对光和CO2的利用率远高于悬浮式培养[7]。因此,研究影响固定化生物膜培养方式的因素,开发低成本、可规模化的培养系统,已成为微藻养殖领域的一个重要方向[8]。
氮、磷是调节细胞生长和代谢的必需营养因子,在细胞生命过程中起着不可或缺的作用。研究表明,氮、磷等营养元素对微藻生物膜的形成和生长至关重要[9]。目前,关于螺旋藻生物膜的研究主要集中在固定材料的筛选和反应器的构建方面[7-10],有关氮、磷对螺旋藻生物膜的影响研究还未见报道,因此,本研究开展了不同氮、磷浓度下固定化钝顶螺旋藻(Spirulinaplatensis)生物膜的培养实验,分析氮和磷浓度对藻细胞生长、代谢产物以及叶绿素荧光参数的影响规律,从而为制定低耗、高效的规模化培养策略,调控代谢产物和提高螺旋藻利用效率提供理论依据。
1 材料和方法
1.1 藻种培养及处理
钝顶螺旋藻 (Spirulinaplatensis)由甘肃省微藻技术创新中心提供。采用Zarrouk培养基[11]进行培养,1 L溶液中含NaHCO316.8 g,NaCl 1.0 g,K2SO41.0 g,NaNO32.5 g,K2HPO40.5 g,MgSO4·7H2O 0.2 g,CaCl20.08 g,FeSO4·7H2O 0.01 g,Na2EDTA 0.08 g,A5微量元素1 mL。其中,A5微量元素配方如下:H3BO32.86 g·L-1,MnCl2·4H2O 1.8 g·L-1,ZnSO4·7H2O 0.22 g·L-1,(NH4)6Mo7O24·2H2O 0.02 g·L-1,CuSO4·5H2O 0.08 g·L-1,CoCl2·6H2O 0.04 g·L-1。
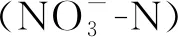
采用单层倾斜平板系统,支撑板表面是有利于螺旋藻吸附固定的材料,将待培养的藻种接种至固定材料无纺布表面,初始接种密度为7~9 g·m-2。培养液通过喷洒系统分布于材料表面并保持湿润,藻细胞在吸附层生长并形成一定厚度的生物膜,收获时用刮板将细胞从吸附层上刮下即可。培养光照强度为100 μmol·m-2·s-1,培养温度为25 ℃。
1.2 观测指标及方法
1.2.1 螺旋藻生长参数测定细胞密度时,将吸附膜上的藻细胞(接种面积为S,m2)用水冲洗下来,通过抽滤装置过滤到预先称重的滤膜(W1,g)上,烘箱105 ℃ 烘干至恒重(W2,g),最后依据公式(1)和(2)分别计算吸附膜上的生物量密度(Wt,g·m-2)和相应的生物量产率(P,g·m-2·d-1)。
Wt=(W2-W1)/S
(1)
P=(Wt-W0)/t
(2)
其中,W0为接种时的细胞浓度(g·m-2),t为培养时间(d)。
1.2.2 螺旋藻叶绿素和类胡萝卜素含量取冷冻干燥后的藻粉20 mg,加入20 mL 80%丙酮溶液,低温超声20 min,于4 ℃放置24 h,离心后测定上清液在波长663、646和470 nm 处的吸光值OD663、OD646和OD470。按式(3)和(4)计算叶绿素a (Chla)和类胡萝卜素(Cart.)含量[11]:
Chla(mg·L-1)=12.21OD663-2.81OD646
(3)
Cart.(mg·L-1)=(1000OD470-1.63Chla)/221
(4)
1.2.3 螺旋藻藻胆素含量取冷冻干燥后的藻粉20 mg,加入50 mL 磷酸盐缓冲液(0.1 mol/L,pH 7.0),混匀后低温超声20 min,于-80 ℃冻融循环3次,离心后测定上清液在562、620和652 nm处的吸光度OD562、OD620、OD652。藻蓝素(PC)、别藻蓝素(APC)和藻红素(PE)的含量计算如下[15]:
PC(g·L-1)=0.187OD620- 0.089OD652
(5)
APC(g·L-1)=0.196A652-0.041A620
(6)
PE(g·L-1)=0.104A562-0.251PC-0.088APC
(7)
1.2.4 螺旋藻可溶性蛋白及多糖含量将待测细胞用一定量的水冲洗并离心,上清液用于测定胞外多糖含量,藻渣冷冻干燥后称取总重。取20 mg藻粉,加入5 mL PBS 缓冲液(0.1 mol/L,pH 7.8),混匀后低温超声20 min,并于-80 ℃反复冻融3次,离心后上清液用于测定胞内多糖和可溶性蛋白含量[16]。
可溶性糖含量的测定采用硫酸蒽酮法[17]。称取0.1蒽酮,溶于100 mL 80%浓硫酸中。取2 mL上清液,置于15 mL比色管中,随后加入5 mL配制的硫酸蒽酮溶液,充分振荡后立即放入沸水浴中,保温15 min,取出后用自来水冷却,在620 nm波长下测定其吸光度OD620,根据标准曲线计算样品中的可溶性多糖含量。
可溶性蛋白含量的测定采用考马斯亮蓝法[11]。取上清液1 mL,置于10 mL比色管中,加入5 mL考马斯亮蓝G-250蛋白试剂,混合放置5 min后,在595 nm下比色,记录吸光度OD595,并通过标准曲线计算样品中的蛋白质含量。
1.2.5 细胞形态观察采用光学显微镜(BX51,Olympus)观察螺旋藻的细胞形态。采用S-3700N(Hitachi) 扫描电子显微镜对真空冷冻干燥并镀金处理后的藻膜样品进行观察,拍摄其表面结构。
1.2.6 叶绿素荧光参数通过叶绿素荧光仪(PAM-100,Waltz)每天定时测定各浓度氮、磷营养条件下的螺旋藻叶绿素荧光诱导动力学曲线和快速光响应曲线,测定前将样品置于暗处适应15 min。测定叶绿素荧光诱导动力学曲线时,先用弱光(小于1 μmol·m-2·s-1)照射样品测定初始荧光(Fo),然后打开饱和脉冲光 (2 800 μmol·m-2·s-1),一个脉冲后关闭,得到黑暗中的最大荧光(Fm),随后开启光化光(85 μmol·m-2·s-1),让样品进行正常的光合作用,当荧光基本稳定时测定稳态荧光(Fs),之后再进行饱和脉冲光处理,一个脉冲关闭后,得到光下的最大荧光(Fm′)。充分暗适应PSⅡ的最大光转化效率(Fv/Fm)、实际光能转化效率(ΦPSⅡ)、光化学淬灭系数(qP)等参数值均是在选定模式下系统自动计算生成。测定快速光响应曲线时,将样品暴露在连续光强梯度(PAR分别为 13、22、35、85、156、210、364、576、901和1 393 μmol·m-2·s-1)下,测定光合电子传递速率ETR[18-19]。
1.3 数据处理
每组实验均设3个重复,利用SPSS 22.0进行数据方差分析(ANOVA)和 Duncan检验;检验水平α=0.05,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 不同氮、磷浓度对螺旋藻生长的影响
各氮、磷浓度条件下螺旋藻生物量均随培养时间的增加而增加(图1)。其中,螺旋藻生物量密度在30 mmol·L-1氮浓度处理时达到最大值,并且在培养周期内(1~10 d)显著高于其余氮浓度处理(P<0.05),而在15 和45 mmol·L-1氮浓度处理中培养8 d之后显著高于5 mmol·L-1氮浓度处理(P<0.05),表明氮浓度过低会降低螺旋藻的产量。同时,在培养周期内,螺旋藻生物量密度在3.0 和4.5 mmol·L-1磷浓度处理时显著高于0.5 和1.5 mmol·L-1磷浓度处理(P<0.05),但前两者间在培养7 d之后并无显著性差异,总体上螺旋藻生物量密度随着磷浓度增加先升高后趋于平稳。
另外,培养10 d后收获藻体,并计算相应的生物量产率(表1)。结果表明,随着培养基中氮浓度的增加,螺旋藻的生物量产率呈先增加后降低的变化趋势,并在氮浓度为30 mmol·L-1时达到最大(8.31 g·m-2·d-1);当氮浓度继续增加时(45 mmol·L-1),螺旋藻的生物量产率显著降低。与此同时,随着培养基中磷浓度的增加,螺旋藻藻生物量产率的变化趋势与氮浓度处理的表现一致,即先升高后降低,当磷浓度为3.0 mmol·L-1达到最大(8.06 g·m-2·d-1);但当磷浓度继续增加时(4.5 mmol·L-1),生物量产率稍有降低并保持在较高水平。

表1 不同氮、磷浓度培养基中螺旋藻的生物量产率Table 1 The biomass productivity of S. platensis under different nitrogen and phosphorus concentrations

同期不同小写字母表示处理间在0.05水平存在显著性差异图1 不同氮、磷浓度培养基中螺旋藻生物量密度的变化The different normal letters within same time point indicate significant difference among treatments at 0.05 levelFig.1 The biomass density of S. platensis under different nitrogen and phosphorus concentrations
2.2 不同氮、磷浓度对螺旋藻细胞形态的影响
在不同氮、磷浓度条件下培养10 d后,将氮浓度为5 mmol·L-1和30 mmol·L-1、磷浓度为0.5 mmol·L-1和3.0 mmol·L-1的处理在光学显微镜(BX51,Olympus)和扫描电子显微镜(日立S-3700N)下进行观察。结果(图2)显示:在光学显微镜下,30 mmol·L-1氮浓度处理和3 mmol·L-1磷浓度处理的螺旋藻藻丝都较长,具有10个或更多螺旋(图2,A、C);而5 mmol·L-1氮浓度和0.5 mmol·L-1磷浓度的处理中,螺旋藻的藻丝较短,螺旋变少(图2,B、D)。在扫描电子显微镜下,相较于氮浓度为30 mmol·L-1和磷浓度为3.0 mmol·L-1的处理(图2,E、G),氮浓度为5 mmol·L-1和磷浓度为0.5 mmol·L-1的处理(图2,F、H)藻丝体螺旋度减小,部分藻丝体变成直线形,而长的藻丝和高的螺旋度有助于螺旋藻形成更为稳定的生物膜,进而增加单位面积的产量。
2.3 不同氮、磷浓度对螺旋藻光合色素含量的影响
螺旋藻光合色素含量在氮浓度处理间或者磷浓度处理间均存在显著性差异,并随着培养基中氮、磷浓度的增加均呈现先升后降的变化趋势,且均在30 mmol·L-1氮浓度或者3.0 mmol·L-1磷浓度条件下达到最大值(图3)。
首先,螺旋藻叶绿素a含量在30 mmol·L-1氮浓度处理时达到最大值(14.89 mg·g-1)并显著高于其余氮浓度处理,而15 和45 mmol·L-1氮浓度处理又显著高于5 mmol·L-1氮浓度处理(P<0.05),总体上与螺旋藻生物量的变化趋势一致。同时,螺旋藻类胡萝素和藻胆素(藻蓝素、异藻蓝素和藻红素)均在30 和45 mmol·L-1氮浓度处理时显著高于5和15 mmol·L-1氮浓度处理(P<0.05),但前两者间和后两者间均无显著性差异,总体上随着氮、磷浓度增加先缓慢升高后趋于平稳。

A~D为光学显微镜观察,E~H为扫描电子显微镜观察:A、E.30 mmol·L-1氮浓度处理;B、F.5 mmol·L-1氮浓度处理;C、G.3.0 mmol·L-1磷浓度处理;D、H.0.5 mmol·L-1磷浓度处理图2 不同氮、磷浓度培养条件下螺旋藻细胞的形态变化A-D are optical microscope observation,while E-H are scanning electron microscope observation:A,E.30 mmol·L-1 nitrogen treatment;B,F.5 mmol·L-1 nitrogen treatment;C,G.3.0 mmol·L-1 phosphorus treatment;D,H.0.5 mmol·L-1 phosphorus treatment Fig.2 Morphological changes of S. platensis cells under different nitrogen and phosphorus concentrations
其次,螺旋藻叶绿素a含量在3.0 mmol·L-1磷浓度处理时达到最大值14.37 mg·g-1,并显著高于其余磷浓度处理,1.5 和4.5 mmol·L-1磷浓度处理又显著高于0.5 mmol·L-1磷浓度处理(P<0.05),总体上与螺旋藻生物量的变化趋势一致。而螺旋藻类胡萝素含量在3.0 和4.5 mmol·L-1磷浓度处理时显著高于0.5 和1.5 mmol·L-1磷浓度处理(P<0.05),但前两者间和后两者间并无显著性差异,总体上随着磷浓度增加先升高后趋于平稳。同时,螺旋藻藻蓝素、异藻蓝素和藻红素含量在各磷浓度处理间均存在显著性差异(P<0.05),并均在磷浓度为3.0 mmol·L-1时达到最高值,分别为15.93%、8.87%和1.40%,在4.5 mmol·L-1磷浓度处理时次之,而在1.5 mmol·L-1磷浓度处理时最低。
2.4 不同氮、磷浓度对螺旋藻叶绿素荧光参数的影响
首先,最大光能转换效率(Fv/Fm)反映了PSⅡ反应中心处于开放时的最大量子产率,即能量捕获效率。在培养基中氮浓度一定时,不同磷浓度处理螺旋藻的Fv/Fm随着培养时间均呈先上升后下降的趋势(图4)。其中,4.5 mmol·L-1磷浓度处理螺旋藻的Fv/Fm在培养的第1天就达到峰值,而3.0 和1.5 mmol·L-1磷浓度处理则在培养第2天达到峰值,0.5 mmol·L-1磷浓度处理则一直处于波动下降之中;在培养结束时,各浓度磷处理螺旋藻的Fv/Fm表现为3.0 mmol·L-1>4.5 mmol·L-1>1.5 mmol·L-1>0.5 mmol·L-1,这与螺旋藻叶绿素含量的变化趋势一致。在基质中磷浓度一定时,各氮浓度处理螺旋藻的Fv/Fm随着培养时间均呈波动下降趋势(图4)。其中,在培养的第1天,5 mmol·L-1氮浓度处理螺旋藻的Fv/Fm的下降幅度最大,而30 mmol·L-1氮浓度处理的下降幅度最小;在培养结束时,螺旋藻的Fv/Fm值以45 mmol·L-1氮浓度处理最大,5 mmol·L-1氮浓度处理最小。

相同色素内不同小写字母表示处理间在0.05水平存在显著性差异图3 不同氮、磷浓度培养条件下螺旋藻光合色素含量的变化The different normal letters within same pigment indicate significant difference among treatments at 0.05 levelFig.3 The photosynthetic pigment contents of S. platensis under different nitrogen and phosphorus concentrations

图4 不同氮、磷浓度处理下螺旋藻最大光能转换效率(Fv/Fm)的变化Fig.4 The Fv/Fm of S. platensis under different nitrogen and phosphorus concentrations
其次,随着光合有效辐射(PAR)强度的增加,各氮、磷浓度处理组螺旋藻PSⅡ光合电子传递效率[ETR(Ⅱ)]光响应曲线均呈现先上升后降低的变化趋势,说明螺旋藻PSⅡ的光化学速率在低光照条件下得到提高,而在高光照条件下会受到抑制。螺旋藻ETR(Ⅱ)在培养基中磷浓度固定时表现为45 mmol·L-1>30 mmol·L-1>15 mmol·L-1>5 mmol·L-1,在培养基中氮浓度固定时表现为3.0 mmol·L-1>4.5 mmol·L-1>1.5 mmol·L-1>0.5 mmol·L-1(图5)。在培养基中磷元素充足的情况下,螺旋藻ETR明显受氮浓度影响,且氮浓度越低,ETR值越低,下降越快;在培养基中氮浓度一定时,螺旋藻ETR始终以3.0 mmol·L-1磷浓度处理最高,这与螺旋藻Fv/Fm和叶绿素a含量的变化规律一致。

图5 不同氮、磷浓度处理下螺旋藻电子传递速率ETR的变化Fig.5 The ETR of S. platensis under different nitrogen and phosphorus concentrations
另外,实际光能转化效率(ΦPSⅡ)反映PSⅡ反应中心部分关闭时所吸收的量子产额;光化学淬灭系数(qP)也是捕获的光子能量用于光化学反应的能力指标,表示PSⅡ开放的反应中心所占比例;初始荧光(Fo)来自天线色素,是已经暗适应的光合机构全部PSⅡ都开放时的荧光强度。图6显示,螺旋藻Fo、ΦPSⅡ、qP在各浓度氮、磷处理间差异不显著,说明本研究设置的氮、磷盐浓度处理在整体上对这几个荧光参数影响较小。
2.5 不同氮、磷浓度对螺旋藻代谢产物的影响
图7显示,螺旋藻可溶性蛋白含量随着培养基中氮浓度的增加而逐渐显著增加,且在各个氮浓度处理间均存在显著差异(P<0.05);而可溶性蛋白含量又随着培养基中磷浓度的增加而先升高后降低,并在3.0 mmol·L-1磷浓度时达到最高值,且显著高于其余处理,但在4.5 mmol·L-1磷浓度处理与0.5 和1.5 mmol·L-1磷浓度处理间无显著性差异(P>0.05)。同时,螺旋藻可溶性蛋白产率均随着培养基中氮、磷浓度的增加而先升后降,且分别在30 mmol·L-1氮和3.0 mmol·L-1磷时达到最高值,分别为3.54和3.33 g·m-2·d-1。可见,培养基中氮、磷浓度偏高或者偏低均会降低螺旋藻可溶性蛋白产率。
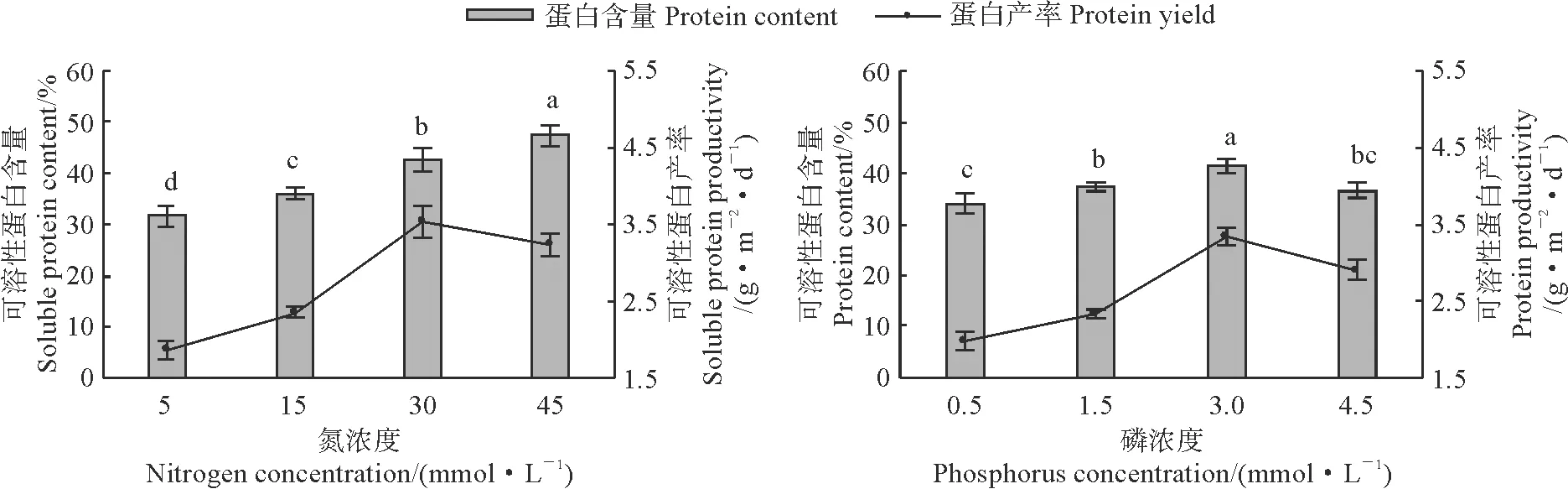
图7 不同氮、磷浓度处理下螺旋藻可溶性蛋白含量及产率的变化Fig.7 The soluble protein content and productivity of S. platensis under different nitrogen and phosphorus concentrations
同时,培养基中氮浓度也对螺旋藻多糖积累有显著影响(图8)。各氮浓度处理的多糖含量存在显著差异(P<0.05),并在氮浓度为15 mmol·L-1时螺旋藻胞外和胞内多糖含量均达到最大值,分别为89.42和116.26 mg·g-1,比30 mmol·L-1氮浓度处理分别显著增加118.79% 和40.44%。同时,随着培养基中磷浓度的增加,螺旋藻胞外多糖含量显著降低,在0.5 mmol·L-1磷浓度处理时达到最高值(99.87±6.18) mg·g-1,但胞内多糖含量并没有随磷浓度发生明显增加。另外,不同氮、磷浓度处理下多糖产率与多糖含量的变化趋势一致,即在15 mmol·L-1氮和0.5 mmol·L-1磷时获得最高值,分别为1.34和1.03 g·m-2·d-1。螺旋藻在氮、磷等营养限制条件下虽不利于藻生物量的增加,但是却会刺激藻积累大量糖类。

图8 不同氮、磷浓度处理下螺旋藻可溶性糖含量及产率的变化Fig.8 The polysaccharide content and productivity of S. platensis under different nitrogen and phosphorus concentrations
3 讨 论
在微藻培养的营养盐中,氮源是研究较多的营养因素之一,它是合成藻体内蛋白质、核酸和叶绿素的基本元素。磷虽然需要的不多,但它是细胞核酸、蛋白质和磷脂的主要成分,也是调节微藻细胞生长和代谢的必需营养因子之一[6]。本研究结果表明,当培养基中氮、磷营养充足时,螺旋藻细胞合成较多的蛋白质,促进细胞的分裂和生长,单细胞藻丝较长;当基质中氮、磷营养缺乏时,会影响藻细胞叶绿素合成和光合作用的进行,单细胞藻丝变短,螺旋变少;随着培养基质中氮、磷含量降低,螺旋藻生长速率下降,细胞多糖含量增加。营养盐的匮乏致使藻细胞处于饥饿状态,蛋白质合成受阻,碳水化合物多数转化为多糖,从而引起细胞多糖含量升高[20],并且磷源限制程度越严重,螺旋藻蛋白质含量越低,多糖含量越高。郑怡等[13]发现氮源浓度(试验范围为1.0~2.5 g·L-1)对极大螺旋藻多糖的含量有显著影响,且随着培养液中氮源浓度的降低螺旋藻胞外多糖含量增加,当NaNO3浓度降至1.0 g·L-1时,胞外多糖含量达到最高。陈浩等[12]研究了磷浓度对钝顶螺旋藻生长代谢的影响,实验发现螺旋藻总糖含量随着磷源浓度的增加显著下降,并在磷源浓度为0.005 g·L-1时达到最高。本研究结果与以上研究结果一致,在培养基中氮浓度为15 mmol·L-1(相当于NaNO3浓度为1.275 g·L-1)时,钝顶螺旋藻胞外和胞内多糖的含量均达到最大值;同时,螺旋藻胞外多糖含量随着基质中磷浓度的增加而降低,在0.5 mmol·L-1磷浓度处理中胞外多糖含量达到最高。目前关于螺旋藻代谢产物如多糖和藻蓝蛋白的研究大多侧重于其分离纯化及结构与功能方面,而有关培养条件对代谢产物的影响则很少涉及。因此,通过对螺旋藻代谢产物的高产条件及机理研究建立高产的生产模式,具有重要的实际应用价值。

螺旋藻的光合色素包括叶绿素a、类胡萝卜素和藻胆素三大类,光合作用是在他们的共同作用下完成的。光能吸收传输路线是光照→藻红素(PE)→藻蓝素(PC)→别藻蓝素(APC)→叶绿素a。前三者传递光能,而叶绿素a作为光合作用反应中心将光能转化为电能[15,32]。本研究结果表明,在氮源缺乏的条件下,钝顶螺旋藻合成的光合色素减少,且降解的细胞内氮主要用于合成核酸、蛋白质、脂质和碳水化合物等细胞主要组成物质。Pancha等的转录组学和蛋白组学分析也发现了类似的结果,即在氮限制条件下微藻细胞中并没有新的光合色素合成[33]。氮素的缺乏影响光合色素的合成,进而削弱微藻的光合作用。另外,本研究进一步发现,钝顶螺旋藻生物膜对氮浓度的耐受程度更强,在高氮浓度(45 mmol·L-1)培养下,其荧光参数Fv/Fm、ETR、ΦPSⅡ都处在较高水平,同时生物质产量和产率也较高。
已有研究表明开放池和密闭式光生物反应器两种培养模式单位面积需水量分别为300和100 L·m-2[34],而固定化生物膜培养模式可将用水量控制在60 L·m-2[35-36]。开放池系统的培养液深度通常在15~30 cm之间,以水平跑道式环形池居多,采用叶轮转动的方式使培养液在池内混合循环,从而防止藻体沉底并提高藻体的光能利用率,流动所产生的剪切强度难以精准测量和控制。此外,由于培养液层浅,CO2作为碳源的利用率不会超过20%,直接导致开放池培养成本升高[6]。目前采用开放池进行户外大规模培养的藻种只有螺旋藻(Spirulina)、小球藻(Chlorella)、杜氏盐藻(Dunaliellasalina)和雨生红球藻(Haematococcuspluvialis)等少数几种,但都存在着生物量低(0.5~1.0 g·L-1左右),采收成本较高的问题[5-6]。光封闭反应器可以有效控制培养条件,控制污染,实现纯种培养,且CO2及营养盐损失小,但缺点在于设备投资成本高,难于放大用于规模培养。特别是有些微藻嗜好附着于反应器内表面生长,不仅阻碍了光能的渗透,还给生物量的采收和反应器的清洗造成困难。本研究表明固定化生物膜培养模式中,在不降低生物量、减少系统用水量的前提下,可以快速地实现生物量的积累,而且采收便捷,同时可根据目标产物的要求制定相应的氮、磷营养元素调控机制,为设计和建造更高效的、适合规模化生产螺旋藻的系统提供了理论基础依据。
4 结 论
氮、磷水平对固定化钝顶螺旋藻生物膜的生长及代谢产物有重要影响。生物膜上附着的细胞干重随着氮、磷浓度的增加而增大,并在氮浓度30 mmol·L-1或磷浓度3 mmol·L-1的条件下达到最高值。随着氮、磷浓度的降低,螺旋藻多糖含量增加,蛋白质含量下降,且磷源限制程度越严重,螺旋藻蛋白质含量越低,多糖含量越高。因此在生产应用中可通过调控氮、磷浓度来促进相应目标产物的合成积累。
随着基质中氮、磷浓度的降低,螺旋藻中的叶绿素a、类胡萝卜素和藻胆素的等光合色素含量减少。光合色素的减少削弱了螺旋藻生物膜的光合作用效率,叶绿素荧光参数(Fv/Fm)和 电子传递速率(ETR)降低。与磷浓度相比,螺旋藻生物膜对氮浓度的耐受程度更强,在高氮浓度(45 mmol·L-1)培养下,螺旋藻叶绿素荧光参数都处在较高水平,同时生物质产量也较高。利用叶绿素荧光技术可对螺旋藻生物膜的光合生理状况和营养条件进行快速的测定和诊断。
