比利时杜鹃花RhDFR基因克隆及分析
2023-02-21蒋宝鑫汪庆昊杨国霞贾永红谢晓鸿吴月燕
蒋宝鑫,汪庆昊,杨国霞,贾永红,谢晓鸿,吴月燕*
(1 浙江万里学院 生物与环境学院,浙江宁波 315100;2 浙江万里学院 设计与建筑学院,浙江宁波 315100)
大多数杜鹃花(Rhododendron)属于观赏性花卉,具有重要的生态影响、观赏和药用价值,广泛分布于亚洲、北美和西欧。杜鹃花是中国特有的观赏性花卉品种之一,其花色艳丽,以满足花卉市场的需要[1-3],因此,培育不同花色的杜鹃花品种是目前研究的热点。影响杜鹃花花色的主要是花青素和黄烷醇,花青素是花卉颜色的重要色素,决定了园艺植物的观赏价值和经济价值[4]。尤其是花青素成分(即矢车菊素、飞燕草素、锦葵素、天竺葵素、牡丹素和矮牵牛素等)的组成,它们的数量决定了花瓣从浅色到深色的花色变化[5]。因此,了解花青素合成途径中相关基因的合成以及花青素合成途径中关键基因对花卉品质的作用具有重要意义。
二氢黄酮醇-4-还原酶(dihydroflavonol 4-reductase,DFR)作为花青素生物合成中的关键酶,在花青素合成过程中起着至关重要的作用[6]。该酶通过还原3种无色、相应的二氢黄酮醇(二氢山奈酚DHK、二氢槲皮素DHQ和二氢杨梅素DHM)催化黄烷-3,4-二醇(亮花青素)的产生,这也是黄酮醇合成反应的中间体[7]。DFR以NADPH为辅助因子,催化二氢黄酮醇还原成各自的亮花青素,这些是花青素和原花青素生物合成的常见前体。无色不稳定的亮花青素是合成花青素的直接前体,是花瓣和果实中主要的水溶性色素。它们也是儿茶素和原花青素的前体,参与植物抗病性,也影响植物产品的质量[8-10]。DFR存在底物特异性,这个特性通常决定植物积累的花青素类型[11]。DFR基因同源物已从许多植物物种中分离出来,二氢黄酮醇-4-还原酶(DFR)最早是从玉米(Zeamays)中分离鉴定[12],中国水仙(Narcissustazettavar.chinensis)[13]、新疆雪莲(SaussureainvolucrataKar.et Kir.)[14]和黄芩(Scutellariabaicalensis)[15]等多种植物中已分离克隆出DFR基因。郑好等[6]发现在芥蓝(Chinese Kale)不同发育时期和不同器官中其BoaDFR表达水平存在显著差异。武博等[16]分析发现毛白杨(Populustomentosa)二氢黄酮醇-4-还原酶基因PtDFR蛋白具有2个保守结构域[NADP(H)结合位点和底物特异性结合位点]。研究表明DFR基因作为花青素合成的关键酶基因,对植物的着色有着关键的作用。对矮牵牛(Petuniahybrida)介导舞春花(Calibrachoahybrids)CaDFR基因进行过表达,观察到转基因矮牵牛的花蕾和花色与对照组相比发生变化[17]。从紫萼(Hostaventricosa)克隆的HvDFR基因转入烟草中增加了烟草花青素的积累[18]。研究说明,DFR的表达情况对植物花色有重要影响。王云生等[19]在茶树(Camelliasinensis)中利用原核表达纯化出目的蛋白,利用HPLC-MS方法对重组蛋白进行了体外酶活检测,目的蛋白具有DFR酶活性。因此,研究DFR底物特异性机理对花色改良和育种具有重要意义。
本试验采用RT-PCR和RACE技术从比利时杜鹃花中克隆获得DFR基因,通过生物信息学分析对比利时杜鹃花RhDFR蛋白结构进行分析;利用植物酶联免疫试剂盒(ELISA)对红色和白色比利时杜鹃花不同发育时期DFR活性进行测定;利用qRT-PCR技术分析RhDFR基因在红色和白色比利时杜鹃花不同器官和不同发育时期花瓣的表达情况,为RhDFR基因的表达和功能研究奠定了基础;通过构建原核表达载体pET-28a-RhDFR转化大肠杆菌(BL21)进行原核诱导表达。本试验为从分子角度分析杜鹃花花色差异变化提供了思路,也为其他观赏性物种花色改良及更深入探讨杜鹃花花青素合成途径供了科学依据。
1 材料和方法
1.1 实验材料
实验材料于2022年7月在中国宁波北仑柴桥万景杜鹃良种园(E121°27′40″~122°10′22″,N29°41′44″~29°58′48″)中采集。选择生长良好的红色和白色比利时杜鹃花为实验材料。比利时杜鹃花花朵发育4个时期(花苞期、初开期、盛开期和衰败期)及不同器官(分为雌蕊、瓣化雄蕊、花瓣和叶片)如图1所示。采后立即置于液氮中,然后放入-80 ℃超低温冰箱内储存备用。
1.2 实验方法
1.2.1 RNA提取与cDNA合成用液氮研磨红色比利时杜鹃花样品,使用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司)提取花瓣总RNA。通过1.5%琼脂糖凝胶电泳和SpectraMax 190全波长酶标仪(北京龙跃生物科技发展有限公司)测定总RNA的质量和浓度。按照NovoScript®Plus All-in-one 1st Strand cDNA Synthesis SuperMix (gDNA Purge)反转录试剂盒(上海近岸科技有限公司)说明书逆转录合成cDNA。使用SMARTer®RACE 5′/3′ Kit RACE试剂盒(宝日医生物技术有限公司)说明书逆转录合成3′/5′cDNA[20-21]。
1.2.2RhDFR基因全长克隆及生物信息学分析从NCBI数据库中下载其他植物DFR基因序列。使用Primer 6.0软件进行简并引物DFR-R1和DFR-F1设计(表1)。以红色比利时花苞时期杜鹃花cDNA为模板,按照2×FastPfuMasterMix酶(上海近岸科技有限公司)说明书进行PCR扩增。扩增产物经1.5%琼脂糖凝胶电泳检测,回收与目的片段大小相同的PCR产物,将PCR扩增回收产物与pEASY®-BluntCloningKit(北京全式金生物技术股份有限公司)载体连接并转化到大肠杆菌DH5α菌株中。将感受态细胞均匀涂布于具有卡那霉素(100 mg·mL-1)抗性的LB固体培养基上,将平板倒置于37 ℃恒温培养箱中。挑选过夜培养平板的单一菌落,利用M13F和M13R通用引物进行菌液PCR,筛选阳性克隆菌,进行测序(北京擎科生物科技有限公司)。使用Primer 6.0软件进行RACEDFR-5′和DFR-3′的引物设计(表1),后续实验过程与保守区域克隆相同,从而获得DFR-5′和DFR-3′基因的核苷酸序列。使用DNAMAN 8软件进行序列拼接,根据拼接结果使用Primer 6.0软件设计全长引物DFR-R2和DFR-F2(表1),后续实验过程与保守区域克隆相同,从而获得DFR基因全部核苷酸序列。

表1 本研究所用的引物序列Table 1 Primer sequences used in this study
使用DNAMAN 8.0软件进行同源蛋白质多序列比对;下载其他植物的二氢黄酮醇-4-还原酶(DFR)序列[Gen Bank(https://www.ncbi.nlm.nih.gov/)],利用MEGA 6.0 软件构建系统进化树分析;采用ProtParam(http://web.expasy.org/protparam)和Protscale(http://web.expasy.org/protscale)网站对RhDFR蛋白结构、分子构成、等电点、糖基化位点、磷酸化位点和亲疏水性进行分析;采用SOPMA (https://npsa-prabi.ibcp.fr/)和Swiss Model(https://www.swissmodel.expasy.org/)网站对RhDFR蛋白质二级结构和三级结构预测;采用CDD网站对RhDFR蛋白功能结构域分析(https://www.ncbi.nlm.nih.gov/cdd/);采用NetPhos 网站对RhDFR蛋白磷酸化位点分析(http://www.cbs.dtu.dk/services/NetPhos/)。
1.2.3 RhDFR活性测定利用植物酶联免疫试剂盒(ELISA)对红色和白色比利时不同发育时期RhDFR活性进行测定。根据对应的ELISA试剂盒说明书对红色和白色比利时杜鹃花不同时期花瓣样品进行粗酶液提取。使用液氮对样品进行研磨,分别称取0.1~0.2 g研磨后的样品,加入1 mL PBS(pH 7.4)缓冲液,4 ℃、8 000 r/min离心30 min,取上清液通过0.45 μm微孔过滤器过滤,4 ℃保存。根据对应酶的植物酶联免疫试剂盒说明书进行RhDFR活性测定。
1.2.4 比利时杜鹃RhDFR基因表达量分析实验所用qRT-PCR的引物序列为全长引物DFR-R3和DFR-F3(表1)。使用RNAprep Pure多糖多酚植物总RNA提取试剂盒提取实验材料总RNA,按照NovoScript®Plus All-in-one 1st Strand cDNA Synthesis SuperMix (gDNA Purge)反转录试剂盒合成荧光cDNA。按照NovoStart®SYBR qPCR SuperMix Plus(上海近岸科技有限公司)试剂盒进行qRT-PCR分析。反应体系包括35 μL的2×No-voStart®SYBR qPCR SuperMix Plus,正、反向引物各1.4 μL,1.4 μL 荧光cDNA,30.8 μL ddH2O,总体积70 μL。反应程序为预变性95 ℃ 5 min;95 ℃ 1 min;95 ℃ 20 s;60 ℃ 1 min;30个循环。采用2-ΔΔCT[22]法计算基因相对表达量。实验所用Actin-R和Actin-F作为内参基因[23]。每种样品都设3次重复。
1.2.5RhDFR基因的原核表达使用Primer 6.0软件设计带有酶切位点的上下游引物DFR-F4和DFR-R4(下划线20 bp为载体序列)(表1)。以比利时杜鹃花花瓣cDNA为模版,利用2×EasyTaq®PCR Super Mix酶进行PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳检测,PCR扩增回收产物与目的片段大小相同。用EcoRI-HF酶(纽英伦生物技术有限公司)将pET-28a质粒(武汉淼灵生物科技有限公司)进行单酶切,酶切产物经1.5%琼脂糖凝胶电泳检测,酶切产物进行割胶回收纯化,使用NovoRec®plus One step PCR Cloning Kit(上海近岸科技有限公司)连接酶试剂盒说明书将纯化产物按载体片段和插入片段摩尔比1∶2连接后。再将连接后pET-28a-RhDFR载体轻轻混匀加入大肠杆菌DH5α感受态细胞中。将一定量的菌体均匀涂布在含Kan的抗生素平板上,37 ℃倒置过夜培养。挑取重组的单一菌落进行菌液PCR鉴定,将质粒送样测序。
1.2.6 RhDFR重组蛋白制备与纯化将重组质粒pET-28a-RhDFR和空载质粒pET-28a加入大肠杆菌BL21感受态细胞中轻轻混匀。将转化后的感受态细胞加到含Kan抗性的固体培养基,37 ℃倒置过夜培养。挑取重组的单一菌落进行菌液PCR鉴定。将重组质粒pET-28a-RhDFR和空载质粒pET-28a阳性菌落预培养于10 mL含有Kan抗性的LB液体培养基中,37 ℃、200 r/min过夜。当菌液吸光度(A600 nm)达到0.5~0.8时,加入0.8 mmol/L IPTG溶液,在37 ℃条件下诱导重组蛋白4 h[24]。诱导结束后4 ℃、8 000 r/min离心10 min收菌,用2 mL 0.1%磷酸盐缓冲液(PBS)悬浮沉淀,对沉淀进行超声处理,4 ℃、13 000 r/min离心10 min后吸取上清液,用2 mL 0.1%磷酸盐缓冲液(PBS)悬浮沉淀。分别收集上清和沉淀,然后取20 μL蛋白样品加入20 μL DTT混匀,100 ℃水浴加热5~10 min,冷却至室温使蛋白变性,进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(10% SDS-PAGE)验证重组蛋白可溶性。使用His60镍超流树脂和重力柱对可溶性重组蛋白进行纯化,收集洗脱液,将洗脱液中的蛋白进行10% SDS-PAGE凝胶电泳分析。
2 结果与分析
2.1 RhDFR基因的克隆
以红色比利时杜鹃花cDNA为模板,利用简并引物进行PCR扩增获得542 bp保守区序列(图2,A);基于保守区序列的RACE扩增,分别获得808 bp的3′序列(图2,B)和817 bp的5′序列(图2,C)。利用DNAMAN软件将保守、5′和3′区序列进行比对拼接,得到RhDFR基因全长为1 253 bp,其中包含1 035 bp的完整ORF序列(图2,D),编码344个氨基酸。

M.DL2000;A.保守区;B.5′-RACE;C.3′-RACE;D.ORF图2 比利时杜鹃花DFR基因 PCR 扩增M.DL2000;A.Conserved zone;B.5′-RACE;C.3′-RACE;D.ORFFig.2 PCR amplification of DFR gene in Rhododendron hybridum Hort.
2.2 RhDFR基因生物信息学分析
通过ProtParam和Protscale网站预测RhDFR蛋白理化性质及亲疏水性。其分子式为C1730H2682N442O512S16,相对分子质量为38 377.94 Da,理论等电点为5.47,总的负电荷残基(Asp+Glu)为45,总的正电荷残基本(Arg+Lys)为36,不稳定指数(Ⅱ)为31.81,亲水性平均值为-0、186,脂肪系数为82.18。结果表明,RhDFR蛋白为酸性、带负电荷稳定的亲水性蛋白。
通过CDD网站对RhDFR蛋白功能结构域进行分析。结果表明,比利时杜鹃花RhDFR蛋白具有一个NADPH结合结构域和一个底物特异性结合结构域。
如图3所示,采用NetPhos网站对RhDFR蛋白磷酸化位点进行分析。结果表明,RhDFR蛋白存在25个磷酸化位点,其中丝氨酸16个,苏氨酸12个,酪氨酸6个。
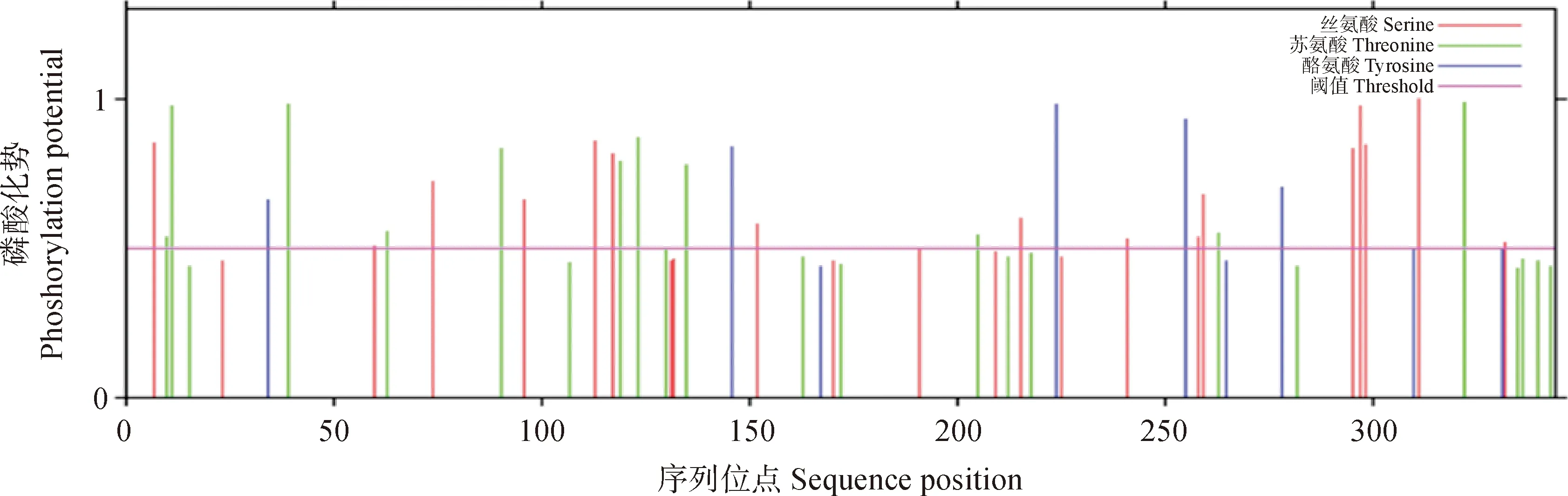
图3 RhDFR蛋白磷酸化位点分析Fig.3 Analysis of RhDFR protein phosphorylation sites
如图4所示,采用Protscale对RhDFR蛋白疏水性进行分析。RhDFR蛋白质存在明显的疏水区和亲水区,其中第194位最高为3.056;第97和98位最低为-2.333。结果表明,RhDFR蛋白质为亲水性蛋白质。
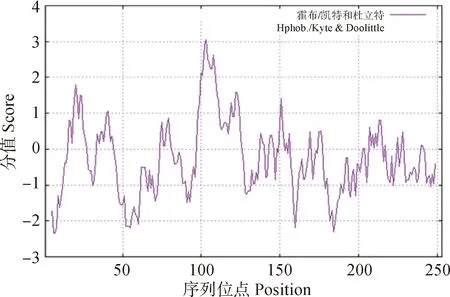
图4 RhDFR蛋白质疏水性/亲水性预测Fig.4 Prediction of the hydrophobic/hydrophilic of RhDFR
如图5所示,利用SOPMA对RhDFR基因编码的蛋白质进行二级结构预测。结果表明,有132个氨基酸参与形成α螺旋,有44个氨基酸参与形成延伸链,有20个氨基酸参与形成β-转角和有144个氨基酸参与形成无规则卷曲,分别占38.37%、13.95%、5.81%和41.86%。RhDFR蛋白主要由无规则卷曲和α-螺旋结构组成。
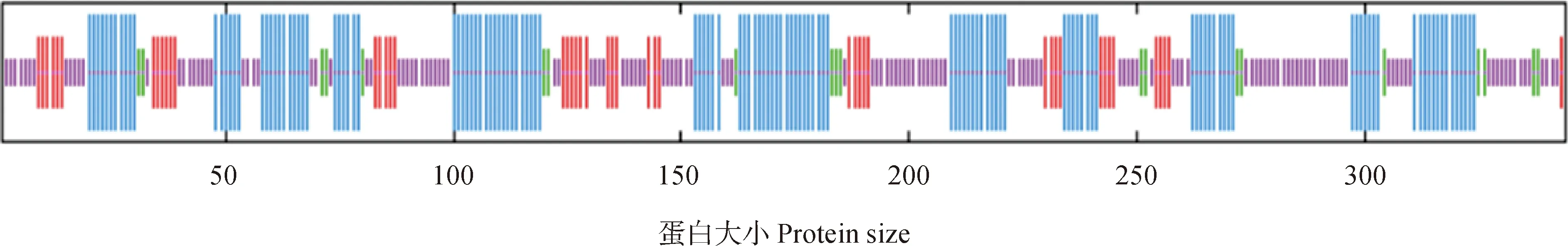
图5 RhDFR蛋白二级结构预测Fig.5 Predicted secondary structure of RhDFR protein
如图6所示,采用Swiss Model网站对RhDFR蛋白质三级结构预测。结果表明,RhDFR蛋白质三级结构与二级结构预测结果一致,含有无规则卷曲、α-螺旋、β-转角和延伸链结构。
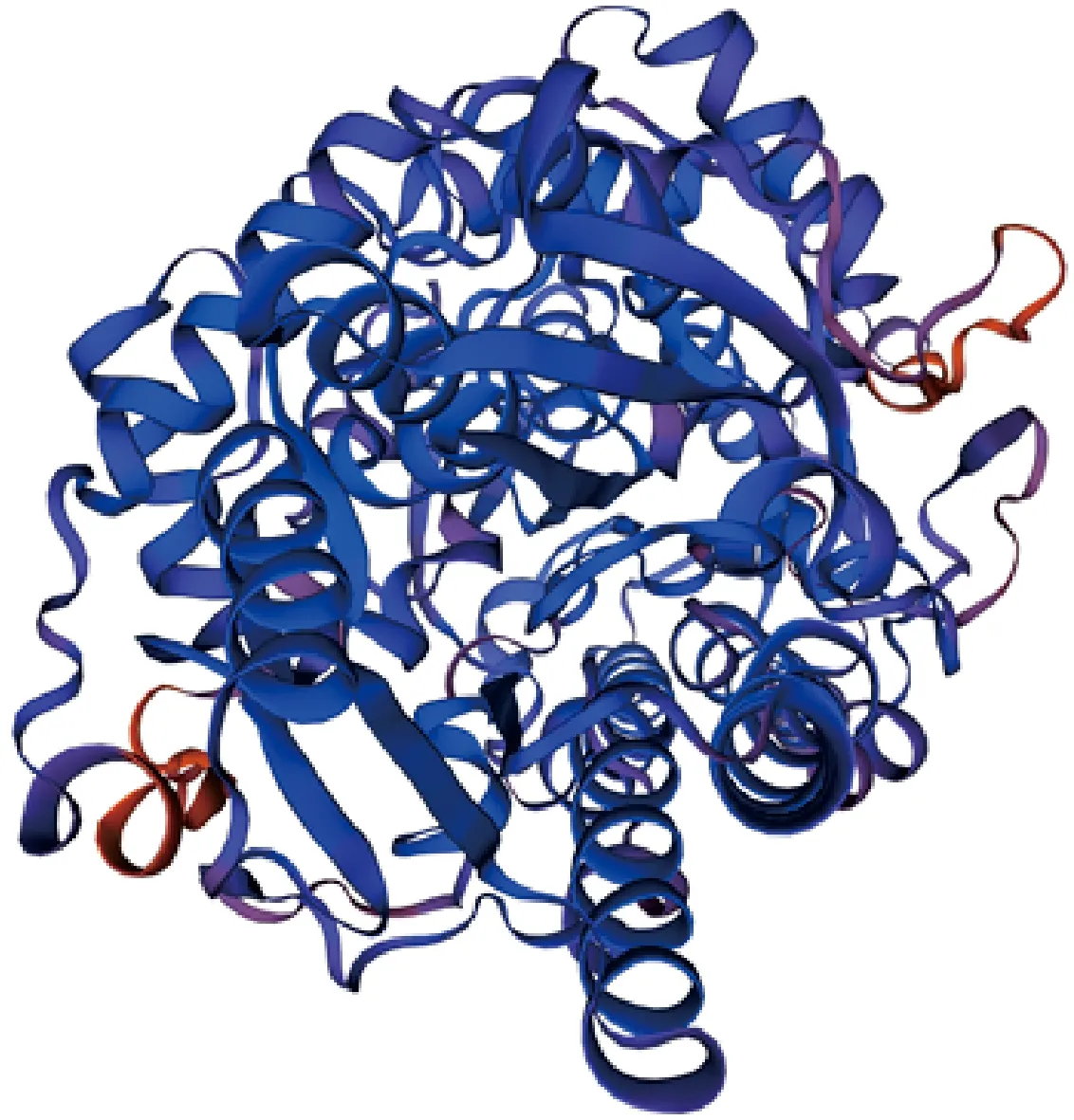
图6 RhDFR蛋白三级结构预测Fig.6 Predicted tertiary structure of RhDFR protein
如图7所示,利用DNAMAN 8.0软件进行蛋白质多序列比对,RhDFR基因编码的氨基酸与凤仙花(Impatiensglandulifera)、猕猴桃(Actinidiachinensis)、矢车菊(Centaureacyanus)、仙客来(Cyclamengraecum)、斑点矢车菊(Centaureamaculosa)、向日葵(Helianthusannuus)、雪莲(Saussureainvolucrata)、越橘(Vacciniumcorymbosum)和紫锥果菊(Echinaceapurpurea)中的DFR蛋白相似性分别为78.53%、88.41%、76.52%、81.40%、77.23%、74.86%、76.52%、92.75%和71.79%。结果表明,RhDFR蛋白含有与一个NADPH结合的保守基序和一个特异结合区,因此初步推测RhDFR蛋白为DFR蛋白的编码序列。

图7 RhDFR与不同物种DFR蛋白的氨基酸序列比对Fig.7 Amino acid sequence comparison of RhDFR with DFR proteins of different species
如图8所示,利用MEGA 6.0 软件构建系统进化树分析,从NCBI中下载其他物种的目的蛋白序列。比利时杜鹃花RhDFR蛋白与越橘DFR(Vacciniumcorymbosum,AHK23093.1)亲缘关系最近。
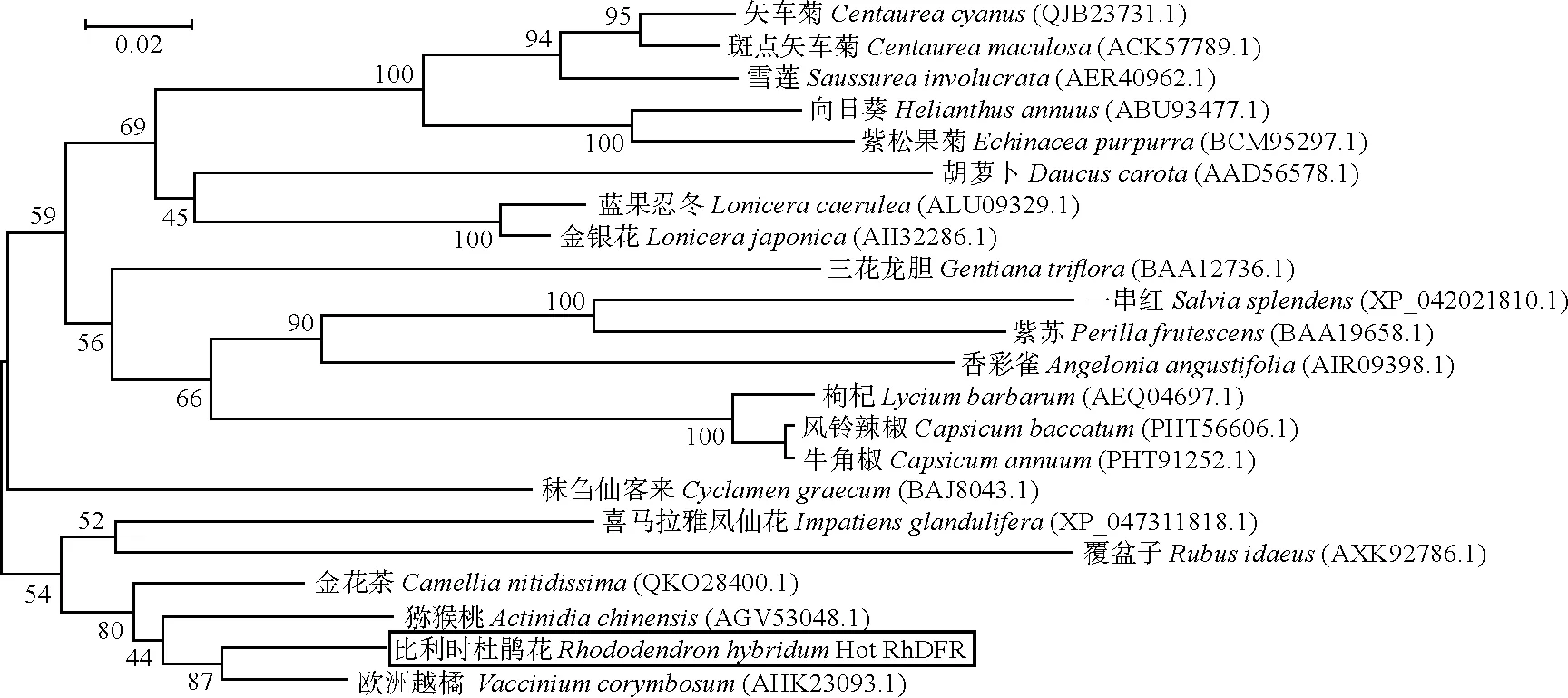
图8 RhDFR与其他植物DFR蛋白的系统进化树分析Fig.8 Phylogenetic tree analysis of RhDFR and other plant DFR proteins
2.3 比利时杜鹃花瓣不同发育时期DFR活性的变化
如图9所示,在红色与白色比利时杜鹃花不同发育时期DFR活性呈先上升后下降的趋势,红色比利时杜鹃花在初开期DFR活性最高,而白色比利时杜鹃花在盛开期DFR活性最高。在红色和白色比利时杜鹃花不同发育时期,白色比利时杜鹃花在盛开期和衰亡期的DFR活性高于相应红色比利时杜鹃花,其活性分别约为红色比利时杜鹃花的1.31和1.26倍。而红色比利时杜鹃花在花苞期和初开期DFR活性高于白色比利时杜鹃花,其DFR的活性分别约为白色比利时杜鹃花的1.33和1.23倍。

不同小写字母表示不同花期在0.05水平差异显著性,不同大写字母表示在0.01水平差异显著性,图11同图9 比利时杜鹃花不同发育时期RhDFR活性Different normal letters indicate significant differences at 0.05 level,and different capital letters indicate that they differ significantly at 0.01 level,the same as Fig.11Fig.9 RhDFR activity at different development stages in R. hybridum Hort.
2.4 比利时杜鹃花不同器官及花瓣不同发育时期DFR基因的空间表达特性
2.4.1 比利时杜鹃花不同组织RhDFR基因表达量如图10所示,利用qRT-PCR技术在红色和白色比利时杜鹃花叶子、花瓣、雄蕊和雌蕊中分析了RhDFR基因表达水平。结果表明,在比利时杜鹃花不同器官中,RhDFR表达量存在明显差异。红色和白色比利时杜鹃花RhDFR表达量均在花瓣中最高,显著高于其他器官,其次是叶子,最低的是雄蕊。红色比利时杜鹃花不同组织的RhDFR基因表达量高于白色比利时杜鹃花,其中红色比利时杜鹃花叶子、雄蕊、雌蕊和花瓣DFR基因表达量分别约为白色比利时杜鹃花的1.56、1.27、1.10和1.40倍。
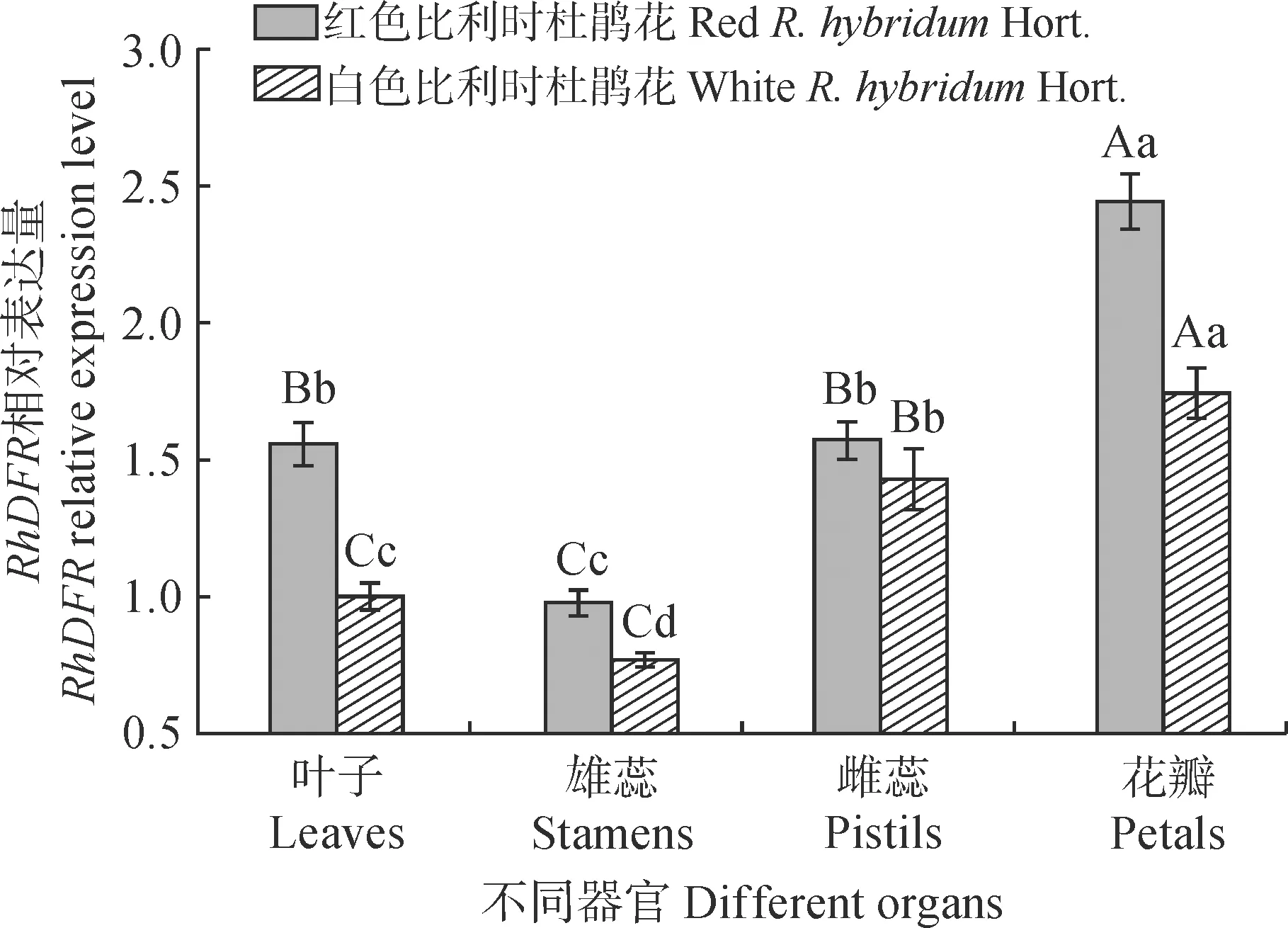
不同小写字母表示不同组织间在0.05水平差异显著性,不同大写字母表示在0.01水平差异显著性图10 比利时杜鹃花RhDFR在不同器官中的表达Different normal letters indicate significant differences at 0.05 level,and different capital letters indicate that they differ significantly at 0.01 levelFig.10 Expression of RhDFR in R. hybridum Hort.in different organs
2.4.2 比利时杜鹃花花瓣不同发育时期RhDFR基因表达量从图11可知,在杜鹃花4个阶段的生长过程中,红色和白色比利时杜鹃花花瓣中RhDFR的表达量均呈现先上升后下降的趋势,红色比利时杜鹃花在初开期表达量最大,而白色比利时杜鹃花在盛开期表达量最大。红色比利时杜鹃花中RhDFR的基因表达量均高于同期白色比利时杜鹃花RhDFR基因表达量。其中,红色比利时杜鹃花在花苞期、初开期、盛开期和衰亡期的花瓣RhDFR基因表达量约为白色比利时杜鹃花的1.58、5.65、1.43和1.79倍。

图11 比利时杜鹃花RhDFR在不同发育时期的表达Fig.11 Expression of RhDFR in R. hybridum Hort.petals at different periods
2.5 RhDFR蛋白制备和纯化
如图12所示,将测序正确的重组质粒pET-28-RhDFR和空载质粒pET-28转入大肠杆菌(BL21)中,以空载质粒pET-28转入大肠杆菌作为蛋白阴性对照。用10% SDS-PAGE凝胶电泳分析,可溶性重组蛋白大小约为38 kD,与预期大小相近。结果说明RhDFR蛋白在大肠杆菌中成功表达。
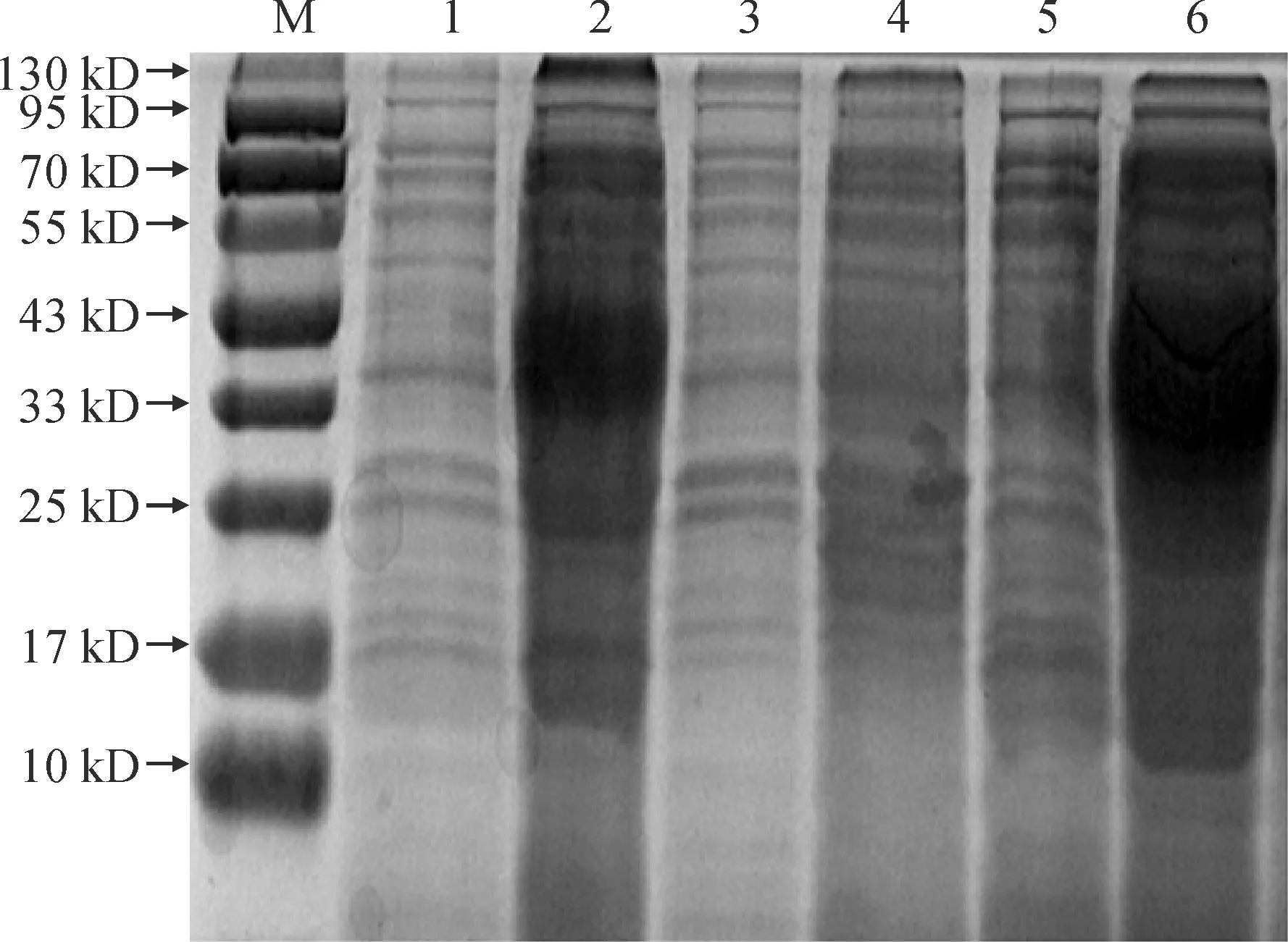
M.蛋白标准;1.诱导前对照菌;2.诱导表达菌体;3和4为未加IPTG诱导剂对照菌的沉淀和上清液;5和6为加入IPTG诱导剂表达菌体的沉淀和上清液图12 重组RhDFR蛋白的10% SDS-PAGE分析M.Protein standard;1.Control bacteria before induction;2.Induced expression organisms;3 and 4 are precipitates and supernatants of control bacteria without IPTG inducer;5 and 6 are precipitates and supernatants of expression organisms with IPTG inducer addedFig.12 10% SDS-PAGE analysis of recombinant RhDFR protein
如图13所示,使用His60镍超流树脂和重力柱对加入IPTG诱导剂的上清液中pET-28-RhDFR重组质粒进行蛋白纯化。用10% SDS-PAGE凝胶电泳分析,纯化后的RhDFR蛋白大小约为38 kD,与理论值相近。

M.蛋白标准;1为纯化后的重组质粒pET-28-RhDFR图13 重组RhDFR蛋白纯化后的10% SDS-PAGE分析M.Protein standard;1 The purified recombinant plasmid pET-28-RhDFRFig.13 10% SDS-PAGE analysis of recombinant RhDFR protein after purification
3 讨 论
二氢黄酮醇-4-还原酶(DFR)基因在植物中表现出很强的序列保守性。通过生物信息学分析中,在比利时杜鹃花花青素生物合成中,RhDFR含有一个NADPH结合的保守基序和一个特异结合区,与玫瑰(Rosarugosa)RrDFR1[25]、矮牵牛(Petuniahybrida)PhDFR[25]、滇牡丹(Paeoniadelavayi)PdDFR[26]、羽衣甘蓝(Ornamental Kale)BoDFR[27]、滇牡丹DFR[28]和红花CtDFR1(CarthamustinctoriusL.)[29]蛋白结合位点相同。RhDFR基因序列所编码的氨基酸序列与其他物种DFR编码的氨基酸序列具有较高的相似性,具有相应的保守区域、活性位点和结合位点等,因此推测他们编码相同的蛋白。系统进化树分析表明,RhDFR蛋白与越橘DFR蛋白亲缘关系最近。本研究通过RT-PCR技术和RACE技术从比利时杜鹃花中克隆RhDFR的基因序列,RhDFR全长1 253 bp,ORF长度为1 035 bp,编码344个氨基酸;RhDFR蛋白为酸性、带负电荷稳定的亲水性蛋白。
潘怡辰[30]研究表明黑粒小麦(Black-greined what)在灌浆期DFR活性呈先上升后下降的趋势。本实验研究结果与之相同,在红色和白色比利时杜鹃花不同发育时期DFR活性都呈先上升后下降的趋势,红色比利时杜鹃花在初开期DFR活性最高,而白色比利时杜鹃花在盛开期DFR活性最高,研究表明红色和白色比利时杜鹃花具有RhDFR活性。在国内外研究中未发现其他观赏性植物DFR活性的检测。利用qRT-PCR技术对红色和白色比利时杜鹃花不同器官及花瓣不同发育时期RhDFR基因的表达差异进行分析,从不同器官中的基因表达量来看,RhDFR基因在花瓣中的表达水平最高,其中红色比利时杜鹃花不同组织的RhDFR基因表达量高于白色比利时杜鹃花。这与葡萄风信子(Muscariarmeniacum)MaDFR[7]、黄芩SbDFR[15]基因的表达量趋势一致,在花瓣中DFR基因的表达水平最高。在红色和白色比利时杜鹃花花瓣发育的不同阶段,RhDFR在红花发育到初开期时表达水平最高,白花则在盛开期的表达水平最高。严朋飞等[31]发现威氏绿绒蒿(Meconopsiswilsonii)在开花过程中MwDFR基因表达量也呈先上升再下降的趋势;齐宇[32]报道玫瑰DFR基因表达量也呈先上升再下降的趋势,并在初开期达到峰值,均与RhDFR表达结果相同。结果证明,在红色和白色比利时杜鹃花不同发育时期DFR活性和基因表达量都呈正相关。红色和白色比利时杜鹃花DFR活性及基因表达量分别在初开期和盛开期最高。
本实验在成功克隆获得比利时杜鹃花RhDFR基因的基础上构建pET-28-RhDFR重组表达载体,并对其进行了诱导表达。研究显示,与潘丽晶等[33]石斛兰(Dendrobium)DenDFR基因的原核表达验证结果相符。在原核表达体系中,二氢黄酮醇 4-还原酶(DFR)融合蛋白在上清液中表达[34],这与本实验结果相符。本研究中在37 ℃诱导4 h条件下pET-28-RhDFR目的蛋白以可溶性形式存在[34-35]。本试验使用His60镍超流树脂和重力柱对pET-28-RhDFR重组质粒进行蛋白纯化,纯化后的RhDFR蛋白大小约为38 kD,与理论值相近。
本研究以红色和白色比利时杜鹃花的不同器官和不同发育时期花瓣为实验材料,克隆得到RhDFR基因,并对RhDFR基因进行生物信息学分析,也对比利时杜鹃花不同发育阶段RhDFR活性检测;还通过qRT-PCR分析RhDFR基因在比利时杜鹃花不同发育阶段和雌蕊、雄蕊、花瓣和叶片中的表达量;同时成功制备pET-28-RhDFR重组蛋白。比利时杜鹃花RhDFR基因克隆及表达研究尚未见报道,本研究首次克隆得到的比利时杜鹃花二氢黄酮醇4-还原酶(RhDFR)基因,并对该基因表达量和蛋白进行相关验证。上述研究表明,杜鹃花中RhDFR活性的功能多样化,DFR基因与比利时杜鹃花花瓣的颜色有关。本研究结果对深入探讨杜鹃花花色调控分子机制有着重要意义,也为进一步研究RhDFR基因功能奠定了基础。
