猕猴桃Aux/IAA基因家族的鉴定与表达
2023-02-21苏丽艳
苏丽艳
(西安文理学院 生物与环境工程学院,陕西省航天育种工程中心,西安 710065)
生长素作为重要的植物激素之一,在植物的生长发育,如细胞分裂与伸长、器官形成、果实的发育等过程有重要的调控作用[1-2]。Aux/IAA是生长素信号早期响应因子之一,在生长素浓度较低时,Aux/IAA通过与生长素响应因子(auxin response factor,ARF)形成异源二聚体抑制生长素信号转导过程;当生长素浓度较高时,Aux/IAA发生降解,释放ARF,调控下游靶基因的表达[3-4]。典型的Aux/IAA基因含有Ⅰ、Ⅱ、Ⅲ、Ⅳ 四个保守的结构功能域,结构域 Ⅰ 包含保守的亮氨酸重复基序LxLxLx,抑制生长素下游调控基因。结构域 Ⅱ 保守的GWPPV 基序与 F-box 蛋白 TIR1 相互作用,导致 Aux/IAA 的不稳定性和快速降解。位于 C 端的结构域 Ⅲ和 Ⅳ 能与其他 Aux/IAA 或 ARF 相互作用,形成同源二聚体和异源二聚体,从而调控下游基因表达[5-6]。
随着植物基因组测序的完成,Aux/IAA家族基因在多种植物中均已分离与鉴定。如拟南芥中分离鉴定Aux/IAA家族基因29个,水稻31个,番茄26个,黄瓜27个,玉米34个,草莓21个,且在小麦、葡萄、毛白杨和苜蓿等物种中均已被分离和鉴定[7-15]。Aux/IAA家族基因在植物发育过程中的功能也被广泛研究。在拟南芥中研究表明,iaa3/shy2、iaa7/axr2、iaa14/slr、iaa17/axr3、iaa28等 Aux/IAA 家族基因均参与拟南芥侧根的形成过程[16-18];水稻OsIAA1、OsIAA11及OsIAA23亦在根的发育过程中有重要调控作用[19-20];在番茄中,Sl-IAA9、Sl-IAA15、Sl-IAA17、Sl-IAA27等Aux/IAA 家族基因均参与调控番茄的根、叶及果实的发育过程[21-24]。
猕猴桃,又称奇异果,因其品质鲜嫩,营养丰富而受到广泛欢迎。红阳猕猴桃属中华猕猴桃(Actinidiachinensis)中的红肉猕猴桃变种,栽培过程中经常受到各种的非生物胁迫,如干旱、寒冷、盐分和激素胁迫。红阳猕猴桃全基因组测序的完成为鉴定基因家族成员的数量及预测其功能提供了重要的数据资源。本研究借助生物信息学手段分离鉴定猕猴桃Aux/IAA(AcIAA)家族成员,并对其序列特征、染色体定位、基因结构、顺式作用元件,不同组织及激素胁迫的表达模式进行分析,为进一步通过基因工程手段分析该家族基因在猕猴桃发育过程中的功能奠定基础。
1 材料和方法
1.1 材料及取样
红阳猕猴桃由陕西省周至县佰瑞猕猴桃研究院提供。植物组织取样自3株5年生(2016-2021)红阳猕猴桃嫁接树(嫁接砧木为佰瑞研究院自主培育品种YZ31012),包括根、茎、叶(春季幼叶第4片)、花、小果 (约花后30 d)、熟果 (约花后120 d),每种组织取3次重复。激素处理植株选取苗长约25 cm,含有6~8片叶的2年生嫁接苗。植物激素喷施于叶片上,处理浓度为100 μmol·L-1,对照组用超纯水处理。处理及对照组分别在处理0、1、6和12 h 取材,每个处理3次重复,每个重复选取长势较好的6株嫁接幼苗,每个样品含有6片不同植株的叶片。所有植物材料液氮冷藏于-80 ℃。
1.2 方 法
1.2.1 Aux/IAA家族基因的鉴定红阳猕猴桃基因组数据下载于Ensembl Plants (http://plants.ensembl.org/index.html),包括gff文件、蛋白序列和核酸序列文件[25]。IAA 基因家族的 HMM 模型(PF02309)下载于Pfam 数 据 库(http://pfam.xfam.org/),利用 HMMER 软件包的 hmmsearch 程序在猕猴桃基因组氨基酸序列中进行搜索(E<1 × 10-5),用 Perl 脚本提取候选蛋白的序列信息,比对到 Pfam数据库预测候选序列所含的结构域,保留含有IAA家族基因结构域的序列即为猕猴桃IAA家族成员初筛结果,再利用在线网站SMART (http://smart.embl-heidelberg.de) 及NCBI-CDD(http://www.ncbi.nlm.nih.gov/ Structure/ cdd/wrpsb.cgi)数据库进行结构域预测检验,确定Aux/IAA成员组成。
1.2.2 生物信息学分析利用在线工具 ExPASy(https://web.expasy.org/protparam/)分析 Aux/IAA家族蛋白的分子质量、等电点信息;使用 CELLO(http://cello.life.nctu.edu.tw/)进行蛋白亚细胞定位预测;利用MapChart V2.1进行染色体定位分析,通过 MEGA X 软件采用邻接法(neighbour-joining,NJ)构建进化树,利用meme软件做motif分析;利用 GSDS 2.0(http://gsds.cbi.pku.edu.cn/)进行基因结构分析;利用Clustalw 软件进行蛋白序列比对;通过 MCScanX 程序分析基因复制事件,DSP software展示猕猴桃和拟南芥Aux/IAA 基因共线性关系,运用拟南芥和猕猴桃之间PMEI 共线线性基因对计算 Ka 和 Ks 值,计算分化时间 T= Ks/2R;利用 PlantCARE 对猕猴桃Aux/IAA基因起始密码上游 1.5 kb 启动子的顺式作用元件进行查找和统计分析;基因定位利用WoLF PSORT在线网站完成。
1.2.3 实时荧光定量PCR分析猕猴桃叶片总RNA采用去多糖多酚试剂盒(天根,北京)提取,并利用反转录试剂盒合成cDNA(天根,北京)。以cDNA 为模板,利用ABI Quant Studio tm 6 Flex荧光定量PCR系统进行qPCR 检测。采用SYBR Green Master Mix (ROX,瑞士)试剂盒进行扩增反应,反应总体系为20 μL,包含SYBR Green Master Mix 10 μL,1 μL cDNA (30 ng · μL-1) 模板,上、下游引物 (10 μmol·L-1) 各1 μL,1 μL cDNA (30 ng · μL-1)模板,无菌水7 μL。扩增程序为 95 ℃预变性 30 s;95 ℃ 5 s,58 ℃ 10 s,72 ℃ 30 s,共 40 个循环。选取ACT2 基因 (GenBank:EF063571)为内参,用在线工具 Primer 3.0(http://primer3.ut.ee/)设计AcIAA家族基因特异性引物(表1),采用 2-ΔΔCt法计算目的基因的相对表达水平。

表1 实时荧光定量PCR所用引物Table 1 All the primers for quantitative real-time PCR
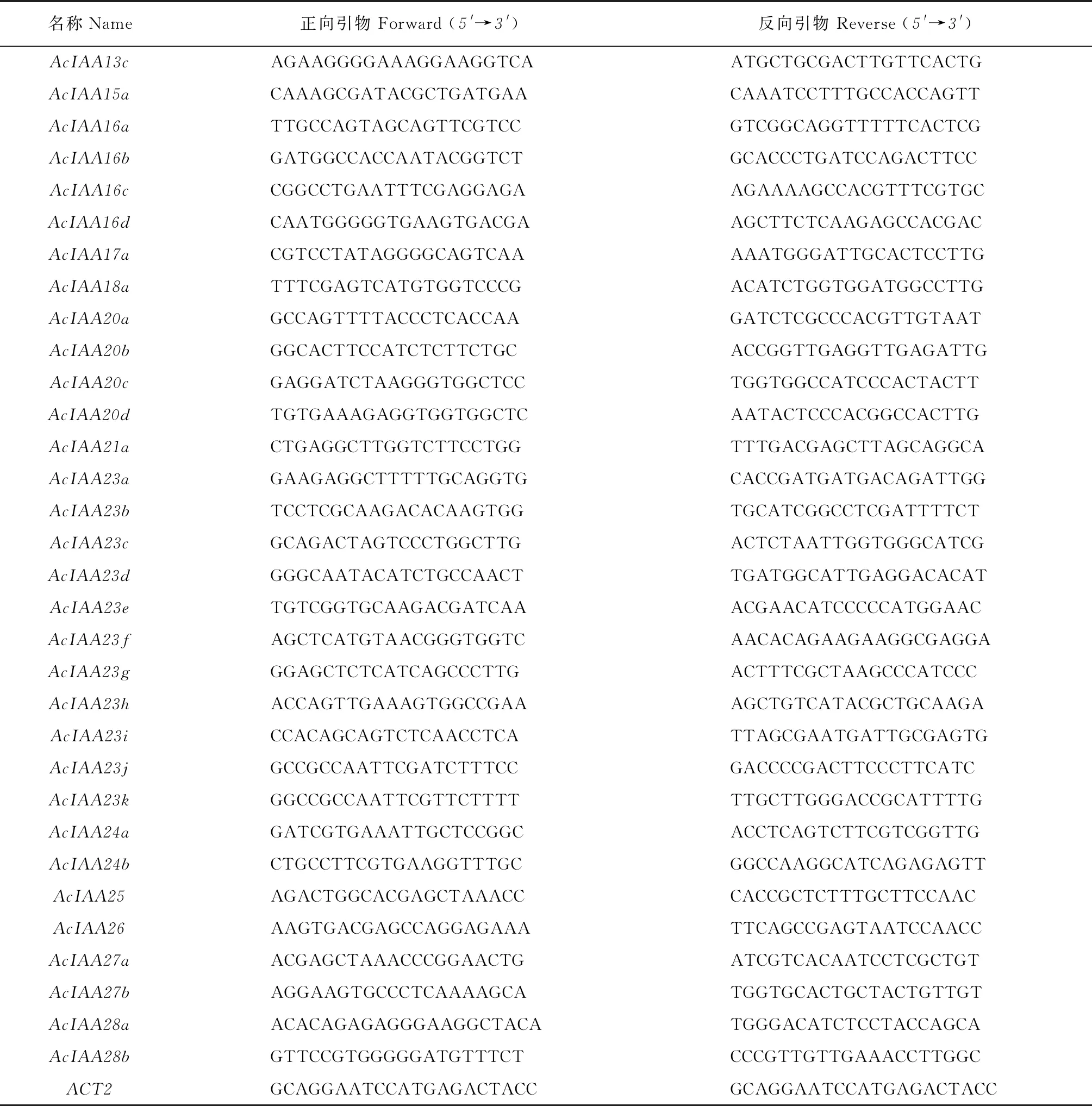
续表1 Continued Table 1
2 结果与分析
2.1 猕猴桃AcIAA家族成员的鉴定及染色体定位
经过分析与鉴定,确定猕猴桃AcIAA家族包含50个成员(表2)。根据其在染色体上的定位信息进行命名,若X号染色体上包含多个成员,则命名为AcIAA Xa、AcIAA Xb 以此类推。AcIAA家族成员氨基酸大小介于125~391 aa,分子量介于14.06~42.48 kD,等电点介于 4.33~9.51。内含子在1~5个不等。染色体定位分析表明,50个基因不均等地分布于21条染色体上,其中23号染色体上分布最多,共11个。
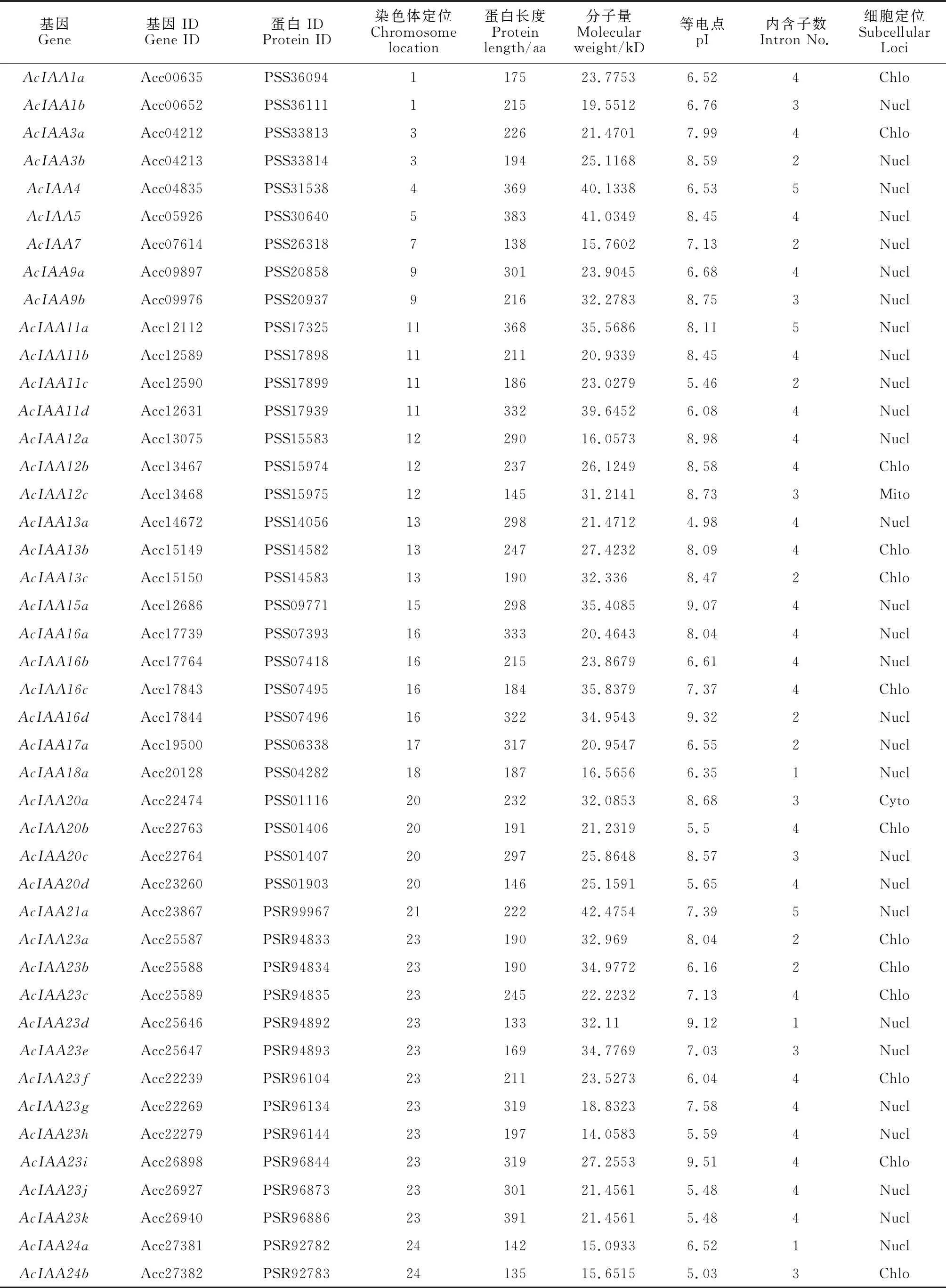
表2 猕猴桃AcIAA家族成员基本信息Table 2 Basic information of AcIAA family in A. chinensis
2.2 猕猴桃AcIAA家族成员进化关系分析
通过NJ方法构建猕猴桃AcIAA家族成员进化树,对50个基因的进化关系进行分析。根据亲缘关系远近可将其分为9组,进化树聚集在同一分支的成员间通常具有相似的基因结构和保守元件,可能在进化过程中具有相似的功能,不同的分支在长期的进化过程中可能出现了功能的分化(图1)。
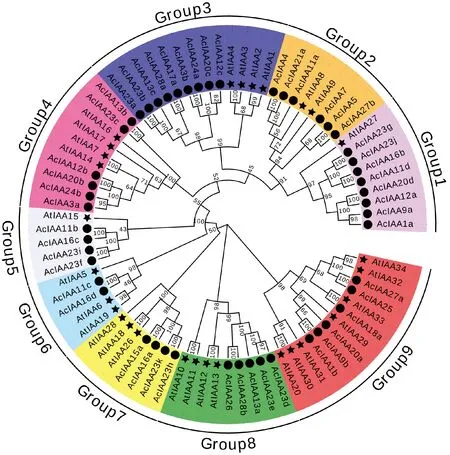
图1 猕猴桃与拟南芥中Aux/IAA家族进化关系分析Fig.1 Phylogenetic relationships of Aux/IAA family between A. thaliana and A. chinensis
2.3 猕猴桃AcIAA家族成员基因结构及保守元件分析
基因结构分析表明,猕猴桃AcIAA家族成员所含内含子数1~5个不等,外显子数2~7个不等。其中,结构较为简单的AcIAA18a和AcIAA24a含有1个内含子,结构较复杂的AcIAA4、AcIAA11a和AcIAA21a含有5个内含子(图2)。15个保守元件分析结果表明,50个AcIAA包含元件的种类和数量不等,Motif 2在50个基因中均含有,而Motif1、Motif3和Motif4存在于大部分家族成员中。

图2 AcIAA家族进化关系、基因结构及保守元件分析Fig.2 Phylogeny,motifs,and exon-intronic structures of AcIAAs

续表2 Continued Table 2
2.4 Aux/IAA家族基因共线性分析
由于基因重复能显著促进基因家族的扩展和蛋白质功能的多样化,本研究分析了AcIAA家族基因在猕猴桃基因组内(图3)及与拟南芥基因组间的基因复制事件(图4)。结果表明,组内筛选到23组重复事件AcIAA基因对,包括20对片段重复和3对串联重复(AcIAA23k/AcIAA23h、AcIAA23j/AcIAA23g、AcIAA23b/AcIAA23a)。组间筛选到24个AcIAA基因与拟南芥IAA家族基因形成了36组共线性关系(图4),基因组共线性分析可以预测AcIAA基因在种内和种间的序列同源性,同源基因可能具有相似的功能,因此全基因组共线性分析对于关键基因功能预测提供了线索。

图3 猕猴桃AcIAA家族基因共线性分析Fig.3 Collinear prediction of AcIAA family genes in A. chinensis

图4 猕猴桃与拟南芥基因组间Aux/IAA家族基因共线性分析Fig.4 Collinear prediction of Aux/IAA family genes between A. thaliana and A. chinensis
2.5 Aux/IAA家族基因启动子结构分析
对AcIAA家族成员启动子区1 500 bp序列进行了顺式作用元件分析。结果表明(表3),50个AcIAA基因含有多种植物激素应答及胁迫响应元件,包括生长素、赤霉素、脱落酸、茉莉酸甲酯、水杨酸、厌氧诱导、胁迫反应、干旱及低温等,预测该基因家族在猕猴桃形态建成及激素互作调控果实生长发育及逆境胁迫方面发挥着重要作用。此外,AcIAA基因均含光响应元件,且部分基因含有组织特异性(胚乳、分生组织等)。

表3 猕猴桃AcIAA基因家族基本信息Table 3 Basic information of AcIAA gene family in A. chinensis
2.6 Aux/IAA家族基因组织表达特异性分析
qRT-PCR检测发现,AcIAA基因在6种不同组织中均有表达,表达模式差异明显(图5)。AcIAA23k、AcIAA9b、AcIAA11c、AcIAA28a分别在根、茎、叶片和花中的表达量最高,其中AcIAA28a在果实发育过程中始终维持相对较高表达水平,说明该基因可能在果实整个发育过程中有重要的调控作用;AcIAA12c和AcIAA28b分别在小果和成熟果实中表达量最高。

图5 猕猴桃AcIAA基因在不同组织中表达热图Fig.5 The heatmap of AcIAA gene in different tissues of A. chinensis
2.7 AcIAA对外源激素IAA的响应模式分析
研究表明,Aux/IAA家族的基因作为生长素原初反应基因在激素互作调控植物生长发育过程有重要的功能。本研究筛选15个AcIAA基因为目标基因,利用qRT-PCR对其在植物激素IAA处理后的响应模式进行分析。结果(图6,A)显示,AcIAA3a、AcIAA5、AcIAA9b、AcIAA11b、AcIAA12c、AcIAA21a、AcIAA23j、AcIAA23k共8个基因在IAA处理后迅速响应,1 h后呈现显著性下调表达且持续到12 h后,特别是AcIAA9b持续保持显著下调表达趋势,其他基因后期表达量较处理初期有上升趋势,但仍然低于同期对照组;同时,AcIAA12b、AcIAA16d、AcIAA23e、AcIAA24b4个基因在IAA处理1和6 h后表达量显著下调,12 h后恢复正常水平;AcIAA25在IAA处理12 h呈现下调表达,应答速度较其他基因迟缓;AcIAA1a和AcIAA18a在IAA处理1 和6 h后表达量呈现一定的上调趋势,处理后期恢复正常表达水平(图6,B)。不同的基因对外源激素均有一定的响应,表明其参与了植物激素生长素对猕猴桃果实发育的调控过程。本研究检测的15个基因中,有13个基因的相对表达量在IAA处理不同时期呈现下调趋势,说明植物激素生长素对其有负调控作用;同时,有2个基因受到生长素的正向调控,因此,响应模式的差异也说明了Aux/IAA家族各个基因在调控猕猴桃发育过程中功能上的差异性。
3 讨 论
Aux/IAA家族基因作为重要的转录调控因子广泛参与植物生长发育各阶段及逆境响应过程[26-27]。本研究在猕猴桃基因组中鉴定出50个Aux/IAA基因,多数成员均含有Ⅱ、Ⅲ和Ⅳ结构域,部分基因缺失Ⅰ结构域,基因进化树同一分枝基因结构具有相似性,少量基因结构存在特异性,推测可能在猕猴桃进化过程中基因受到环境胁迫导致序列的缺失。
目前,Aux/IAA家族基因在很多物种中已被鉴定分离,前期研究表明,Aux/IAA家族基因在进化过程中存在较多的基因复制事件,本研究鉴定的50个基因中存在基因复制对共23组,包括20对片段重复和3对串联重复,基因扩张可能是在进化过程中发生了全基因组复制使连锁群加倍导致的[28],而Aux/IAA 基因扩张产生的功能冗余或多样性可为猕猴桃适应环境提供动力。猕猴桃与拟南芥基因组间形成36组共线性关系,根据猕猴桃与拟南芥Aux/IAA 基因间同源关系将Aux/IAA家族基因分为9组,同源基因功能可能存在相似性。从启动子顺式作用元件分析可知Aux/IAA家族基因含有大量激素响应、胁迫应答及生长发育调控相关的元件。以上结果可为进一步了解猕猴桃AcIAA基因的功能提供线索。
Aux/IAA家族基因在猕猴桃不同植物组织中的表达模式不同,表示该家族基因具有功能多样性,存在基因复制现象的基因部分表现出组织表达模式相似性,推测在功能上可能有冗余,如AcIAA1b和AcIAA9b,AcIAA15a和AcIAA16a,AcIAA11a和AcIAA21a;AcIAA11c和AcIAA16d,AcIAA12b和AcIAA20b。选取15个AcIAA基因分析其在植物激素IAA处理后的响应模式,15个基因均对外源激素处理作出应答,但其响应的时间和强度各有不同。其中,绝大多数基因均在激素处理的早期反应强烈,而后渐恢复,说明Aux/IAA家族基因中多数成员在响应生长素信号的早期发挥作用,且外源激素IAA对其有负向调控作用;被检测基因中仅有两个基因呈现一定上调表达,表明IAA对其有一定的正向调控作用,说明Aux/IAA家族基因直接或间接地参与了生长素调控猕猴桃生长发育的过程。

续表3 Continued Table 3

0h-C、1h-C、6h-C、12h-C与0h-I、1h-I、6h-I、12h-I分别为对照组与IAA处理组在0、1、6和12 h样品;不同小写字母表示差异达显著水平(P<0.05)图6 外源激素IAA处理后AcIAA基因表达模式0h-C,1h-C,6h-C,12h-C and 0h-I,1h-I,6h-I,12h-I are control and IAA treatment samples at 0,1,6 and 12 hours;The different normal letters indicate significant differences at the 0.05 level (P<0.05)Fig.6 Expression patterns of AcIAA genes under exogenous hormones IAA treatment
近期有大量研究表明Aux/IAA家族基因在植物果实的发育,特别是果实早期发育过程中有重要调控作用。如在番茄中,SlIAA3抑制表达后引起包括顶端优势在内的生长素及乙烯相关表型的改变[29],SlIAA9使番茄座果过程提前发生[21],Sl-IAA27下调后影响果实大小[23],Sl-IAA17则通过影响细胞的膨大过程使番茄果实增大[24]。猕猴桃Aux/IAA家族基因如何参与调控其生长发育过程,是否存在功能冗余现象,在生长素信号通路中的主要调控网络如何,如何对激素的调控作出响应,均有待进一步分析研究。
