关于中药新药用饮片取样法的探讨
2023-02-21周跃华衡明莉
周跃华,冯 丽,衡明莉*
·综 述·
关于中药新药用饮片取样法的探讨
周跃华1,冯 丽2,衡明莉1*
1. 国家药品监督管理局 药品审评中心,北京 100022 2. 河北省药品医疗器械检验研究院,河北 石家庄 050227
从药材及饮片(植物药)的包件取样、包件内取样及试验样品制备等方面对《中国药典》(Chinese Pharmacopoeia,ChP)、《欧洲药典》(European Pharmacopoeia,EP)、《英国药典》(British Pharmacopoeia,BP)及《美国药典》(United States Pharmacopoeia,USP)进行对比,结合新药用饮片检验的要求,就中药新药用饮片取样法存在的问题进行探讨,并提出以下建议:(1)相关部门组织专家起草中药新药用饮片取样的指导原则或技术要求。(2)暂时参照EP、BP的取样法对中药新药用饮片进行研究,并关注饮片取样对检验结果的影响。(3)根据试验样品的特点研究确定其处理方法。如饮片的不同药用部位或位置的质量差异大,可采用分层抽样的方法,减少取样误差。(4)加强药材的源头管理,减少药材质量差异。(5)在新药用饮片的生产过程中采用混合步骤提高同批饮片的同质性。(6)在ChP“中药材及饮片取样办法”中增加:待检批次饮片应具有较好的同质性;有些样品或试验需要采用更严格的取样方法,包括更多取样包件数或包件内取样量;此外,可对包件内抽取的位置进行修订。
中药饮片;取样方法;中国药典;欧洲药典;英国药典;美国药典
饮片是中药制剂生产的原料,其质量直接影响药品的安全、有效及质量稳定。实际工作中通过抽样方法从待检批次饮片中选取合理的样本量进行检验,从而推断待检批次饮片是否合格。《中国药典》2020年版(Chinese Pharmacopoeia,ChP)四部中“药材及饮片取样法”[1]是中药饮片抽样的基本方法。目前我国饮片质量标准或炮制规范中的定量指标大多未规定限度范围,对定量指标检测结果的精确度要求不高。即使不同单位的检测数据差异较大,只要符合标准规定的限度要求均判定合格。故ChP的饮片取样法基本适用。
饮片也是中药新药生产的原料。准确了解其质量状况对于保持不同批次中药新药质量的相对稳定具有重要意义。中药复方新药、古代经典名方中药复方制剂等的质量标准中规定了有效成分或指标成分的含量范围。均一化研究也需了解投料所用饮片中相关成分含量等的精确数据。因此,对于中药新药及经典名方中药复方制剂用饮片而言,需要采用合理的抽样方法以较好了解投料所用饮片的质量状况。为更好满足中药新药所用饮片的检验需要,本文就中药新药研究所用饮片取样相关问题进行探讨,以供参考。
1 饮片取样的现状
在饮片检验中,大多以抽样样本的均值估计总体均值。但这种点估计存在一定的误差。抽样误差受多种因素的影响,如饮片质量的离散程度、抽样样本量等。饮片质量波动越大,抽样误差越大,生产的质量风险越高,出现不合格的可能性就越大。一般情况下,抽样样本量越大,抽样误差越小。对于中药新药及经典名方制剂而言,准确了解所用饮片的质量状况是均一化投料、保证相应制剂质量稳定的基础。确定合理的取样方法和取样量,有利于较好估计待检批次饮片的整体质量状况,有利于保证不同批次中药制剂质量的稳定。
ChP四部中“药材及饮片取样法”采用2阶段随机抽样方法,分3个步骤。(1)包件取样:从待检批次的所有包件中按一定规则抽取规定数量的特定包件;(2)包件内抽样:从已抽取的特定包件中按一定规则抽取规定重量(体积)的样品;(3)试验样品准备:对已抽取的样品进行处理以获得能代表该批药材或饮片质量的试样。由于中药饮片具有天然产物质量波动较大的特点,如何通过合理抽样较好估计待检批次饮片的质量并不是一个简单的问题。
1.1 饮片批次
我国《药品生产质量管理规范》(good manufacturing practice,GMP)附件七[2]第49条明确:“中药饮片应以同一批中药材在同一连续生产周期生产的一定数量相对均质的成品为一批”。即同一批次的饮片应具有同质性。此外,《药材生产质管理规范》(good agriculture practice,GAP)[3]明确药材的“批”是指:“同一产地且种植地、养殖地、野生抚育或仿野生栽培地的生态环境条件基本一致,种子种苗或其它繁殖材料来源相同,生产周期相同,生产管理措施基本一致,采收期和产地加工方法基本一致,质量基本均一的中药材”。如果能严格按“六个同一”来确定批次,可以基本保证同一批次药材内部的同质性。但是,长期以来,我国中药材的生产方式较为粗放,按照GAP规范生产的较少。现阶段大多数药材尚未能按照“六个同一”确定批次。饮片加工炮制过程中也缺少有效的混合步骤,且流通过程中还可能合并批次,往往不能保证标示为同一批次饮片的同质性。



1.2 包件取样



表1 ChP的取样包件数与EP、BP、USP对比
1.3 包件内取样
包件内取样为确定抽样包件后从包件中取一定量的样品。抽取的样品应尽可能代表该包件内药物的质量。以下为4种药典对于包件内取样的规定,(1)USP:包装量<1 kg,混合样品,取足够试验用量;包装量为1~5 kg,从上、中、下取3份样,每份应满足试验用量;包装量>5 kg,从上、中、下取3份样,每份净质量250 g,共750 g,充分混合样品,取样应满足试验需要。(2)ChP:从包件至少2~3个不同部位取样。每个包件一般抽取100~500 g;粉末状抽25~50 g;贵重药材及饮片取样5~10 g。(3)EP、BP未直接给出包件内取样的数据,但明确了待检批次药物总量与总取样量的比例关系;同时,列出了待检批次药物总量、包件内装量(待检批次包件数)、包件取样量的关系。根据这2个关系可计算出每个包件的取样量,见表2。当待检药物总量一定时,无论包件内装量(或待检批次药物包件总数)如何改变,总取样量相同。一般情况下,包件内取样量越多越能反映包件内药物的质量状况。从包件内取样量看,ChP及USP规定的包件内取样量固定为100~500 g及750 g,无需根据包件内装量改变而改变。而EP、BP在规定根据待检批次药物总量确定总取样量的同时,根据该批药物包件总数规定了取样包件数。在药物总量、总取样量及取样包件数确定后,也明确了包件内取样量。当包件内装量增大时,ChP及USP的包件内取样量均不变,取样比下降;而EP、BP的包件内取样量随着包件内装量的增加而增多。
从表1、2可见,当包件内装量低于25 kg时,ChP、USP的包件内取样量大于EP、BP,此时,包件内抽样比大于0.6%,包件内取样量虽较少也可基本反映总体的质量;当包件内装量为125 kg时,ChP、USP的包件内取样量与EP、BP大致相当(ChP的抽样比为0.4%,USP为0.6%);当包件内装量为500 kg时,EP、BP的包件内抽样比为0.20%~0.27%,而ChP、USP的包件内取样量为500、750 g(抽样比为0.10%、0.15%);当包件内装量为2000 kg时,EP、BP的包件内抽样比为0.10%,而ChP、USP的包件内取样量仍是500、750 g(抽样比为0.025%、0.037 5%)。随着包件内装量的增加,ChP、USP的包件内抽样比下降,抽样误差相对增大。
1.4 总取样量
ChP与EP、BP、USP的总取样量对比情况见表3。
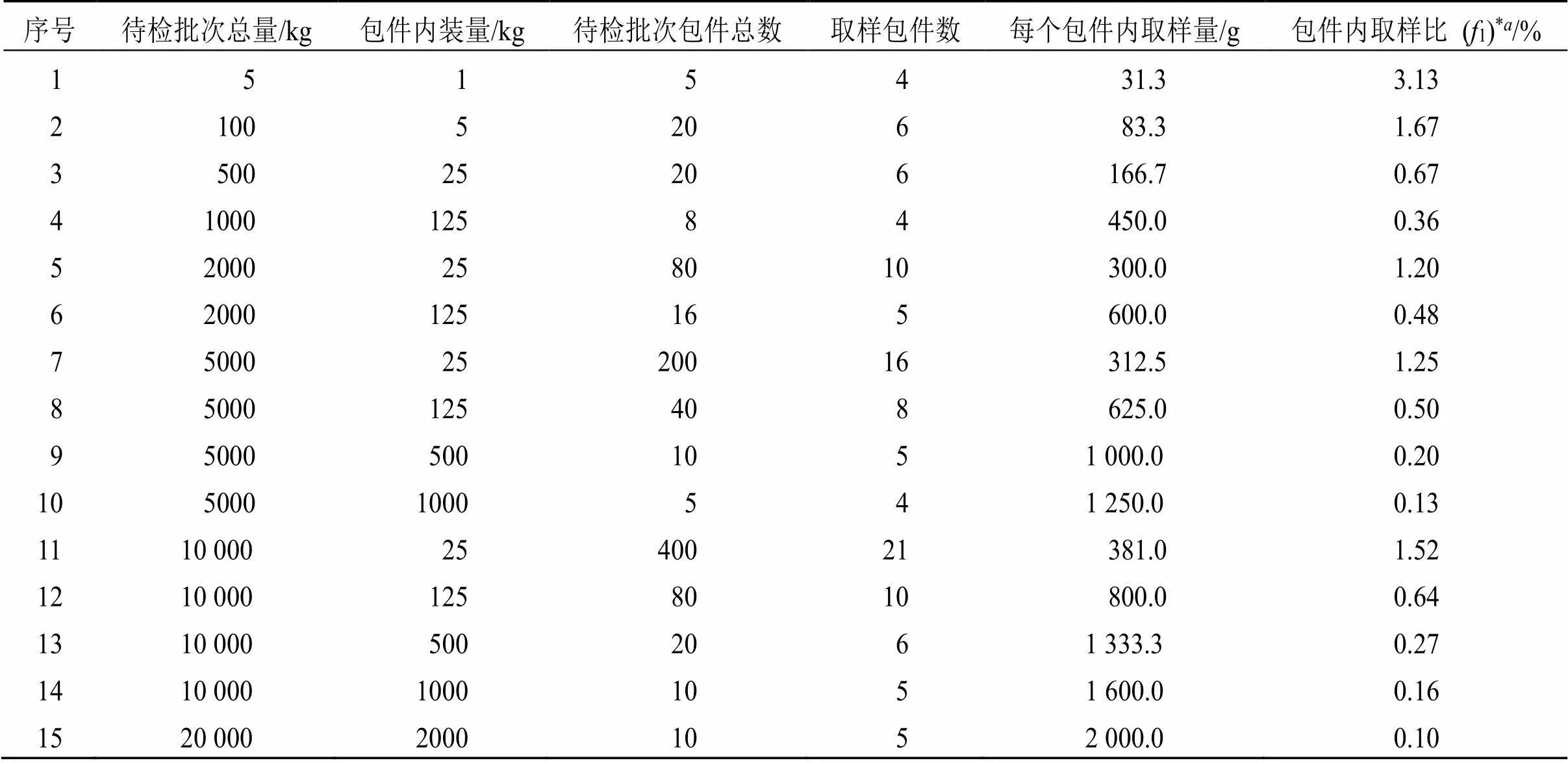
表2 EP、BP包件内取样量
*-包件内取样比(1)为包件内取样量/包件内装量
*-in-package sampling ratio (1): sample volume in package/the amount of the package

表3 ChP与EP、BP、USP的总取样量对比
*-包件内取样量按以下计算:包件内装量为小于10 kg,每个包件取100 g;包件内装量为10~100 kg,每个包件取200 g;包件内装量大于100 kg,每个包件取500 g
*-The sample volume in the package is calculated as follows: when the amount of the package is less than 10 kg, take 100 g for each package; when the amount of the package is 10—100 kg, take 200 g for each package; when the amount of the package is more than 100 kg, take 500 g for each package
根据EP、BP的规定,明确待检批次药物总量后,可按相应比例确定总取样量,同时,根据待检批次药物总包件数按要求确定包件取样数。从表3可见,按EP、BP的要求,待检批次药物的总量越多,对应的总取样量越多,同时,待检批次药物总包件数越多,对应的包件取样数越多,相对更为科学。
根据USP的规定,待检批次药物总包件数越多,对应的包件取样数越多。而在待检批次药物总包件数不变的情况下,待检批次药物总量或包件内装量增大,对应的总取样量不变。即随着包件内装量的增大,包件内的取样比(1=包件内取样量/包件内装量)下降,抽样误差增大。由于USP规定的取样包件数较多,大多数情况下(包件内装量小于1000 kg),USP的取样总量大于EP、BP及ChP。但是,当包件内装量大于1000 kg时,则抽样比低于EP、BP。如包件内装量为2000 kg,1为0.187 5%;5000 kg时1为0.03%。如表3中,同样为1×104kg的待检药物,随着包件内装量的增加(25~5000 kg),总取样量减少(从37.5 kg降至1.5 kg),1降低(从0.375%降至0.015%)。故USP在抽样规定中强调:(1)规定的取样办法是适用于植物药的最低要求。(2)有些药物或某些检测项目可能需要更严格的要求,包括增加包件取样数或包件内取样量。
根据ChP的规定,按待检批次药物总包件数的一定比例抽取包件,同时规定了包件内取样量为100~500 g。从表3可见,大多数情况下,ChP的总取样量低于USP及EP、BP。对于同一批饮片,如分别按ChP、USP、EP、BP的取样法抽样,大多数情况下,ChP的总取样量较少,抽样误差相对较大。
1.5 检验试样
试样所用样品量,可以根据药用部位的特点确定不同的试验样品用量。USP要求:对抽取样品按四分法重复处理,直至获得试验所需量,应保证所获得试验样品的代表性。ChP规定:最终抽取的试样量一般不得少于检验所需用量的3倍。EP、BP规定:可采用四分法或其他方法获得具有代表性的试样。最低试验用样品量为:根、根茎、树皮、全草的最低取样量为500 g(低于500 g取全部),叶子、花、种子、果实250 g(低于250 g取全部),破碎的药材125 g(平均每块的质量低于0.5 g)。
不同部位的差异。部分药材的不同药用部位或同一个体相同药用部位的不同位置所含待测成分的含量差异较大。有研究显示,同一株管花肉苁蓉中根部与顶部的松果菊苷含量最大差异达22.4倍,毛蕊花糖苷差异达16.7倍,苯乙醇总苷差异达8.7倍[7]。如不同药用部位(位置)所含成分差异较大,在制备检验用试样时,可对包件内抽取的样品进行分层抽样,即将成分含量相近的样品合并成几个部分,称定各部分的质量百分比,分别从各部分抽样、测定含量后,再按各部分的百分比计算得抽样样本的含量;或者按百分比从各部分抽取样品组成检验试样,再测定其含量。
2 存在问题的分析与对策
2.1 饮片的同质性
要保证简单随机抽样较好反应总体的质量状况,需以待检批次饮片具有同质性为前提,这样取样才能具有较好的代表性,并减少由于同一批次饮片内部的质量差异较大而带来的抽样误差。
减少抽样误差的路径:(1)生产环节,一方面可以设法降低饮片生产用药材原料的质量差异,如固定产地、采收期,加强药材生产管理,建立质量追溯体系,通过药材产销利益关联及责任传递提高药材生产方加强药材质量管理的积极性。另一方面,可以在新药用饮片加工过程中对质量差异进行动态监测,并通过混合步骤,提高同一个批次饮片的同质性,使其符合GMP“中药饮片应以同一批中药材在同一连续生产周期生产的一定数量相对均质的成品为一批”的要求。此外,如对饮片按质量进行分级,也有利于降低其批内的质量波动。(2)抽样环节,可以在ChP“中药材及饮片取样办法”中要求从包装、标签及外观性状初步判断是否在待检批次饮片中混有其他批次饮片。除符合GAP要求的药材为原料制成饮片的同质性较好外,建议对中药新药研究所用饮片在取样前,查验饮片的品名、规格、产地、生产企业、产品批号、生产日期、到货数量等;核对饮片的证明文件、质量追溯材料,初步了解该批次饮片的同质性。同时,可打开每个包件,观察包件内饮片的形状、大小、颜色、质地等性状,初步判断待检批次饮片的同质性。如同质性较好,可按照ChP的抽样法取样;如同质性较差,应按不同批次分别抽样。
2.2 抽样的取样量
从包件抽样情况分析,ChP有2点可调整:(1)抽取的包件数相对较少,低于USP、EP、BP;(2)当待检批次药物的包件为5~99件时,均抽取5件。抽样包件的数量未随着待检批次药材包件数的增加而增加。
从包件内取样量分析,ChP、USP均规定了包件内的取样量,但取样量未随包件内装量的增加而加大。EP、BP在规定包件内取样量时考虑了待检批次药物总量及包件总数2个因素,包件内取样量与包件内装量成正比,比较而言更加合理。
从总取样量分析,大多数情况下,ChP的总取样量低于USP及EP、BP,抽样误差相对较大。此外,ChP未强调:规定的包件取样数为最低值、特殊情况下可增加取样包件数或包件内取样量。相比较而言,EP、BP的取样法相对较优,总取样量与待检批次药物总量成正比,同时,取样包件数与待检批次药物总包件数成正比,符合抽样的基本要求。但是,EP、BP取样法规定的总取样量占待检药物总量的比例未考虑不同取样比例之间的平衡。当样品总量为50~100 kg时,取样比例为0.5%;当样品总量为100~250 kg时,取样比例为0.25%。如某批饮片总量为90 kg时,取样量为0.45 kg;当饮片总量为110 kg时,取样量为0.275 kg。待检饮片总量多的取样量反而更少,不符合抽样的基本原则。建议参照阶梯电价的方式计算抽样量,仅超出部分按相应比例抽样。即当待检样品总量为110 kg时,其中100 kg按0.5%抽取0.50 kg;超出的10 kg按0.25%抽取0.025 kg,加起来抽样总量为0.525 kg。对于中药新药用饮片,可暂时参照EP、BP的取样法进行研究,此外,按阶梯法计算相应取样量。
包件内取样的方法中,EP、BP、USP要求从包件的上中下取样,以便获得具有代表性的样品;ChP要求至少在2~3个不同位置取样,但未规定具体位置,在不同位置抽样可能影响样本的代表性。此外,某些特殊饮片(药材)的个体在形状、大小、密度等方面差异较大,仅从上中下取样有时仍不一定能获得具有代表性的样品,此时,可将整个包件取出,摊匀,按四分法反复处理,直至获得具有代表性并符合取样要求的样品。当包件内饮片的不同药用部分分离,且不同部位质量差异较大时,可采用分层取样的方法。如易破碎的花类等,破碎的花瓣等往往集中在包件底部,或者在运输过程中反复摇晃而大小(轻重)分层,可将整个包件取出,合并相同药用部位或质量相近的部分,分别称定质量,再按各部分的百分比分别取样。
2.3 抽样误差
抽样检验的抽样误差是客观存在的。在初级单位大小相等的两阶段抽样中,总的抽样误差估计见公式(2)。

根据公式(2),当第1、2阶段抽样的样本量(、)越大,抽样比(1、2)越大,则总的抽样误差越小。当保持不变,增大第1阶段抽样样本量同时减少第2阶段抽样样本量,则第1阶段抽样误差缩小,增大第1阶段的抽样数相对更为有利。当然,抽验检验也不是抽取样品越多越好,需要在检验风险与检验成本、非抽样误差等间找到最佳的平衡点。
根据上述分析,通过对抽样样本检测的均值估计待检批次饮片的质量是存在抽样误差的。抽样误差的大小受待检批次饮片质量的离散程度及抽样样本量等的影响。不同饮片的质量离散程度不同,所需样本量也可能不同。对于批内质量离散程度较大的饮片,建议增加包件取样数、包件内取样量,以较好地反映饮片总体的质量状况。
3 结语与建议
本文从包件取样、包件内取样、试验样品制备等方面对ChP、USP、EP、BP用于植物药或中药饮片的取样法进行了对比,结果显示,4种药典均采用两阶段随机抽样的方法,但在包件取样、包件内取样、试验样品制备等方面各不相同。其中,ChP的取样量相对较少,且未根据包件内装量的增加而加大取样量,如采用该方法取样的检测数据估计待检批中药新药用饮片总体的质量状况,有时出现的偏差可能相对较大。
笔者建议:(1)研究起草中药新药用饮片取样的指导原则或技术要求,以满足中药新药用饮片检验的需要。(2)根据实际情况研究确定合理的取样样本量。可暂时参照EP、BP的取样法对中药新药用饮片进行研究,并结合研究结果对包件取样数、包件内取样量的合理性进行评估。对于批内质量离散程度较大的饮片,建议增加包件取样数或包件内取样量,以较好地反映饮片总体的质量状况。(3)建议加强试验样品处理方法的研究。对于不同药用部位或位置成分差异较大的饮片,可采用分层抽样法,减少因不同部位含量差异大而带来的误差。(4)建议加强药材源头质量管理,固定药材基原、产地及采收加工等,建立相应的药材生产质量规范、质量追溯系统,以提高相应批次饮片的同质性,减少抽样误差。(5)建议在新药用饮片生产过程中采用合理的混合设备及参数,提高同一批次饮片内部的同质性。使中药饮片符合GMP对饮片“相对均质”的要求。(6)建议修订ChP“中药材及饮片取样办法”中的相关内容。增加对于待检批次饮片同质性的要求。如饮片的同质性较好,可按规定随机抽取包件;如果饮片的同质性较差,应将其分成同质性尽可能较好的小批次,然后对每个小批次进行抽样。同时,提出原则性要求:所抽样本应能代表待检批次饮片的质量状况。实际抽样时,应检查饮片的包装标签、标志及质量追溯文件等,并可尽可能多地打开饮片包装,从外观性状(颜色、大小、形状等)初步判断待检批次饮片的同质性,将明显不属于同一个批次的饮片分开,按不同批次检验。建议ChP“中药材及饮片取样办法”中增加:“本取样法是适用于中药饮片的最低要求。必要时可采用更严格的取样法,包括更多取样包件数或包件内取样量。”此外,建议将“每一包件至少在2~3个不同部位抽取样品”修订为“每一包件至少在上部、中部及下部抽取样品”,保证取样的代表性。
目前,中药复方新药、古代经典名方中药复方制剂、中药注射剂以及部分已上市中药(如含有既是毒性成分又是有效成分的品种)的质量标准中已要求规定有效成分或指标成分的含量限度范围。本文关于饮片抽样法的讨论有利于更好了解投料所用饮片中有关成分的含量状况,对于进一步推进均一化投料研究,减小不同批次中药制剂的质量差异具有较好参考价值。
本文仅代表作者观点,不代表任何组织或机构。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 四部. 2020: 29.
[2] 卫生部. 药品生产质量管理规范: 2010年修订. (卫生部令第79号) [EB/OL]. (2011-01-17) [2022-10-01]. https://www.nmpa.gov.cn/xxgk/fgwj/bmgzh/20110117120001434.html.
[3] 国家药监局, 农业农村部, 国家林草局, 国家中医药局. 关于发布《中药材生产质量管理规范》的公告(2022年第22号) [EB/OL]. (2022-03-17) [2022-10-01]. https://www.nmpa.gov.cn/xxgk/fgwj/xzhgfxwj/20220317110344133.html.
[4] European Pharmacopoeia (EP). EP10.8 herbal drugs: sampling and sample preparation [EB/OL]. (2021-11-01) [2022-10-08]. https://pheur.edqm.eu/app/10-8/content/ default/20820E. html.
[5] British Pharmacopoeia (BP). BP2020 Appendix XI T. Herbal drugs: Sampling and sample preparation [EB/OL]. (2022-10-8) [2022-10-09]. https://www.pharmacopoeia. com/bp-2022/appendices/appendix-11/appendix-xi-t--herbal-drugs--sampling-and-sample-preparation.html? date=2022-07-01.
[6] United States Pharmacopeial Convention (USP). USP-NF 2022: <561> Articles of botanical origin [EB/OL]. (2021-11-01) [2022-10-08]. https://online.uspnf.com/uspnf/document/1_GUID-E8A1366F-9657-41FC-9EDC-C20-F4BE473B6_6_en-US.
[7] 郭雄飞, 吴亚东, 倪慧, 等. 管花肉苁蓉不同部位有效成分含量的考察比较 [J]. 新疆医科大学学报, 2012, 35(1): 48-50.
Discussion on sampling method of decoction pieces used as raw materials of new traditional Chinese medicine
ZHOU Yue-hua1, FENG Li2, HENG Ming-li1
1. Center for Drug Evaluation, National Medical Products Administration, Beijing 100022, China 2. Hebei Institute for Drug and Medical Device Control, Shijiazhuang 050227, China
This paper compares(ChP),(EP),(BP) and(USP) from the aspects of container sampling, container internal sampling and test sample preparation of medical materials and decoction pieces (herbal drugs), and discusses the problems existing in the sampling method of decoction pieces used as raw materials of new traditional Chinese medicine in combination with the needs of the inspection of decoction pieces. Some suggestions are put forward as follows: (1) The relevant departments organize experts to draft the guideline or technical requirements for the sampling of decoction pieces used as raw materials of new traditional Chinese medicine. (2) The sampling method of EP, BP could be referred to study the decoction pieces temporarily. The effect of the sampling on the test results should be paid attention to. (3) Appropriate treatment methods should be determined according to the characteristics of test samples. If the quality of different parts or positions of the decoction pieces varies greatly, stratified sampling could be used to reduce sampling error. (4) The source management of the quality of medicinal materials should be strengthened to reduce the quality difference of medicinal materials. (5) The mixing step should be adopted to the production of decoction pieces to improve the homogeneity. (6) The following contents should be added to the “sampling method for Chinese medicinal materials and decoction pieces” in the ChP: The batch of decoction pieces being examined should be homogeneous; Some samples or tests may require more rigorous procedures involving more containers being sampled or more samples per container. In addition, the provisions on sampling location in packages need to be revised.
Chinese medicine decoction pieces; sampling method;;;;
R288
A
0253 - 2670(2023)04 - 1267 - 07
10.7501/j.issn.0253-2670.2023.04.028
2022-10-17
周跃华,主任药师,主要从事中药新药的药学评价研究。Tel: (010)85242879 E-mail: yhztcm163@163.com
衡明莉,主任药师,主要从事新药医学统计学评价研究。Tel: (010)85243180 E-mail: hengml@cde.org.cn
[责任编辑 赵慧亮]
