终结新冠,疫苗还是药物?
2023-02-20瞻云
瞻云

2022年1月7日,美国加州,一名医护人员正在准备注射莫德纳新冠疫苗
从最初新冠疫情暴发带来的恐慌,到疫苗上市带来的希望,再到病毒快速变异一次次突破疫苗防线带来的压抑,我们逐渐适应了反复感染的现状,我们还有希望终结新冠疫情吗?
当然是有希望的,醫药科研人员从来没有放弃疫苗和药物的研发。但每个人都必须接受这样一个事实:新冠病毒的快速变异,及其强大的免疫逃避能力,让我们曾经试图建立的防线崩溃得彻彻底底。
关键突变致免疫逃避能力加强
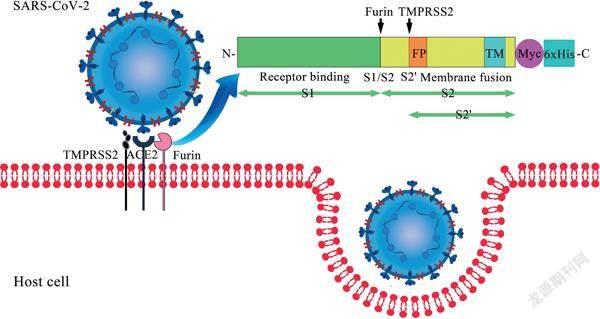
那么,新冠病毒是如何逃脱人类的“狙击”的?时至今日,我们对新冠病毒已经有了足够充分的了解。新冠病毒入侵宿主细胞,主要通过S蛋白与细胞上的受体ACE2发挥作用。ACE2是一种负责调控血压的酶,在人体中很常见,这是新冠病毒容易感染人类的根本原因之一。
人体免疫系统“狙击”新冠病毒,正是通过抗体结合病毒的S蛋白来实现的。新冠病毒首次入侵人体后,S蛋白等抗原信息暴露在免疫系统面前,抗原呈递细胞会对抗原进行摄取、加工处理,随后把抗原信息呈递给T细胞。T细胞产生的白细胞介素等淋巴因子,能刺激B细胞增殖分化成效应B细胞和记忆细胞。
效应B细胞能够产生与抗原特异结合的抗体,发挥体液免疫作用;记忆B细胞则具有很长的寿命,当病原体再次入侵时,记忆B细胞可激活为效应B细胞,进行快速增殖,产生大量抗体阻止病毒对人体的感染。
新冠病毒感染和人类免疫反应的特性,注定了人类要“狙击”新冠病毒,就必须直接或者间接地对S蛋白下手。虽然自2020年以来,灭活疫苗、腺病毒载体疫苗、核酸疫苗、重组蛋白疫苗、减毒流感病毒载体疫苗等层出不穷,但针对的都是S蛋白。它们的主要区别是S蛋白的呈现形式,以及最终抗体成分的差异。
虽然特异性识别令体液免疫发挥出了迅速而高效的优势,但高度专一性,也成了新冠病毒突破的弱点。当S蛋白发生突变,免疫效果就可能减弱甚至失效。相比起原始毒株,德尔塔总共发生了13处突变,最关键的4处突变,均发生在病毒的S蛋白区域。
相比起德尔塔,奥密克戎的变异则更加复杂。它就像一个怪物聚合体,具有超过30种突变,同时具有阿尔法、贝塔、伽马、德尔塔的重要S蛋白突变位点。德尔塔S蛋白上,与细胞ACE2特异结合的关键区域RBD有着2处突变,而奥密克戎在该区域的突变多达11处。
人类要“狙击”新冠病毒,就必须直接或者间接地对S蛋白下手。
病毒S蛋白与人体细胞上的受体ACE 2之间的相互作用
甚至有研究者认为,奥密克戎应被看作一种全新的病毒。但无论怎么定义,它都是以S蛋白作为结构蛋白之一的一种新型冠状病毒。
无论是当初的预测,还是后来的感染数据统计,都证明奥密克戎具有极强的传播能力以及免疫逃避能力。仅仅几个月的时间,其便由最初的5种主要亚型发展出了200多种亚型毒株。如果加上德尔塔等其他毒株,所有的新冠病毒更是多达2000多种亚型。
虽然在疫情暴发的第一年,大规模的疫苗接种避免了超过1400万人的死亡,但面对前所未有的突变,疫苗发挥的作用正在大打折扣。
“终结新冠”的疫苗?
面对新冠,疫苗真的无能为力了吗?答案是否定的,我们还可以选择更加广谱的疫苗。虽然新冠病毒的S蛋白能够快速变异,但它进入细胞的方式却较保守,并没有发生过变化。
S蛋白分成S1蛋白和S2蛋白两个部分。S蛋白上,具有弗林蛋白酶(Furin)和跨膜丝氨酸蛋白酶2(TMPRSS2)的切割位点,在两种酶的作用下,S1蛋白的RBD区域会暴露出来,与ACE2发生特异结合;S2蛋白则负责介导病毒与宿主细胞膜融合。
Paxlovid由粉红色的奈玛特韦和白色的利托那韦两种药物组成
S蛋白融合后会发生结构重排,形成融合后构象,具有更低的抗原性,不易被免疫识别。因此,新冠病毒激发的免疫应答,主要都是发生于融合前构象。针对RBD区域暴露之后、S蛋白重排之前的阶段(这也是免疫应答最充分的阶段),如果研发的疫苗能够增强这个过程,就能大大增加免疫效果。
来自Biohub和斯坦福等医学研究机构的研究人员,实现了这个设想。他们以铁蛋白为核,设计出了一种叫作S?C-Fer的蛋白质纳米颗粒疫苗。这种疫苗添加了弗林蛋白酶切割位点,以及S2蛋白的2个脯氨酸突变位点,同时删除了刺突蛋白胞外域C端的70个氨基酸残基—这些氨基酸残基原本能与抗体结合,对病毒的RBD区域进行保护。
当S?C-Fer进入人体后,由于其纳米级的大小,它很容易被抗原呈递细胞处理。疫苗上的弗林蛋白酶会切割S1/S2结合位点,让抗原快速有效地暴露。S2蛋白的2个脯氨酸突变,可以抑制S蛋白发生重构;而删除的氨基酸残基,则能让抗体与RBD有更加充分的结合机会。
Paxlovid其实并没有那么“特效”。
截至目前,无论新冠病毒如何变异,S蛋白结合位点如何变化,感染细胞的过程没有变化。所以,任何亚型的新冠病毒进入人体后,S?C-Fer疫苗都能对它发挥免疫效果。
为了增加这个蛋白质纳米颗粒疫苗的效果,斯坦福的研究人员对S?C-Fer进行了升级。他们又添加了4个脯氨酸,打造出了拥有6个脯氨酸的疫苗,命名为DCFHP。
DCFHP疫苗不仅让新冠病毒的S蛋白构象更加稳定,也更有利于抗原表达。而且DCFHP疫苗还具有更好的稳定性,在4℃~37℃的温度范围内,可以稳定保存14天—不像其他疫苗,需要冷藏才能避免失活。
为了增加DCFHP疫苗的效果,研究人還使用了安全的氢氧化铝佐剂。动物实验结果显示,DCFHP疫苗对多种奥密克戎亚型,都具有广谱、强效、持久的免疫效果。
问题在于,DCFHP疫苗尚未进行人体实验,并不能确定最终的效果;而且,新冠病毒还在发生变异,无论是弗林蛋白酶切割位点,还是其他的关键基因发生突变,都可能影响疫苗的效果。
抗病毒药物难适用轻症患者
几乎和疫苗开发同步,抗新冠病毒药物一直在如火如荼地进行研发。经过市场的大浪淘沙,Paxlovid最终赢了瑞德西韦和莫那匹韦,得到了世卫组织用于救治住院风险最高的轻度和中度新冠病毒患者的“强烈推荐”。
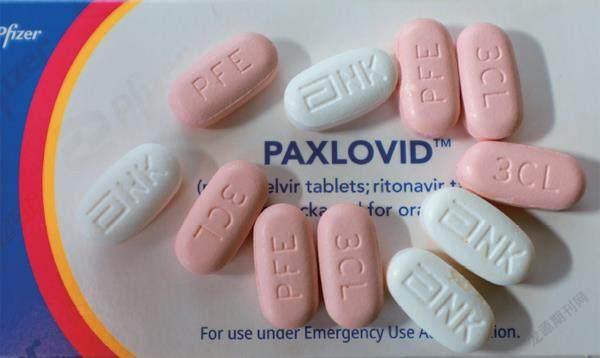
然而和诸多宣传的“特效”不同的是,Paxlovid其实并没有那么“特效”。Paxlovid由粉红色的奈玛特韦和白色的利托那韦两种药物组成。奈玛特韦本身是广谱抗病毒小分子药物,具有一定的肝脏毒性,因此肝脏会对它进行快速降解,从而影响效果。辉瑞通过添加利托那韦肝功能抑制剂,以保证奈玛特韦发挥充分的抗病毒效果。
早期的三期临床数据显示,确诊三天内的轻中度新冠患者在服用该药后,住院或死亡风险可降低89%左右。Paxlovid一度被媒体称为新冠病毒的“银色子弹”,被戴上了“特效药”的冠冕。

中国国产的V V116抗病毒药物
但其实,作为一种以广谱抗病毒药物为基础的药物,它严格意义上并不是新冠“特效药”。这也是为什么面对过度宣传,中国工程院医药卫生学部院士张伯礼在近期强调“没有特效药,更没有神药”。
虽然Paxlovid的实际表现并没有临床实验数据那么突出,但诸多治疗结果都表明,它的确在降低高危人群重症和死亡风险上,具有明显效果,可以保护老人等脆弱人群。
但由于它的肝脏毒性,以及较高的不良反应事件发生率,Paxlovid不适合更广泛的轻症群体。即便Paxlovid被炒得几近天价,黑市万元难求,但它的具体效果和副作用,注定让其不可能成为新冠疫情的终结者。
Paxlovid之外,国产药物有可能吗?2022年的最后几天,传来了国产“特效药”的喜讯。2022年12月29日,发表在《新英格兰医学杂志》的论文显示,君实生物研发的VV116抗病毒药物,经过与Paxlovid的对比研究发现,针对具有高位风险因素的轻中度新冠感染者,VV116的中位症状恢复时间是4天,比Paxlovid的5天短了一天;在不良反应事件的统计上,VV116的不良率为67.4%,低于Paxlovid组的77.3%。
VV116是一种核苷类药物,主要通过诱发病毒错误突变来阻止病毒传播,与抑制3CL蛋白酶活性的Paxlovid具有截然不同的药物动力学。但从数据表现看,VV116也只是略有优势,最终的大数据表现,依旧无法判断孰优孰劣。
抗病毒类药物,本身就是通过破坏或抑制病毒复制来实现,而病毒在人体内复制又是依赖人体自身的微观生态,因此抗病毒类药物在人体内发挥作用,就必然会对人体微观生态产生负面影响。这就令很多抗病毒药物在面对轻症时,危害往往高于收益。
总之,抗病毒药物很难成为终结新冠疫情的首选,不过它依旧可以成为我们终结新冠疫情的有力帮手。相信随着广谱疫苗和各类药物的研发,我们迟早会有看到新冠疫情结束的那一天。
责任编辑吴阳煜 wyy@nfcmag.com
