基于近红外光谱的陈皮炮制品快速质量评价研究
2023-02-20方嘉雯麦淑仪孟江张晓婷陈倩茹陈志维张戴英
方嘉雯,麦淑仪,孟江,张晓婷,陈倩茹,陈志维,张戴英
(1.广东药科大学中药学院/国家中医药管理局中药数字化质量评价技术重点研究室/广东高校中药质量工程技术研究中心,广东广州 510006;2.广州至信中药饮片有限公司,广东广州 510006;3.东莞广州中医药大学研究院,广东东莞 523000;4.广东和翔制药有限公司,广东广州 510006)
陈皮为芸香科植物橘Citrus reticulataBlanco及其栽培变种的干燥成熟果皮,味辛、苦,性温,归肺、脾经,具有理气健脾、燥湿化痰的功效,用于脘腹胀满、食少吐泻、咳嗽痰多[1]。蒸陈皮为陈皮湿润后蒸3~4 h 得到的炮制品,在广东、广西、四川等地区应用非常广泛,陈皮生品燥性比较大,蒸制后降低其辛燥之性,以保障其临床安全有效使用[2]。目前,对于饮片的质量及炮制过程的控制,多依据传统经验开展“辩状论质”[3]和化学成分含量测定来进行评价。如陈皮生品“外表面橙红色或红棕色,有细皱纹和凹下的点状油室。内表面浅黄白色,粗糙,附黄白色或黄棕色筋络状维管束。气香,味辛、苦。”蒸陈皮“蒸后内表面变为棕红褐色,质硬,气清香。”陈皮化学质量标准《中国药典》2020 年版规定采用高效液相色谱法,以橙皮苷含量进行质量控制[1]。根据传统经验开展评价虽然简单省时,但具有一定的主观性。化学质量分析操作较为繁杂,且使用化学试剂对环境有一定的污染;同时,对于中药炮制缺乏工艺参数和质量质控指标之间定量关系研究,因此亟需一种快速高效的技术对中药饮片质量和工艺过程进行控制,从而提高其质量,为临床应用提供科学依据。
近红外光谱(NIRS)是由分子振动的非谐振性使分子振动从基态向高能级跃迁时产生的,记录的主要是含氢基团C-H、O-H、N-H、S-H、P-H等振动的倍频和合频吸收。不同基团(如甲基、亚甲基、苯环等)或同一基团在不同化学环境中的近红外吸收波长与强度都有明显差别。NIRS 具有丰富的结构和组成信息,非常适合用于中药含碳氢有机物质的组成性质测量。与常规分析方法相比,NIRS具有不破坏样品、无需预处理、无污染、快速高效,同时能测定样品中的多种成分的优势。近红外光谱技术也有报道用于陈皮道地性、种属、不同年份的定性和定量研究[4-6]。但陈皮蒸制前后及其蒸制过程控制未见有相关近红外光谱的快速定性定量分析。
陈皮主要化学成分为黄酮类、挥发油类、生物碱类、柠檬苦素等成分,其中主要药效成分为橙皮苷、芸香柚皮苷、3,5,6,7,8,3′,4′-七甲氧基黄酮、川陈皮素等。药理学研究表明川陈皮素具有抗炎作用[7-8],多甲氧基类黄酮成分具有促消化作用[9],橙皮苷能够抗脂肪肝、肝纤维化、肝衰竭[10],5-羟甲基糠醛具有较好的抗氧化及保护心血管作用,且炮制后含量增加[11-12]。本文首先采用HPLC 法测定5-羟甲基糠醛、川陈皮素、芸香柚皮苷、橙皮苷、3,5,6,7,8,3′,4′-七甲氧基黄酮含量,采用近红外光谱技术建立陈皮生品及制品的近红外光谱图,建立近红外光谱的定性判别模型和近红外光谱-成分的定量模型,对陈皮生品及制品进行定性定量分析,为陈皮饮片质量控制提供简单快速客观准确的质量控制方法。
1 材料
1.1 仪器
LC-20A 型HPLC 仪及配备的SPD-20A 型检测器、CTO-10ASVP 型柱温箱、LC Solution 1.26 色谱工作站(日本Shimadzu 公司);TANGO 傅立叶变换近红外光谱仪(德国Bruker),配备TANGO-R 积分球漫反射系统和TANGO 软件;BSA124S 万分之一电子天平(德国Sartorius公司);DFY-400D摇摆式高速粉碎机(温岭市大机械有限公司);KQ-300DE 型数控超声波清洗器(昆山市超声仪器有限公司);电热鼓风干燥箱(上海一恒科学仪器有限公司)。
1.2 药品
采集陈皮生品及制品饮片各30 批,分别采购于广州至信中药饮片有限公司、康美药业股份有限公司、广州采芝林药业有限公司等,并经广东药科大学中药学院刘基柱副教授鉴定为芸香科植物橘Citrus reticulataBlanco及其栽培变种的干燥成熟果皮的加工品,样品详细信息见表1。粉碎后过100目筛,储存于密封袋中备用。
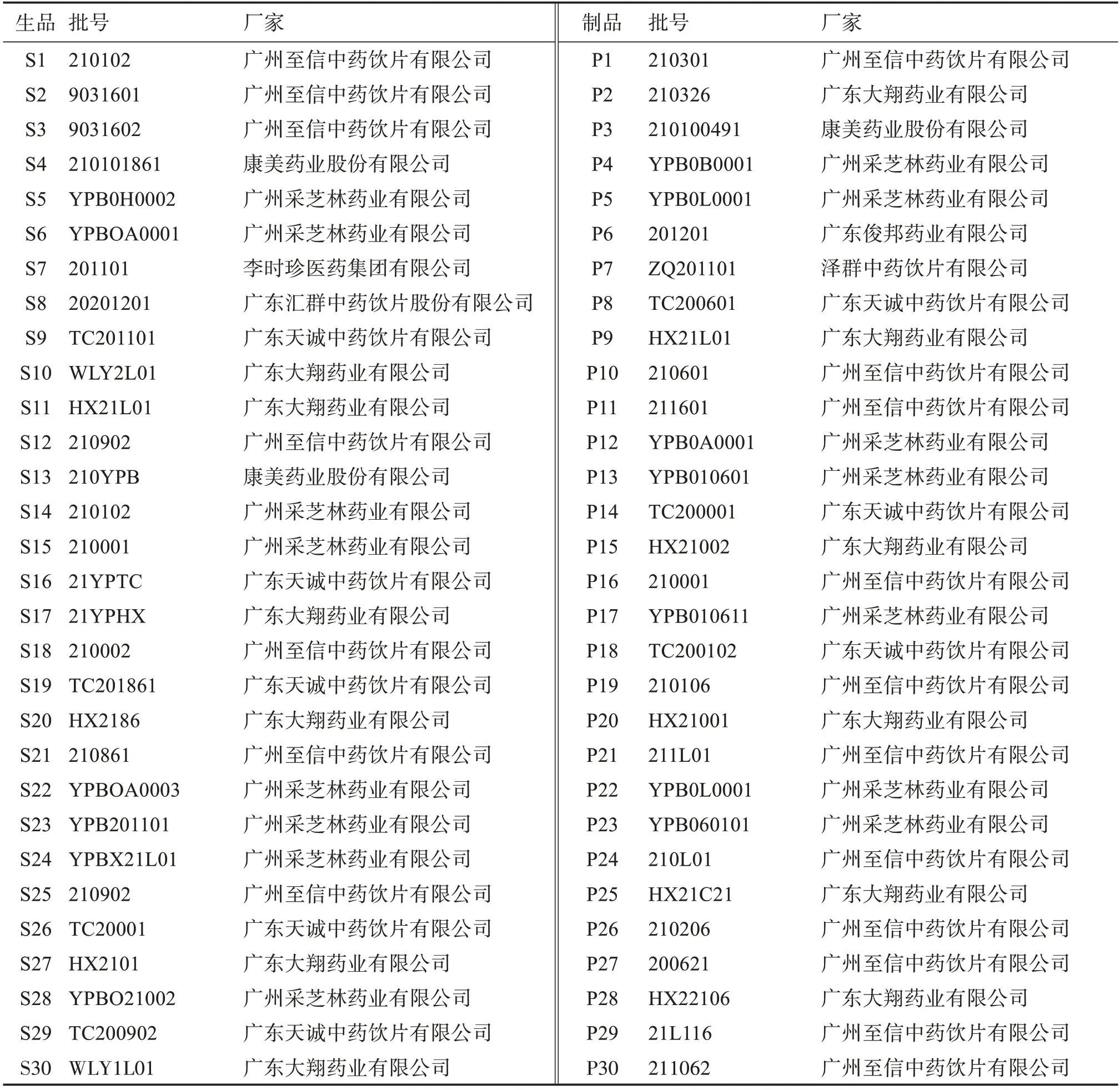
表1 样品信息Table 1 Sample information
1.3 对照品与试剂
5-羟甲基糠醛(批号:CHB201120)、川陈皮素(批号:CHB210107)、芸香柚皮苷(批号:CHB2012089)、橙皮苷(批号:RFS-C00601910011)、3,5,6,7,8,3′,4′-七甲氧基黄酮(批号:RFS-Q11302101019)均购自成都瑞芬思生物科技有限公司,纯度均大于98%;甲醇、乙腈(色谱纯,OCEANPAK 试剂公司);无水乙醇(分析纯,天津市致远化学试剂有限公司);水为屈臣氏蒸馏水。
2 方法与结果
2.1 HPLC法测定5种成分的质量分数
2.1.1 色谱条件 日本岛津的LC-20A型高效液相色谱仪,Ultimate XB-C18色谱柱(4.6 mm×250 mm);流动相为甲醇(A)-0.1%甲酸水溶液(B),梯度洗脱(0~5 min,5%~20%A;5~30 min,20%~28%A;30~48 min,28%~34%A;48~68 min,34%~38%A;68~73 min,38%~45%A;73~87 min,45%~60% A;87~105 min,60%~78%A;105~117 min,78%~82% A;117~120 min,82%~95%A);流速:1 mL/min,柱温:35 ℃,进样量:10µL;对照品及样品的色谱图见图1。可见,在与对照品溶液谱图中5-羟甲基糠醛、芸香柚皮苷、橙皮苷、川陈皮素、3,5,6,7,8,3′,4′-七甲氧基黄酮相应的保留时间位置,陈皮生品和制品溶液谱图中均有相对应的吸收峰;5 种指标性成分分离效果良好,理论塔板数均大于2 000。
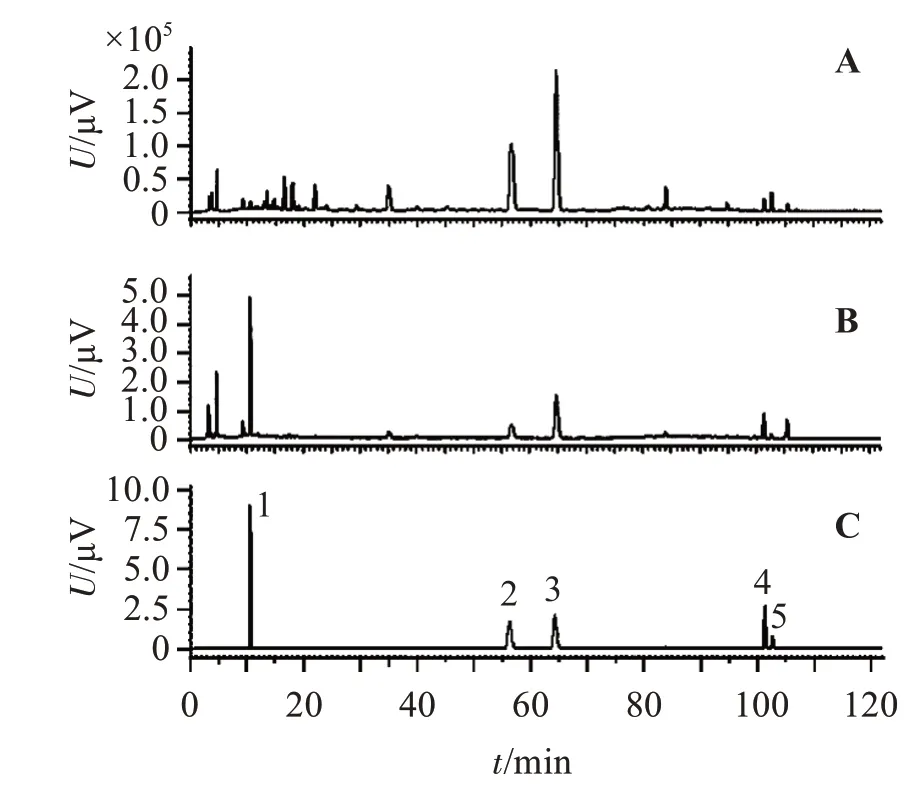
图1 陈皮生品(A)、制品(B)及混合对照品(C)溶液HPLC图谱Figure 1 HPLC chromatograms of Citri reticulatae Pericarpium(A),processed products(B)and mixed reference substances(C)
2.1.2 混合对照品溶液的制备 精密称取5-羟甲基糠醛、芸香柚皮苷、川陈皮素、橙皮苷、3,5,6,7,8,3′,4′-七甲氧基黄酮5 种对照品适量,加甲醇定容制备质量浓度分别为0.115 6、0.566 7、0.072 9、0.650 0、0.070 3 mg/mL 的混合对照品溶液,于4 ℃下避光保存备用。
2.1.3 供试品溶液制备 精密称定样品粉末(过100目筛)0.4 g,置50 mL 具塞锥形瓶中,精密加入体积分数50%乙醇10 mL,盖好瓶塞,超声(功率150 W、频率40 kHz)提取45 min,静置到室温后取上清液,0.22µm 滤膜滤过,弃去初滤液,收集续滤液,封口,贴好标签,置于4 ℃保存备用。
2.1.4 标准曲线的绘制 分别精密吸取上述混合对照品溶液适量,配置系列对照品溶液,在同一色谱条件下进行分析,以对照品质量浓度(μg/mL)为横坐标、峰面积积分值为纵坐标,绘制标准曲线,得5种成分的回归方程、r值、线性范围如下:5-羟甲基糠醛,Y=64 963 320X+68 499,r=0.999 0,0.000 7~0.115 6 μg/mL;芸香柚皮苷,Y=14 689 439X+36 323,r=0.999 6,0.003 5~0.566 7 μg/mL;川陈皮素,Y=95 651 795X+32 115,r=0.999 7,0.000 5~0.072 9 μg/mL;橙皮苷,Y=14 008 043X+36 441,r=0.999 8,0.004 0~0.650 0 μg/mL;3,5,6,7,8,3′,4′-七甲氧基黄酮,Y=47 170 055X+17 351,r=0.999 6,0.000 4~0.070 3 μg/mL。
2.1.5 方法学考察 取同一供试品溶液连续进样6次,考察精密度。按“2.1.3”项下方法平行制备6 份同一批样品的供试品溶液,考察重复性。将同一供试品溶液分别在0、2、4、8、12、24 h 测定,考察稳定性。向已知含量的样品溶液中加入含量100%的对照品,考察加样回收率。结果显示:精密度,稳定性和重复性试验RSD 值均小于2%;平均回收率分别为5-羟甲基糠醛106.79%(RSD 1.03%)、芸香柚皮苷112.72%(RSD 0.95%)、川陈皮素90.58%(RSD 1.36%)、橙皮苷93.25%(RSD 1.12%)、3,5,6,7,8,3′,4′-七甲氧基黄酮90.84%(RSD 1.41%)。
2.1.6 样品质量分数的测定 精密称取各批次陈皮粉末0.4 g,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进样分析,记录各样品峰面积,由线性回归方程求出各样品的质量分数,结果见图2。可见,陈皮炮制后5-羟甲基糠醛和川陈皮素质量分数显著升高(P<0.001),芸香柚皮苷经炮制后显著下降(P<0.001),橙皮苷炮制前后无显著差异,3,5,6,7,8,3′,4′-七甲氧基黄酮炮制后显著下降(P<0.01)。
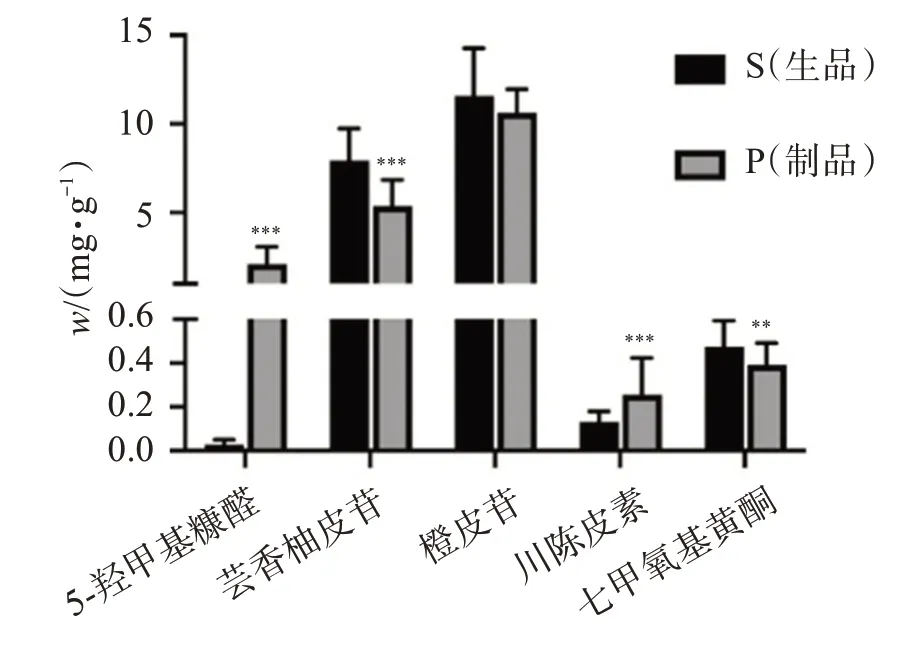
图2 陈皮生品与制品成分质量分数比较Figure 2 Comparison of ingredient content of Citri reticulatae Pericarpium and processed products
2.2 近红外光谱采集
取一定量样品粉末置于石英杯中,粉末应完全覆盖在石英杯底部,并且保证粉末表面处于水平均匀状态,设置适宜参数,进行光谱扫描。参数设置:积分球漫反射;扫描次数64 scan-1;分辨率8 cm-1;光谱采集区间12 000~4 000 cm-1。每批样品需要在同一环境下重复测试3 次取平均值,得到平均光谱作为测试光谱,同时为了避免环境对结果的影响,温度控制在20 ℃左右,湿度控制在35%左右。60 批样品的NIRS 合集图及平均近红外光谱图见图3。可见,吸收峰位置主要在8 296、6 784、5 688、5 104、4 528、4 152 cm-1附近。
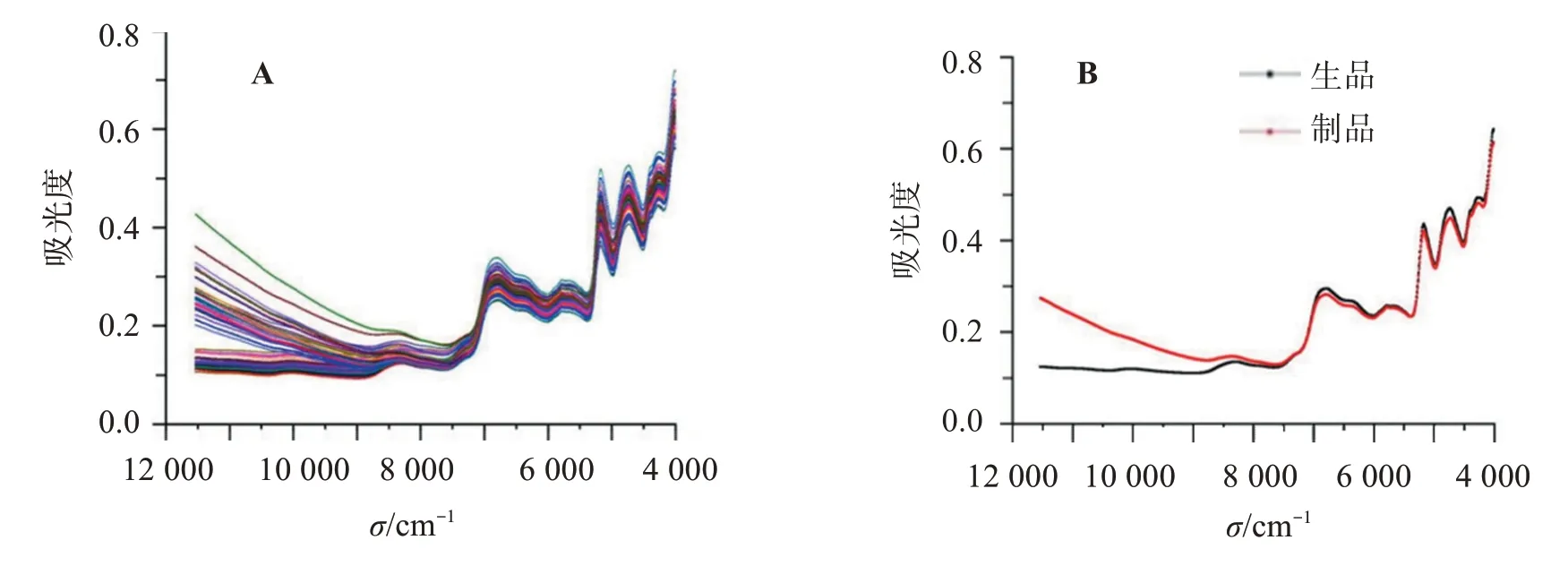
图3 陈皮生品与制品近红外光谱合集图(A)及平均近红外光谱图(B)Figure 3 Near-infrared spectral collection(A)and average near-infrared spectra(B)of Citri reticulatae Pericarpium and pro‐cessed products
2.3 陈皮的近红外光谱定性判别
2.3.1 无监督识别的主成分分析(PCA)模型 将陈皮和蒸陈皮的NIRS全光谱图输入MATLAB软件中的Discriminant Analysis(判别分析)程序,建立陈皮生品及炮制品NIRS 的全光谱段定性判别分析模型。生品、制品的定性值分别设定为1、2,建立无监督识别的PCA 模型。PCA 模型前10 个主成分的解释变量与累计变量结果见图4。可见,当主成分数为2 时,累积解释为96.07%(PC1=54.6%,PC2=41.47%),说明该模型前两个主成分可以解释全部原始光谱的96.07%的信息,具有一定的代表性。该PCA 模型的得分(score)图见图5,可知生品的聚集度较高,但生品和制品的分界线不明显,不能准确判别样品炮制类别,因此还需要建立有监督识别的定性判别模型进行识别,以提高判别的准确率。
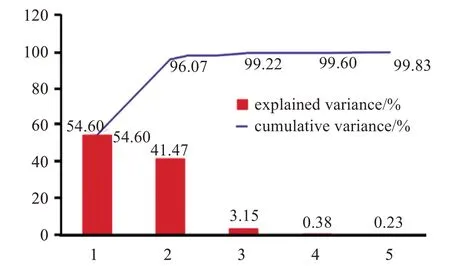
图4 前10个主成分解释变量与累计变量Figure 4 Explanatory and cumulative variables of the first 10 principal components
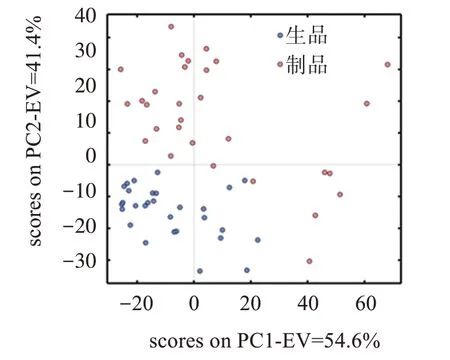
图5 陈皮生品及制品PCA模型得分图Figure 5 PCA model score chart of Citri reticulatae Pericarpium and processed products
2.3.2 有监督识别的定性判别模型 利用MATLAB软件中的Partial Leaast Squares DA 算法(PLS-DA)、SIMCA 算法、Suport Vector Machines 算法(SVM)及K-Nearest Neighbors 算法(KNN),各算法按照2∶1比例划分为训练集和验证集,依次建立陈皮及蒸陈皮的NIRS 有监督的PLS-DA、SIMCA、SVM、KNN定性判别分析模型,结果见表2。结果显示,5 个定性判别模型训练集及验证集的正判率均为100%,与无监督识别的PCA 模型相比,有监督识别的定性判别模型效果较好。各有监督判别分析模型中,PLS-DA 作为一种常见的有监督的模式识别方法,即具备线性判别分析的分类能力又兼具PLS 降维、降噪的优势,且在原始变量方面具有强大的解释能力,适用于区分两类的样本[13]。故在陈皮及蒸陈皮定性模型分析中将采用PLS-DA方法建模。
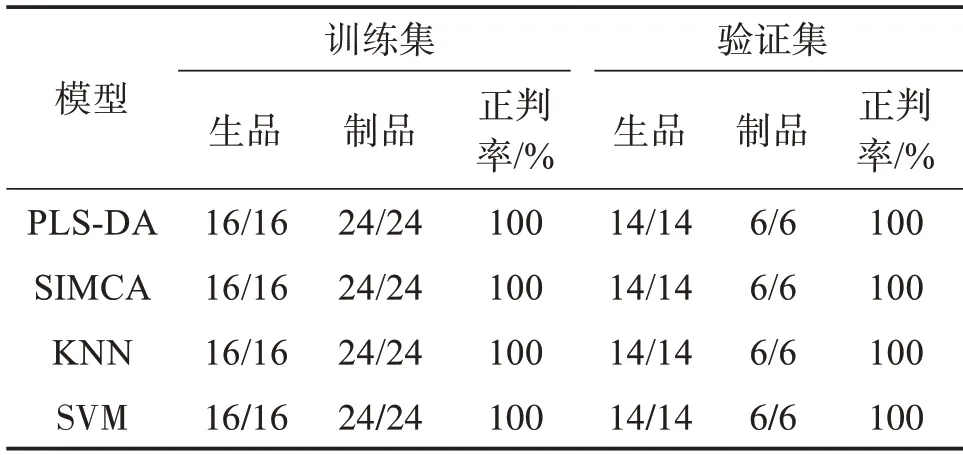
表2 基于近红外光谱的有监督模式识别结果Table 2 Supervised pattern recognition results based on nearinfrared spectroscopy
2.4 陈皮的近红外光谱定量鉴别
2.4.1 样本集划分 偏最小二乘回归(Partial Least Squares Regression,PLSR)是一种成熟且最常用的回归方法,可以被认为是NIR 光谱学进行定量分析的标准方法[14],因此本实验采用PLSR 法对陈皮中各指标成分进行定量预测。采用Kennard-Stone 算法,从60批样品中选取2/3作为训练集(40批),建立定量校正模型,余下的1/3 作为验证集(20 批),以验证训练集建立的定量模型的预测能力。
2.4.2 光谱预处理方法的选择 NIRS中有大量的冗余信息和噪音,在建立定量模型前首先采用9S、SNV、MSC、2D9S、1D9S 对光谱进行预处理。将原始光谱数据及预处理光谱数据导入MATLAB中,原始光谱数据或预处理光谱数据作为变量X,以指标成分含量作为变量Y,建立PLSR 模型运行,结果以相关系数(R2)、均方根误差(RMSE)和相对分析误差(RPD)作为评价指标,从而优选各指标成分最佳的预处理方法。一般来说,R2表示模型的拟合程度,当R2越接近1,说明模型的拟合效果较好;RMSE 用于表示模型的估算能力,RMSE 值越接近0 越好;RPD 用于表示模型预测的准确性,RPD 值大于2.0,说明模型预测效果较好[15],模型原始光谱及预处理光谱结果见表3。
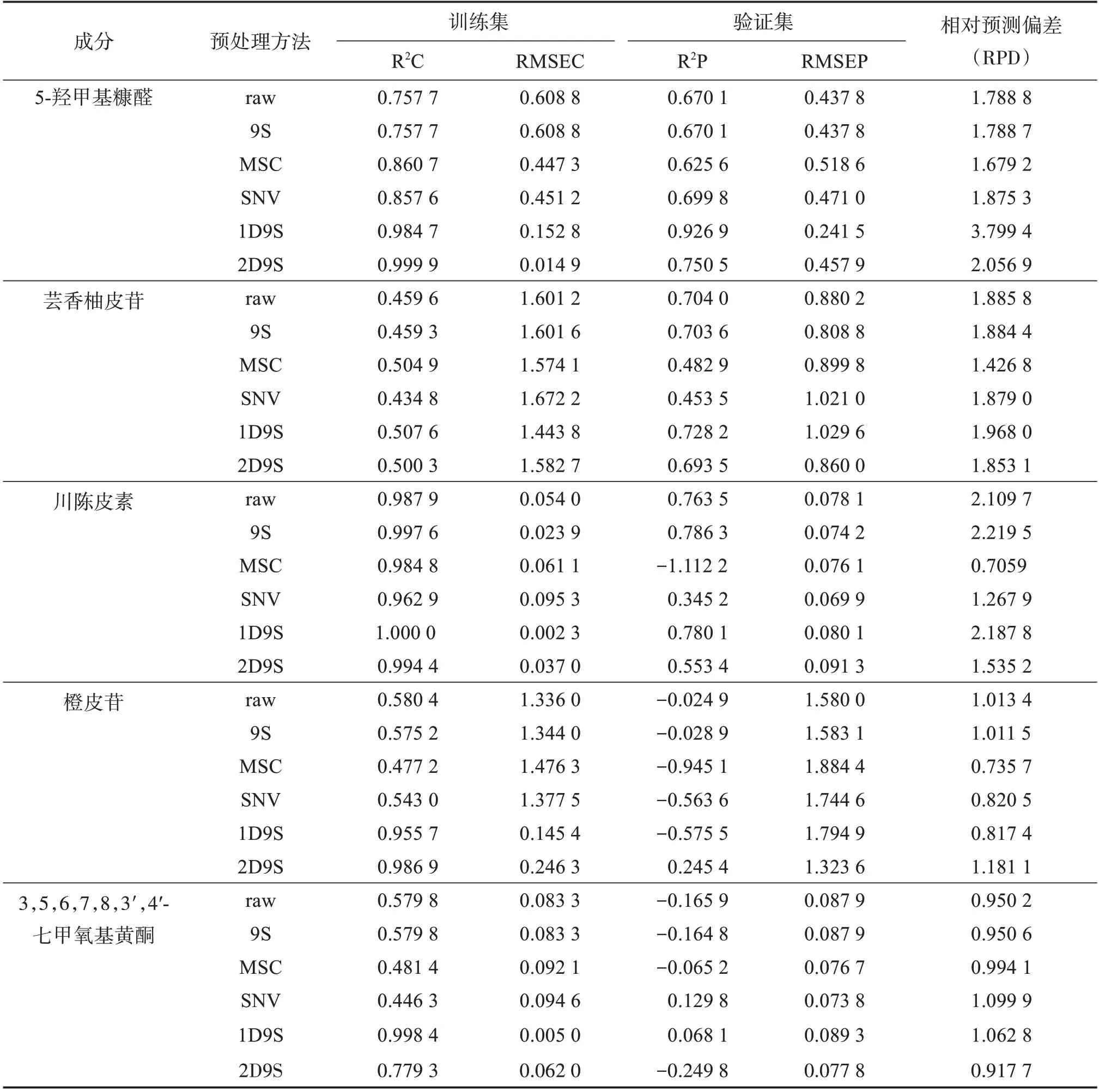
表3 各成分原始光谱及预处理光谱建模结果Table 3 Modeling results of the original spectra and pretreatment spectra of each component
可见:对光谱预处理后所得定量模型性能均优于原始光谱。其中,5-羟甲基糠醛经过1D9S 处理后,RPD 达3.799 4,R²C、R²P 有很大的提升,R²C由0.7577提升为0.9847,R²P由0.6701提升为0.9269,RMSEC与RMSEP也更接近于0,说明1D9S 处理后该模型对5-羟甲基糠醛的拟合预测非常好。川陈皮素经过9S 处理后,R²C 为0.997 6,R²P为0.786 3,RMSEC 为0.023 9,RMSEP 为0.074 2,RPD 为2.219 5,模型的稳定性优于原始光谱模型。芸香柚皮苷采用1D9S 的预处理方法,模型比原始光谱模型有提升,但RPD 为1.968 0,还需要对该模型进行优化处理。而橙皮苷和3,5,6,7,8,3′,4′-七甲氧基黄酮原始光谱建模结果较差,二者训练集的R2在0.6 左右,验证集的R2均小于0,说明验证集的拟合效果极差,而且RPD 远远小于2.0,由此可知,陈皮中的橙皮苷和3,5,6,7,8,3′,4′-七甲氧基黄酮不适合用于建立PLSR 定量模型,因此本实验仅针对陈皮中5-羟甲基糠醛、芸香柚皮苷和川陈皮素3 种化学成分进行定量建模。
2.4.3 光谱特征波段的选择 为了有效地找到有用的变量,建立更强大、更简单的预测模型[16],需继续优化光谱,进行光谱特征波数选择。将光谱数据与各指标成分高效液相数据导入MATLAB 中,采用CARS、IRIV、GA 法进行特征选择,处理后同样以R2C、RMSEC、R2P、RMSEP和RPD作为评价指标。
5-羟甲基糠醛使用全光谱建模;芸香柚皮苷最佳建模波数为11 456、4 456、4 344、4 336 cm-1,由图6A可知,当序号为11时,对应波数为11 456 cm-1,所建立的PLSR 定量回归模型的回归系数最大(Y=1 585);川陈皮素最佳建模波数有32 个,处在8 584~8 184 cm-1和6 960~4 352 cm-1内,由图6B 可知,当序号为17 时,对应波数为6 744 cm-1,PLSR 定量回归模型的回归系数最大(Y=-547.1)。
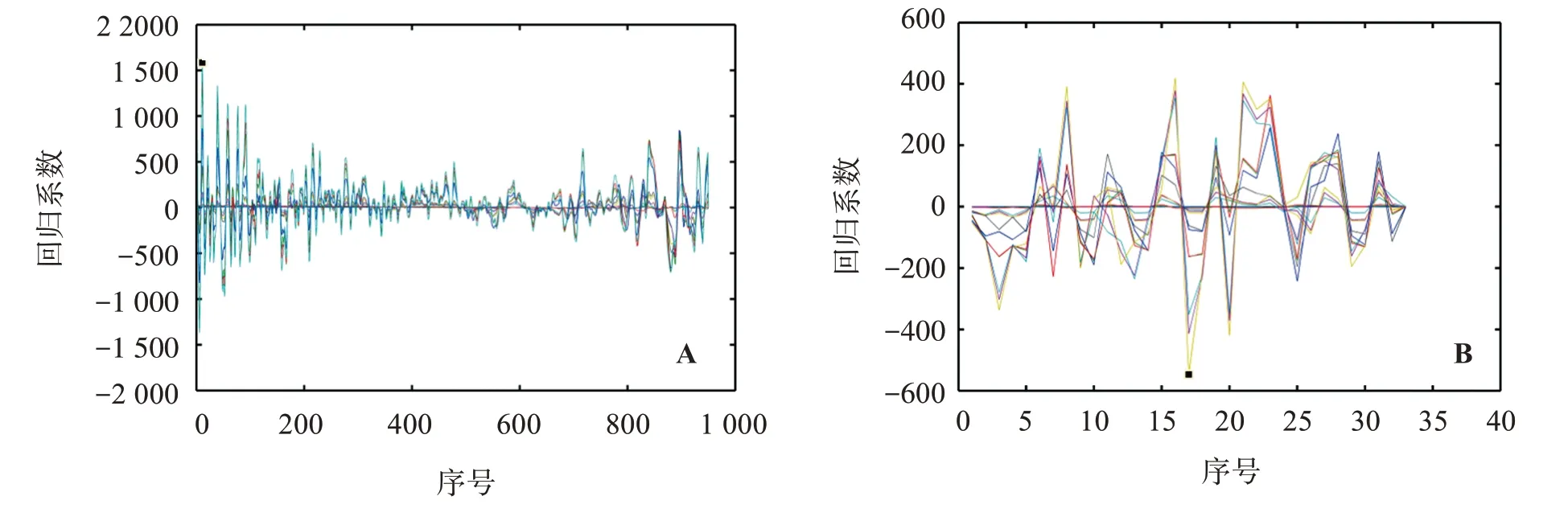
图6 芸香柚皮苷(A)与川陈皮素(B)波数特征选择图Figure 6 Selection charts of wave number characteristics of russetine naringin(A)and nobiletin(B)
各指标成分特征波数选择方法结果见表4。可见,针对5-羟甲基糠醛,与全光谱相比,经过光谱特征波数选择后,R²C变化不大,R²P下降了,说明该成分验证集的拟合程度下降;训练集和验证集的RMSE 相差不大;而全光谱的RPD 值高达3.799 4,比光谱选择后的RPD 值高,说明用全光谱建立的定量模型能有效预测5-羟甲基糠醛的含量,模型稳定性也较高。故,5-羟甲基糠醛的定量模型最佳建模方法为1D9S+PLSR。芸香柚皮苷通过CARS 方法进行光谱选择后,训练集的R²C 由0.507 6 提高到0.6718,验证集的R²P由0.7282提高到0.7681,RMSEP由1.0296降低到0.950 9,RPD 由1.968 0 提高到2.130 7,说明该光谱特征选择方法适合该成分,同时也说明经过CARS 方法对光谱进行预处理可以降低高维数据带来的模型繁杂性,减少光谱变量,从而提高模型稳定性。因此,芸香柚皮苷定量模型最佳建模方法为1D9S+CARS+PLSR。而川陈皮素通过GA 方法进行光谱选择后,验证集的R²P由0.786 3 提高到0.802 4,RMSEP 由0.074 2 降低到0.071 3,RPD 由2.219 5 提高到2.307 9,说明经过GA 方法对光谱进行预处理能提高该模型的稳定性。虽然训练集的R²C 比全光谱有所下降,但数值达到0.983 6,拟合效果较好,而RMSEC 与全光谱相比上升,总体而言该光谱特征选择方法适合川陈皮素定量模型建立。因此,川陈皮素定量模型最佳建模方法为9S+GA+PLSR。
表4 各成分近红外光谱特征选择方法Table 4 Selecting method for near-infrared spectral features of each component
2.4.4 模型主因子数的选择 本研究考察了主因子数对RMSECV 及R2的影响,选择RMSECV 较小及R2接近于1 的主因子数作为最佳建模主因子数,结果表明5-羟甲基糠醛RMSECV最小值为0.538 8,最佳建模主因子数为11,芸香柚皮苷RMSECV最小值为1.683 5,最佳主因子数为11,川陈皮素RMSECV 最小值为0.135 7,最佳建模主因子数为13。
2.4.5 定量模型的建立与评价 通过以上的条件优化,以各成分的最优建模参数和各指标成分高效液相数据导入MATLAB 中,采用PLSR 算法建立陈皮及其炮制品中5-羟甲基糠醛、川陈皮素及芸香柚皮苷的近红外-成分定量模型,选择验证集20 批样品对定量模型进行验证,定量预测值与实测值的相关图见图7。可见,5-羟甲基糠醛、川陈皮素及芸香柚皮苷的训练集与验证集的图形均较为接近对角线,且较为集中,初步说明该模型的拟合度较好。由表4 各成分最佳定量模型参数显示,5-羟甲基糠醛定量模型的R2C 为0.984 7,RMSEC 为0.152 8,验证集R2P 为0.926 9,RMSEP 为0.241 5;RPD 为3.799 4;芸香柚皮苷定量模型的R2C 0.671 8,RMSEC 为1.178 9,验证集R2P 0.768 1,RMSEP 为0.950 9,RPD为2.130 7;川陈皮素定量模型的R2C 为0.983 6,RMSEC 为0.063 0,验证集R2P 为0.802 4,RMSEP为0.071 3,RPD 为2.307 9,说明定量模型有较好稳定性且预测性能理想。

图7 基于近红外光谱各指标成分预测值与测量值的相关图Figure 7 Correlation diagrams of predicted and measured values of each index component based on near-infrared spectroscopy
3 讨论
本研究使用近红外光谱技术结合机器学习方法对陈皮生品及制品进行了有效、快速、无损的定性鉴别,还实现了对陈皮中有效成分的准确定量预测,为陈皮的质量控制提供了一种简便快速有效的方法。HPLC 含量测定结果显示,陈皮通过炮制后芸香柚皮苷和3,5,6,7,8,3′,4′-七甲氧基黄酮的含量显著下降,5-羟甲基糠醛和川陈皮素的则显著性增加,推测可能是在蒸制过程中芸香柚皮苷发生裂解失去糖,3,5,6,7,8,3′,4′-七甲氧基黄酮高温蒸制过程中失去-CH3O 而生成川陈皮素等成分,故其含量降低而川陈皮素含量升高。5-羟甲基糠醛含量升高主要是蒸制过程受热发生美拉德反应的产物[5]。定性鉴别中有监督定性判别模型结果达到100%的准确率,较无监督定性判别结果辨识率高。
在常用的有监督识别方法PLS-DA、SVM、SIMCA 中,PLS-DA 作为一种常见的有监督的模式识别方法,具备线性判别分析的分类能力又兼具PLS降维、降噪的优势,且在原始变量方面具有强大的解释能力,更适用于区分两类的样本[13]。近红外定量模型结果显示,5-羟甲基糠醛的最佳近红外光谱优化和建模方法是1D9S+PLSR,芸香柚皮苷是1D9S+CARS+PLSR,川陈皮素是9S+GA+PLSR,定量模型拟合度较好,有较好稳定性且预测性能理想。而橙皮苷和3,5,6,7,8,3′,4′-七甲氧基黄酮不适合采用近红外定量模型进行含量预测。
本文所用样品主要为市场上大量销售的陈皮及其蒸制品,不包括广陈皮,陈皮和广陈皮成分组成和含量不同,因此该定量模型仅适用于陈皮及其蒸制品的定性鉴别和定量预测,如需进行广陈皮识别还需再增加大量广陈皮的样品进行进一步的分析和验证。
本文建立的近红外定性定量分析陈皮及蒸制陈皮的快速检测方法,操作简便、无需样品预处理过程,模型建立后一次测定仅需几分钟即可完成,且成本较低,不涉及有机试剂,绿色无污染,为更好控制陈皮及其炮制品的质量奠定了基础。
