紫薇叶片原生质体的分离及瞬时转化
2023-02-20刘洁茹林启芳池秀凤程堂仁张启翔潘会堂
刘洁茹,冯 露,林启芳,周 杨,池秀凤,蔡 明,程堂仁,王 佳,张启翔,潘会堂
(北京林业大学 园林学院,花卉种质创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,城乡生态环境北京实验室,北京 100083)
紫薇(Lagerstroemiaindica)抗逆性强,夏季开花,花期长、花量大,广泛应用于园林绿化建设中。人们通过传统的育种方法培育出一系列紫薇品种,使其花色、株型更加丰富[1-5]。近年来,人们致力于紫薇的分子育种探索,从紫微中克隆出一批基因,包括细胞分裂相关的CYCDs基因[6]、调控赤霉素通路的相关基因[7]、影响枝条发育的LfiDAD2基因[8]、生长素相关的基因[9]等,并利用病毒诱导的基因沉默技术(virus-induced gene silencing,VIGS)和模式植物过表达对这些基因进行了验证,但这些研究并不能充分证明基因在紫薇中的功能,基因组功能分析仍然是紫薇分子生物学研究的一大难题。稳定的遗传转化体系是解决这一问题的根本途径,但紫薇遗传转化体系的建立比较困难,目前尚未获得转基因植株,故基因组功能研究工作受到很大影响。
原生质体是去除细胞壁后由质膜包围的具有生活力的植物细胞,其制备相对容易,具有活细胞的一切特征。由于没有细胞壁,原生质体可以摄入细胞核、细胞器基因组或外源 DNA 片段等遗传物质,是非常好的基因转化系统,已在蛋白质互作[10]、基因亚细胞定位[11]、细胞融合[12-13]、基因功能分析[14]、基因组编辑[15]等方面进行了应用。目前已成功分离出原生质体的植物有近400种,分布于40余科160余属,主要为茄科、豆科、禾本科、菊科和蔷薇科植物[16]。有学者利用鹰嘴豆(Cicerarietinum)幼嫩叶片分离出原生质体,用聚乙二醇(PEG)介导的方法将外源DNA导入其中,成功地进行了鹰嘴豆基因的亚细胞定位[17]。王义强等[18]采用银杏(Ginkgobiloba)成熟胚离体培养得到无菌苗和愈伤组织,制备出原生质体,并诱导其融合,融合率达到67%。姜倩倩[19]建立了多年生黑麦草(Loliumperenne)原生质体高效制备及瞬时表达体系,并利用该体系对CRISPR/Cas9编辑载体活性进行了检测。高思丹[20]分离得到了枸杞(Lyciumchinense)的原生质体,对其进行再生细胞壁培养,获得愈伤组织并得到完整的再生植株。由以上研究可知,原生质体途径是验证基因在本源植物中功能的一种有效手段。
高效的原生质体分离是进行遗传转化、细胞融合等研究的重要前提,对紫薇分子生物学研究具有重要意义。目前关于紫薇原生质体制备和瞬时转化的研究尚未见报道。为此,本研究分离了紫薇幼嫩叶片的原生质体,并进行瞬时转化,以期为紫薇基因功能分析提供技术支撑。
1 材料与方法
1.1 材 料
以屋久岛紫薇(L.fauriei)为母本、紫薇品种‘Pocomoke’为父本杂交获得的F1株系S047[6]、紫薇品种‘Ebony Embers’和‘Pocomoke’,均由本课题组收集,在北京林业大学林业科技股份有限公司温室内培养,定期浇水、施肥和修剪,促其萌发新枝。采集修剪后萌发出的幼嫩枝条上的叶片作为原生质体分离的材料。
纤维素酶R-10(10 U/mg,货号为S10043-25g)、离析酶R-10(3 000 U/g,货号为S10082-10g)、果胶酶(500 U/mg,货号为S10007-25g),均购于上海源叶生物科技有限公司。D-甘露醇(纯度≥99%),购于北京百瑞极生物科技有限公司,货号为BN20023-500g。
1.2 品种选择
参考已发表的其他物种的原生质体制备方法,设计3组酶解液,第1组为:10 g/L纤维素酶,3 g/L离析酶,0.5 mol/L甘露醇;第2组为:15 g/L纤维素酶,4 g/L离析酶,0.8 mol/L甘露醇;第3组为:20 g/L纤维素酶,20 g/L离析酶,0.4 mol/L甘露醇。用3组酶解液分别酶解株系S047、紫薇品种‘Ebony Embers’和‘Pocomoke’ 2,4,6,8 h,分析酶解效果,选择适合的分离材料。
为进一步确定最适品种,在上述试验的基础上,对未分离出原生质体的紫薇品种将酶解液中纤维素酶和离析酶质量浓度分别提高为25,50,75 g/L,甘露醇浓度为0.6 mol/L,进行3,5,7 h酶解,分析酶解效果。
1.3 原生质体分离条件的确定
根据1.2节中选定品种原生质体的初步分离情况,确定酶解液中纤维素酶、离析酶质量浓度及甘露醇浓度。
1.3.1 单因素试验 (1)纤维素酶质量浓度对原生质体分离的影响。设置酶解液中纤维素酶质量浓度分别为5,10,15,20,25,30 g/L,离析酶质量浓度为6 g/L,甘露醇浓度为0.6 mol/L,酶解4 h后测算原生质体产量和破损率。
(2)离析酶质量浓度对原生质体分离的影响。设置酶解液中离析酶质量浓度分别为5,10,15,20,25,30 g/L,纤维素酶质量浓度为20 g/L,甘露醇浓度为0.6 mol/L,酶解4 h后测算原生质体产量和破损率。
(3)甘露醇浓度对原生质体分离的影响。设置酶解液中纤维素酶质量浓度为20 g/L,离析酶质量浓度为5 g/L,甘露醇浓度分别为0.4,0.6,0.8 mol/L,酶解4 h后测算原生质体产量和破损率。
1.3.2 正交试验 单因素试验确定了紫薇原生质体的最适甘露醇浓度及纤维素酶、离析酶的质量浓度范围,但原生质体产量较小,不能满足转化试验的要求。为提高分离效率,参考其他物种的分离条件[16,21-23],本试验在原有酶解液中添加果胶酶,进行正交试验。在甘露醇浓度为0.6 mol/L的条件下,以纤维素酶、离析酶、果胶酶质量浓度为影响因子,设计3因素3水平正交试验,将紫薇酶解处理后在黑暗条件下培养5 h,测算原生质体产量和破损率,确定分离紫薇叶片原生质体的最优组合。试验因素与水平见表1。

表1 紫薇叶片原生质体分离条件筛选正交试验设计的因素与水平
1.4 原生质体的制备
原生质体的制备参考包菲等[24]的方法进行,并作部分修改。取叶片0.1 g,用刀片去掉叶片的尖部、尾部和中脉,把叶片切成0.1~0.3 mm宽的长条,浸入酶解液中,放入真空泵中遮光抽真空30 min,然后置于50 r/min的摇床上室温遮光酶解。酶解完成后,在酶解液中加入等体积W5溶液(154 mmol/L NaCl,125 mmol/L CaCl2,5 mmol/L KCl,2 mmol/L MES,pH 5.7)终止反应,将混合物用75 μm的细胞筛过滤至50 mL离心管中,水平冷冻离心机(4 ℃)500 r/min离心5 min,去除上清液,收集管底的原生质体,洗涤2次。向清洗后的原生质体中加入10 mL W5溶液冰上静置30 min,500 r/min离心5 min后,去除上清液,以0.5 mL 转化悬浮液(0.6 mol/L甘露醇,15 mmol/L MgCl2,4 mmol/L MES)重悬原生质体。
吸取原生质体20 μL,用血球计数板计测原生质体产量(g-1),每样品计数3次,计算公式[25]为:原生质体产量=(16个中方格内的原生质体数/0.1×500)/叶片质量。16个方格的总体积为 0.1 mm3。原生质体破损率=视野内破裂原生质体数/原生质体总数×100%。
1.5 原生质体转化
吸取200 μL纯化的原生质体放入2 mL的圆底离心管,加入10~20 μg pSuper1300::GFP质粒,轻轻混匀后,加入等体积的PEG溶液(4 g PEG-4000,2.5 mL 0.8 mol/L的甘露醇,1 mL 1 mol/L的CaCl2,3 mL ddH2O),混匀后室温静置15 min,加入800 μL W5溶液混匀漂洗,以100 r/min离心3 min,去除上清液后,再次加入1 mL W5溶液漂洗,100 r/min离心3 min,去除上清液,并加入1 mL W5溶液重悬原生质体,转移至细胞培养皿中,在22 ℃避光条件下培养14 h后,在激光共聚焦荧光显微镜下进行观察[26]。
1.6 数据处理
使用SPSS 26软件中的一般线性模型对试验数据进行显著性分析和多重比较,使用Excel软件对试验数据进行极差分析,使用Origin 2021软件绘图。
2 结果与分析
2.1 不同紫薇品种的原生质体分离效果
在3种酶解液条件下,‘Ebony Embers’和‘Pocomoke’均未分离出完整的原生质体;S047株系除第1,5,6组合外,其他处理均可正常分离出完整的原生质体,产量为(0.03×105)~(1.01×105) g-1(表2)。
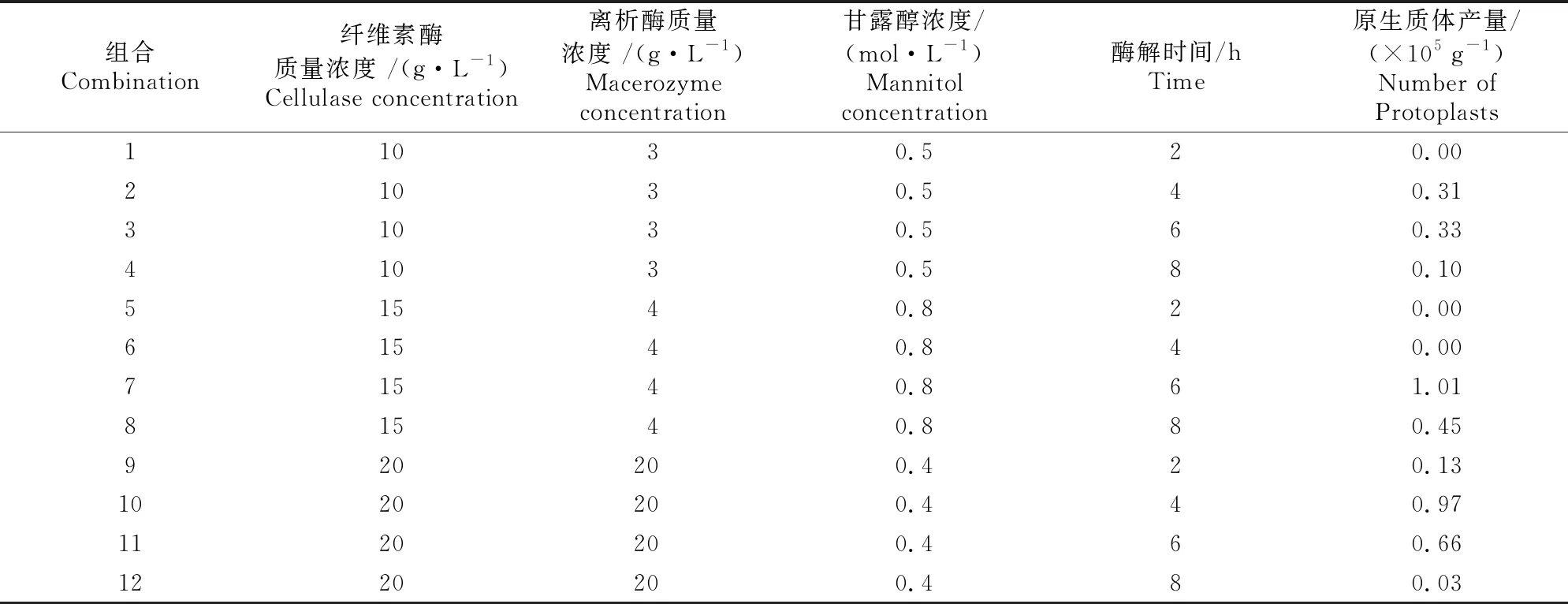
表2 3种酶解液下紫薇S047的原生质体数量
在‘Ebony Embers’酶解过程中产生大量黏稠物质,对黏稠物质镜检发现,其中有少部分完整的原生质体,但过滤后溶液中没有游离的原生质体(图1-a、b和c);‘Pocomoke’叶片在酶解10~30 min时出现褐化现象,并在后续酶解过程中持续褐化(图1-d);S047株系分离溶液呈明亮绿色(图1-e)。

a,b,c.紫薇品种‘Ebony Embers’;d.紫薇品种‘Pocomoke’;e.S047株系
鉴于‘Ebony Embers’和‘Pocomoke’在上述3种酶解液条件下未分离出原生质体,故继续提高酶解液中纤维素酶和离析酶质量浓度,使其质量浓度分别为25,50,75 g/L,甘露醇浓度为0.6 mol/L,分别酶解3,5,7 h,结果仍未分离出完整的原生质体。综上可知,分离原生质体的最适紫薇品种为S047株系。
2.2 紫薇叶片原生质体分离条件的初步筛选
纤维素酶质量浓度对紫薇叶片原生质体分离的影响结果见图2。由图2可知,以S047叶片为材料,不同纤维素酶质量浓度处理的原生质体产量有较大差异,为(0.13×105)~(2.90×105) g-1,当纤维素酶质量浓度为20 g/L时,原生质体产量最高;当纤维素酶质量浓度为15 g/L时,原生质体破损率最低。综合分析表明,S047较合适的纤维素酶质量浓度为15~20 g/L。

图2 纤维素酶质量浓度对紫薇叶片原生质体分离的影响
离析酶质量浓度对紫薇叶片原生质体分离的影响结果见图3。由图3可知,离析酶质量浓度也影响了紫薇叶片原生质体产量,为0~(3.11×105) g-1,当离析酶质量浓度为5~15 g/L时原生质体产量较高。当离析酶质量浓度为5 g/L时原生质体破损率最低,仅为20%;当离析酶质量浓度大于5 g/L时,原生质体破损率总体呈增大的趋势,在其质量浓度为30 g/L时,破损率达到100%。综合分析发现,S047适宜的离析酶质量浓度为5~10 g/L。
甘露醇对紫薇叶片原生质体分离的影响结果见图4。由图4可知,当甘露醇浓度为0.6 mol/L时,原生质体产量最高,为5.5×105g-1,破损率最低。综合分析发现,0.6 mol/L为甘露醇最适浓度。

图4 甘露醇浓度对紫薇叶片原生质体分离的影响
2.3 紫薇叶片原生质体分离最优条件的确定
紫薇叶片原生质体分离条件筛选正交试验结果如表3所示。由表3可知,处理2(10 g/L纤维素酶、5 g/L离析酶、4 g/L果胶酶)的原生质体分离效果最好,产量为28×105g-1,破损率为 14%。极差分析结果(R值)显示,3种酶对原生质体产量的影响由大到小表现为离析酶>纤维素酶>果胶酶。方差分析及多重比较结果表明,3种酶对试验结果均有显著或极显著影响(表4)。因此确定,分离紫薇叶片原生质体的最适酶解液成分为:10 g/L纤维素酶,5 g/L离析酶,4 g/L果胶酶。
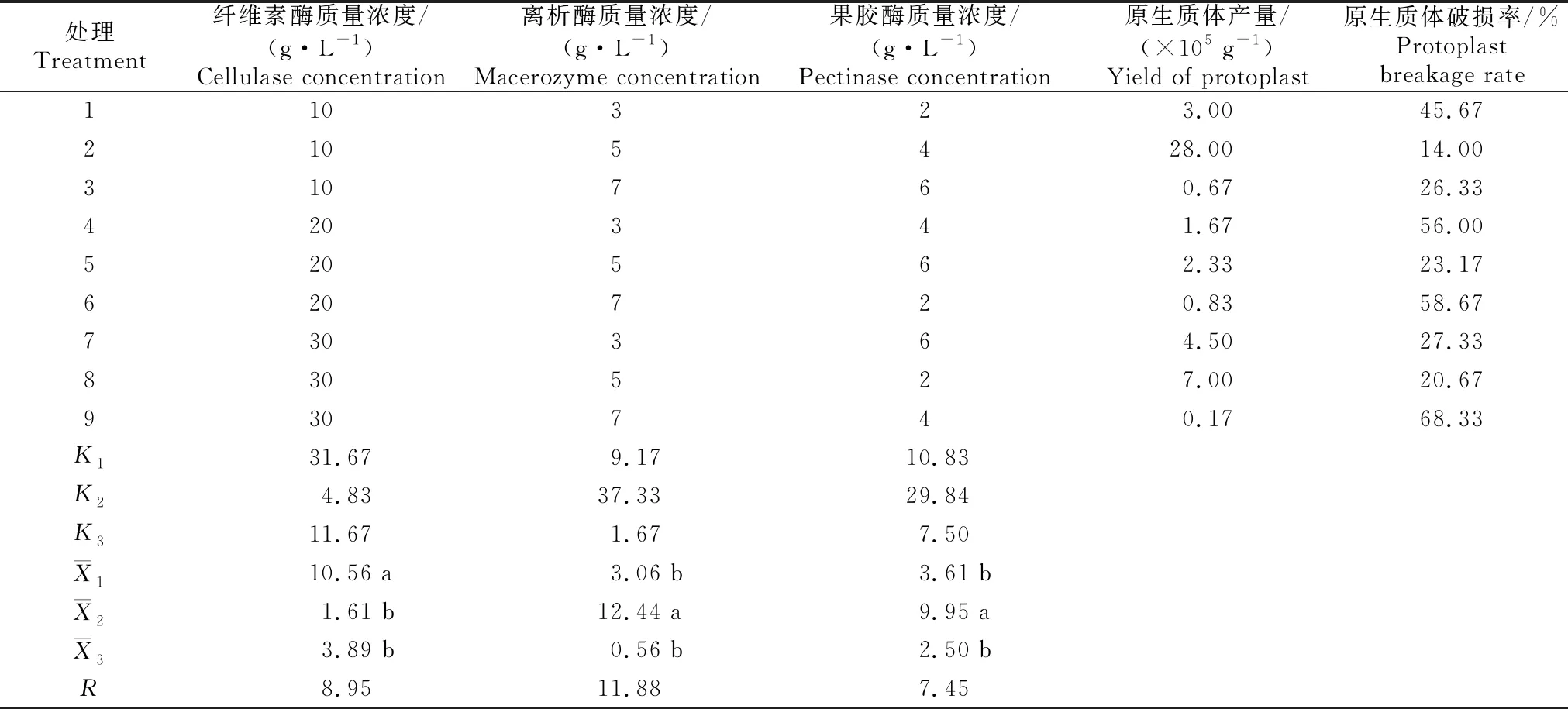
表3 紫薇叶片原生质体分离条件筛选正交试验结果

表4 紫薇叶片原生质体分离条件筛选正交试验方差分析结果
2.4 紫薇叶片原生质体的瞬时转化
利用获得的紫薇叶片原生质体,将连有绿色荧光蛋白GFP的pSuper1300::GFP载体通过PEG介导法进行转化,在荧光共聚焦显微镜下观察到明显的绿色荧光信号(图5),表明分离得到的叶片原生质体可应用于基因的瞬时转化。

A.明场;B.叶绿体自发荧光;C.绿色荧光蛋白(GFP);D.融合场
3 讨 论
影响原生质体分离效果的因素很多,包括植物材料、酶的组成和质量浓度、渗透压、酶解时间等。本研究以3种紫薇的嫩叶作为材料分离原生质体,发现‘Ebony Embers’在酶解过程中出现黏稠物质,阻碍了原生质体的释放。陈彦[27]发现,部分紫薇品种叶片中含有多糖类物质,据此笔者推测本研究‘Ebony Embers’酶解过程中黏稠物质可能为多糖类物质,其会将原生质体裹挟,导致原生质体无法释放至酶解液中。本研究发现,紫薇‘Pocomoke’酶解时会逐渐褐化。陈林等[28]研究表明,紫薇中有大量的多酚类物质。刘艳丽等[29]发现,茶树(Camelliasinensis)原生质体分离过程中会出现褐化现象,利用交联聚乙烯吡咯烷酮(PVPP)可以有效缓解茶树叶片中酚类物质的氧化。后续在紫薇原生质体分离中,也可使用PVPP,探究其对褐化的影响。S047株系原生质体分离过程中没有出现褐化现象,分离溶液呈明亮绿色,可以得到完整的原生质体。可见,不同紫薇品种原生质体分离需要的条件各异,应针对不同的品种建立不同的分离体系。
在原生质体提取过程中,酶的组成及质量浓度是影响分离效果的关键,不同物种所需要的酶的种类和质量浓度不同。如在分离茶树[29]、毛果杨(Populustrichocarpa)[26]、穿心莲(Andrographispaniculata)[30]、甘蓝(Brassicaoleracea)[31]等原生质体时所需酶的种类为纤维素酶和离析酶,而水曲柳(Fraxinusmandshurica)叶片原生质体的分离则要用到纤维素酶、离析酶和半纤维素酶[32],三七(Panaxnotoginseng)原生质体的制备则需要纤维素酶和果胶酶[33]。由以上研究可知,纤维素酶是分离原生质体不可或缺的条件,相对于果胶酶、半纤维素酶和离析酶,其应用更加广泛。本研究单因素试验确定,甘露醇0.6 mol/L、纤维素酶10~20 g/L、离析酶5~10 g/L为紫薇叶片原生质体分离的适宜条件。为提高酶解效率,本研究后续试验在酶解液中引入果胶酶,在甘露醇为0.6 mol/L条件下,设计正交试验筛选酶解液组成,最终得出10 g/L纤维素酶、5 g/L离析酶、4 g/L果胶酶为最适酶解液组成,此条件下原生质体产量为28×105g-1,破损率为14%。
去除细胞壁后的原生质体更易转入外源DNA序列,是进行瞬时转化的良好材料,现在较常用的转化方法有PEG介导法、电穿孔和显微注射法等[34]。本研究采用PEG介导的方法成功地将外源质粒pSuper1300::GFP转入紫薇原生质体,表明分离得到的原生质体可以应用于紫薇外源DNA的瞬时转化,为后续研究提供了基础。本研究对紫薇原生质体转化进行了初步探究,在培养过程中出现原生质体破损现象,导致转化细胞直径仅约有10 μm,影响转化效率,这可能与转化培养过程中的渗透压有关。有研究发现,在棉花叶片原生质体转化过程中,等渗溶液的转化效率高于低渗溶液[35],这对紫薇原生质体转化效率的提高提供了参考。
综上所述,本研究筛选出分离紫薇叶片原生质体的酶解体系为:以10 g/L纤维素酶、5 g/L离析酶、4 g/L果胶酶和0.6 mol/L甘露醇配制酶解液,在黑暗条件下酶解5 h,在此条件下原生质体的产量为28×105g-1。分离的紫薇叶片原生质体可进行瞬时转化,这为紫薇分子生物学研究提供了技术支持。
