基于网络药理学分子对接探讨山慈菇抗三阴性乳腺癌的分子机制
2023-02-17杨冬冬刘颖曹晓东张楠张子英马丽杰
杨冬冬,刘颖,曹晓东,张楠,张子英※,马丽杰※
(1.内蒙古医科大学基础医学院,内蒙古 呼和浩特 010110;2.内蒙古医科大学新药安全评价研究中心,内蒙古 呼和浩特 010110;3.内蒙古医科大学慢性病分子流行病实验室,内蒙古 呼和浩特 010110)
三阴性乳腺癌(triple negative breast cancer,TNBC)是雌激素受体、孕激素受体和人类表皮生长因子均为阴性的一种恶性程度最高的乳腺癌亚型,约占所有乳腺癌的15%~20%[1]。TNBC具有发病年龄小、侵袭性强、转移潜能高和预后差等特征[2],在临床治疗中,由于缺乏明确的治疗靶点,对内分泌和治疗不敏感,手术和化疗仍然是主要治疗手段[3]。
山慈菇(Cremastra appendicutata,CR AP)为兰科植物杜鹃兰、独蒜兰和云南独蒜兰的干燥假鳞茎[4],山慈菇味甘、微辛,性凉,是具有清热解毒、化痰散结的传统中药,是临床上的抗肿瘤药物[5]。已有研究发现[6]其可以通过影响肿瘤细胞增殖、诱导细胞凋亡和干扰细胞侵袭迁移等发挥抗乳腺癌作用。
网络药理学通过筛选药物、疾病靶点,构建生物系统网络图,揭示中药多成分、多靶点、多途径的作用关系,这与中医强调系统观、整体观相符[7,8]。本研究基于网络药理学,筛选山慈菇治疗TNBC的活性化合物、作用靶点及相关通路,并通过细胞实验验测可靠性,以期为后续研究TNBC发生、发展进程中的分子机制及寻找临床山慈菇的潜在靶点提供理论指导。
1 材料与方法
1.1 材料
山慈菇(批号:17122501,内蒙古暮昕药业);4T1乳腺癌细胞株(中国科学院细胞库);PBS(批号:AC10260538,Hyclone公司)、DMEM培养基(批号:S118024,Gibco公司)、0.25% Trypsin-EDTA(批号:2046777,Gibco公司);胎牛血清(批号:11G313,ExCell Bio公司);Penicillin-Streptomycin(批号:51H351,Ex-Cell Bio公司);PI3K多克隆抗体(批号:AF6241,Affinity公司)、磷酸化PI3K(p-PI3K)多克隆抗体(批号:AF3241,Affinity公司)、Akt多克隆抗体(批号:AF4718,Affinity公司)、p-Akt多克隆抗体(批号:AF6241,Affinity公司)、-actin(批号:ab8227,abcam公司)、羊抗兔二抗(批号:ab97051,abcam公司)。
1.2 山慈菇酯提物的制备
将4 kg的山慈菇加4倍无水乙醇回流提取,挥去乙醇,形成不溶于水的胶体,乙酸乙酯萃取3次,低温烘干,待用。取125 mg Cremastra appendicutata,加入0.5 mL DMSO助溶,加生理盐水定容至10 mL,配制12.5 mg/mL母液,过滤,4℃保存[9]。
1.3 山慈菇活性成分和靶点的预测
本研究通过运用中药系统药理学数据库和分析平台(TCMSP,ttp://tcmspw.com/tcmsp.php),以OB>30%和DL≥0.18筛选山慈菇活性化学成分,并查询作用靶点;通过中国知网、Pubmed数据库搜索文献补充山慈菇抗肿瘤的相关活性成分,并在SwissADME平台(http://www.swissadme.ch/)进行筛选,筛选条件是药代动力学中胃肠吸收(GI absorption)为High,之后使用Swiss Target Prediction平台预测其靶点,通过使用UniProt数据库(http://www.uniprot.org) 将靶点规范为统一对应基因,将活性成分和作用靶点导入Cytoscape 3.7.2软件构建山慈菇 活性成分 作用靶点网络。
1.4 疾病相关基因检索
以“triple negative breast cancer”为检索词在OMIM(https://omim.org/)和GeneCards(https://www.genecards.org/)数据库进行检索,两者合并后得到靶基因,使用UniProt数据库疾病靶点进行校正统一。
1.5 蛋白相互作用网络图的构建
将山慈菇和乳腺癌靶点输入Venny 2.1中得到交集靶点,并导入String(http://string-db.org/cgi/input.pl)数据库中,进行蛋白质相互作用分析,将结果保存为TSV格式文件。使用Cytoscape 3.7.2软件构建PPI网络,将节点与degree值大小关联,节点越大degree值越大。
1.6 GO富集和KEGG通路富集分析
将1.3中筛选出的山慈菇抗乳腺癌的交集靶点基因输入DAVID数据库(http://david.ncifcrf.gov/),选择GO富集和KEGG通路富集分析,设置阈值P<0.05,并用OmicShare tool(shttp://www.omicshare.com/tools/)绘图软件可视化。
1.7 分子对接
选取PPI网络中核心靶点进行分子对接验证。在Pubchem(https://pubchem.ncbi.nlm.nih.gov/)数据库中检索山慈菇的活性成分的3D结构,在RCSB PBD(https://www1.rcsb.org/)数据库下载关键蛋白,使用Autodock tools 1.5.6软件进行分子对接,其结果以结合自由能的高低作为活性物质与蛋白质结合的程度评价标准。通常活性物质与蛋白质结合的构象越稳定能量越低,发生作用的可能性越大,对接结果越可靠。
1.8 Western blot检测4T1细胞AKT/PI3K通路蛋白表达
将4T1细胞贴壁培养12 h后,根据课题组前期研究[8]设置空白组和山慈菇酯提物低、中、高剂量组,培养箱中培养24 h,用PBS洗净培养瓶中的培养基,每瓶加300L的蛋白裂解液,提取细胞总蛋白,BCA试剂盒测蛋白浓度并计算蛋白上样量。10%聚丙烯酰胺凝胶电泳(SDS-PAGE),将电泳产物转移至PVDF膜,一抗孵育4℃过夜,TBST洗涤3次,5 min/次,二抗室温孵育1 h,TBST洗涤3次,5 min/次,ECL显色后进行凝胶成像系统扫描拍照分析。
1.9 统计学方法
2 结果
2.1 山慈菇的活性成分及作用靶点
在TCMSP数据库和中国知网上检索相关山慈菇抗肿瘤的文献并经过筛选后得到12种成分,将12种活性成分利用TCMSP和Swiss TargetPrediction平台预测靶点,合并后共得到340个。如图1所示,通过cytoscape 3.7.2软件得到山慈菇活性成分作用靶点的网络图。红色菱形代表山慈菇,粉色圆形代表山慈菇活性成分,蓝色方形代表作用靶点,共有364个靶点,652条边,代表山慈菇成分与靶点的相互作用。

表1 山慈菇活性化合物成分Table 1 Active compounds of Cremastra appendicutata
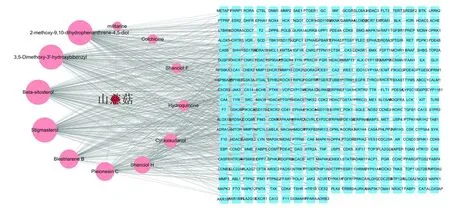
图1 山慈菇化学成分作用靶点网络图Fig.1 Active compound network of Cremastra appendicutata
2.2 山慈菇抗三阴性乳腺癌候选靶基因的筛选
通过GeneCards数据库检索三阴性乳腺癌,取Score>5得到766个靶点;OMIM数据库检索到487个靶基因,两者合并后得到1 235个靶基因。与山慈菇靶点进行匹配,用Venn图形式体现,得到97个交集靶点,见图2。
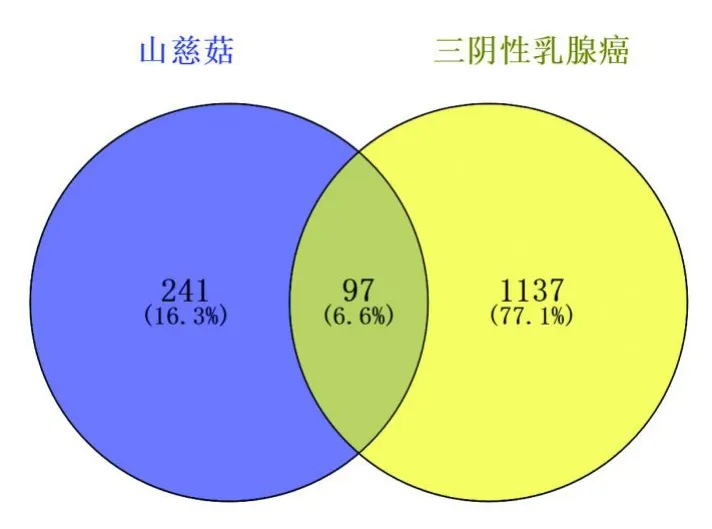
图2 山慈菇和三阴性乳腺癌映射核心靶点Fig.2 Intersection gene of Cremastra appendicutata and triple negative breast cancer target
2.3 蛋白互作网络的构建与分析
将97个交集靶点代入String数据库进行PPI分析,限定物种为Human,获取核心靶点蛋白质的相互作用关系,通过cytoscape软件可视化,根据Degree值对网络进行分析,结果见图3。节点表示蛋白,边代表蛋白之间关联,节点越大颜色越深说明该点的Degree值越高。图中共有88个节点521条边,平均节点度为11.8。从图可知degree排名前10的靶点有HSP90AA1、EGFR、MAPK1、JUN、PIK3CA、CCND1、TNF和ESR1等。

图3 核心靶点蛋白质互作图Fig.3 Protein-protein core interaction network diagram
2.4 GO和KEGG富集分析
为了说明中药化合物的靶点蛋白在基因功能和信号通路中的作用,采用DAVID对交集靶点进行基因本体(GO)分析,以P<0.05筛选显著富集前10个条目。如图4所示,在生物学过程(biological process,BP)中涉及调控细胞的增殖、凋亡、迁移和蛋白质磷酸化过程等;在细胞成分(cellular component,CC)涉及了细胞核、核质、细胞质及线粒体膜等;在分子功能(molecular function,MF)主要涉及酶结合、蛋白质结合、ATP结合、蛋白激酶结合和蛋白丝氨酸/苏氨酸激酶活性等。
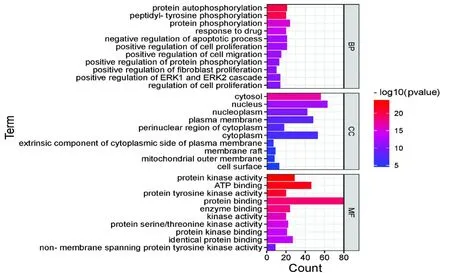
图4 核心靶点GO分析Fig.4 Core target GO analysis
KEGG通路富集分析共得到109条富集分析结果,以P<0.05选取山慈菇治疗乳腺癌潜在治疗靶点的前20条富集结果(见图5和图6),主要涉及到膀胱癌、非小细胞肺癌和胰腺癌等多条癌症相关通路,PI3K-Akt信号通路,Ras信号通路等,构建关键成分靶点通路图,从图中发现前10条通路与41个靶点有着密切的关系。其中12种活性成分、40个靶点作用于癌症通路,有12种成分的27个靶点作用于PI3KAkt信号通路,提示山慈菇可能通过不同成分与多个靶点相互结合,调控不同信号通路发挥治疗乳腺癌的作用。
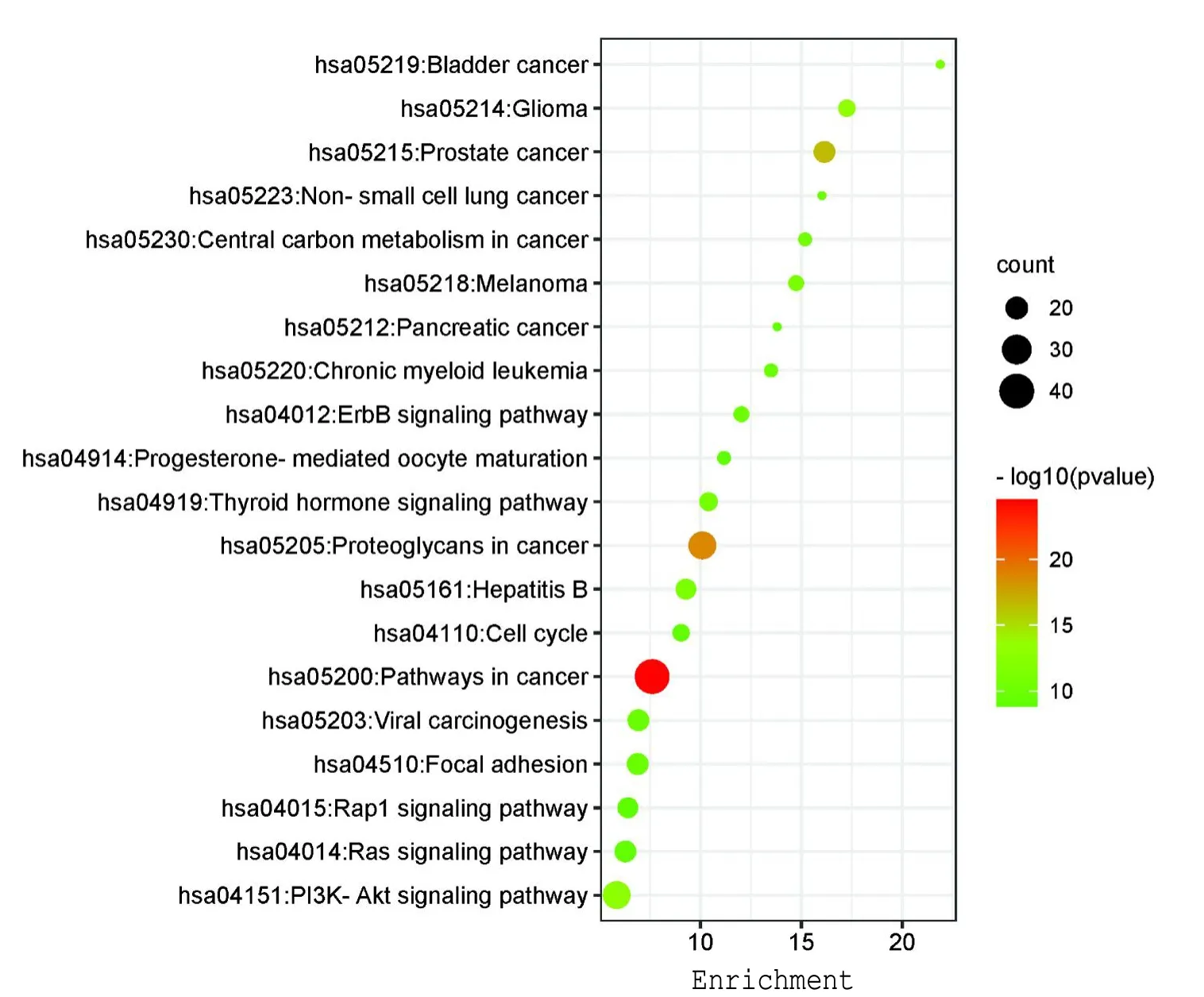
图5 KEGG通路富集分析结果Fig.5 KEGG pathway enrichment analysis
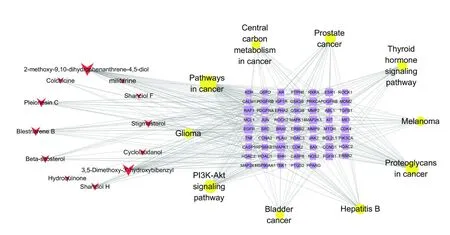
图6 “成分靶点通路”网络图Fig.6 The“components targets pathways”network diagram
2.5 分子对接
为了进一步明确山慈菇治疗乳腺癌的关键靶标与活性成分之间的结合效能,选取山慈菇前4个活性成分与PPI网络中前5个核心靶点进行分子对接,当结合能<0 kJ/mol时,认为分子蛋白质能自发结合,当结合能<5 kJ/mol时,认为分子蛋白质具有较好的结合性,且结合能越低,结合构象越稳定。如图7所示,2-methoxy-9,10-dihydrophenanthrene-4,5-diol,与JUN受体蛋白中氨基酸残基DA-37、DA-6有两个氢键联系;与MAPK受体蛋白中GLN-103、ASP-104有3个氢键联系;与HSP90AA1受体蛋白中氨基酸残基LYS209、GLN-212、PHE-213有4个氢键联系。表2结果显示4个化合物与5个靶点均能稳定结合,提示山慈菇活性成分与上述靶点之间的相互作用可能为山慈菇治疗乳腺癌的机制之一。2.6山慈菇酯提物对4T1细胞AKT/PI3K通路蛋白表达
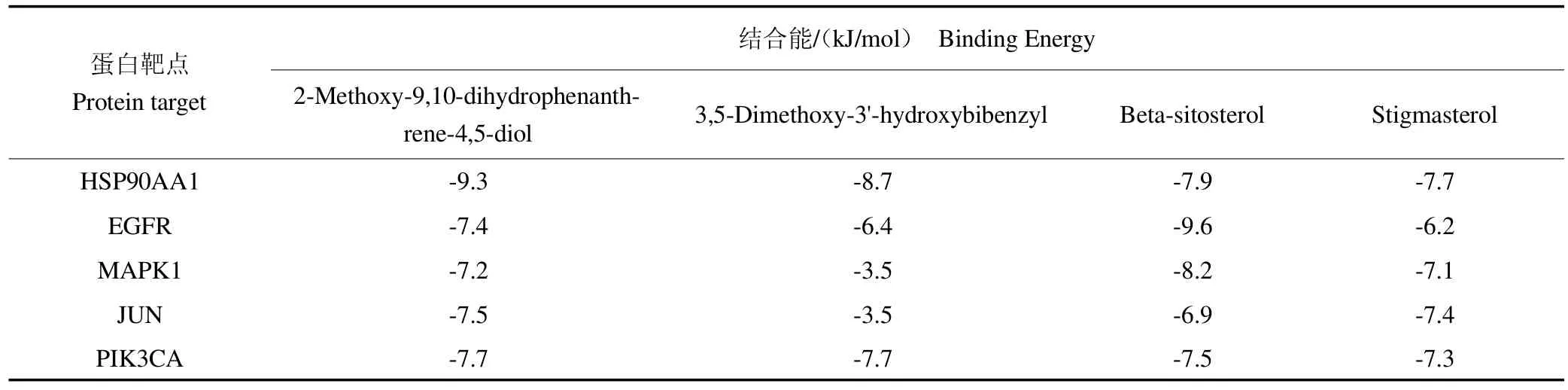
表2 山慈菇核心有效成分分子对接结果Table 2 Molecular docking results of core active ingredients of Cremastra appendicutata
由图8可知,山慈菇酯提物作用于乳腺癌细胞24 h后,与空白组相比,12.5g/mL和125g/mL的CR AP能显著降低AKT的磷酸化水平,1 250g/mL的CR AP能显著降低PI3K和AKT的磷酸化的表达水平(P<0.05)。
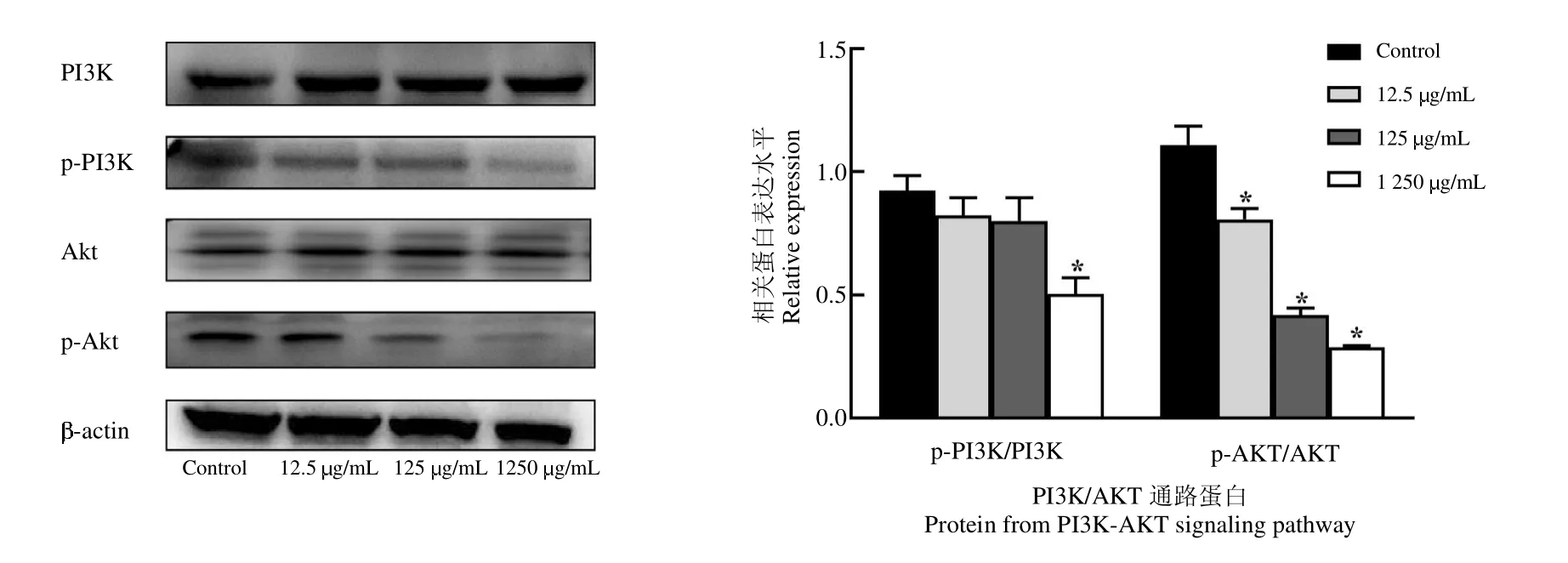
图8 各组细胞PI3K、p-PI3K、AKT和p-AKT蛋白Western blot电泳图Fig.8 Western blot analysis of PI3K,p-PI3K,AKT and p-AKT proteins in each group of cells
3 讨论
山慈菇始载于我国唐代《本草拾遗》,是临床上常用的抗癌中药。现代药理学研究发现山慈菇具有抑制乳腺癌细胞增殖、诱导细胞凋亡和延缓细胞侵袭转移能力[14,15]。本研究基于网络药理学方法,筛选出山慈菇11个抗肿瘤活性成分主要包括甾体类、二氢菲类、联苄类和芳香酯类等。-谷甾醇广泛存在于各种植物中,研究发现[16]-谷甾醇可以通过干扰多种细胞信号通路发挥抗乳腺癌的特性。Zhu等[17]发现-谷甾醇可抑制MCF-7和MDA-MB-231两种人乳腺癌细胞增殖,并通过抑制PI3K-AKT/mTOR通路活化而抑制肿瘤细胞的迁移和侵袭。Attanzio等[18]发现-谷甾醇抑制细胞乳腺癌活性,并介导线粒体凋亡途径促进细胞发生凋亡。豆甾醇具有抗肿瘤、抗氧化和抗炎症等特点[19]。Hyocheol等[20]发现豆甾醇能上调卵巢癌中促凋亡bax和Caspase-3等蛋白表达促使癌细胞凋亡,并通过下调MMP9等蛋白抑制癌细胞转移。本研究通过查询数据库和文献搜索发现山慈菇成分以菲类、二氢菲类居多,李小平[13]研究发现二氢菲类化合物是杜鹃兰的主要成分,对肿瘤细胞具有较强的杀伤作用,提示这可能是山慈菇治疗乳腺癌的重要成分。
本研究通过蛋白相互作用网络分析获得山慈菇治疗TNBC的关键靶蛋白,并通过分子对接技术预测关键靶蛋白HSP90AA1、MAPK1、EGFR和PI3K3CA与山慈菇活性成分间的对接良好。热休克蛋白(Heat shock protein 90 alpha family class A,HSP90AA1)编码癌症伴侣蛋白HSP90,HSP90通过刺激生成肿瘤组织的新生血管,调节肿瘤细胞的免疫应答,影响细胞的增殖与分化[21]。HSP90在乳腺癌患者血液中高表达,可作为TNBC患者预后不良的指标[22]。丝裂原激酶蛋白激酶1(Mitogen activated protein kinase 1,MAPK1)是MAPK信号通路的重要枢纽,与细胞增殖、分化和转录调控等多种生命活动有关[23]。MAPK的表达与TNBC的转移密切相关,研究表明激活MAPK可抑制TNBC细胞的侵袭迁移[24]。表皮生长因子受体(Epidermal growth facter receptor,EGFR)是酪氨酸激酶1型受体家族成员之一,调控细胞的生长。研究表明EGFR蛋白在TNBC中呈现过表达,阳性率高达30%~52%[25],与野生型EGFR相比,突变型EGFR可明显增加PI3K和AKT的活化水平,激活PI3K/AKT/MTOR通路[26]。磷脂酰肌醇激酶3催化亚基(phosphatidylinositol 3-kinase catalytic alpha polypeptide gene,PI3K3CA)是一种致癌基因,编码PI3K的P110亚基,该基因在很多肿瘤处于异常激活状态,大约40%的乳腺癌患者存在PIK3CA表达上调和频繁突变,从而导致P110过度激活[27],HU等[28]发现PIK3CA基因突变可以促进乳腺癌细胞MDA-MB-231的增殖,抑制凋亡,并激活PI3K/ATK/MTOR信号通路从而增加肿瘤细胞对化疗的耐药性。
GO富集和KEGG分析关键靶点蛋白,发现山慈菇活性成分的靶点可能通过Pathways in cancer、PI3K/AKT信号通路发挥调控细胞增殖、凋亡等生物过程。PI3K/AKT信号转导通路是细胞内重要的信号通路,该通路的异常激活可使肿瘤细胞过度增殖、抑制细胞凋亡导致肿瘤发生[29],还可以促进肿瘤细胞的侵袭和转移[30,31]。PI3K蛋白家族是催化肌醇基团磷酸化的蛋白激酶,是信号转导通路中的重要成分,能被受体(RTK)激活,而活化的PI3K蛋白家族将磷脂酰肌醇4,5-二磷酸(PIP2)磷酸化为磷脂酰肌醇-3,4,5-三磷酸(PIP3),进一步激活下游信号因子AKT,促进AKT磷酸化[32],从而发挥相应的生物学功能。
在TNBC的发生发展过程中频繁发现PI3K/AKT/mTOR信号通路的过度激活[33],这或许与TNBC的侵袭转移性强、预后差的临床特点密切相关,抑制该通路激活可成为TNBC新的治疗方向。因此为了进一步验证网络药理学预测结果,结合本课题组前期发现山慈菇抑制鼠源TNBC 4T1细胞增殖促进其凋亡[8],本研究采用Western blot方法验证了山慈菇是否通过调控PI3K/AKT信号通路影响4T1细胞增殖、凋亡,结果显示高浓度的山慈菇干预4T1细胞24 h后,4T1细胞中p-PI3K、p-AKT的蛋白水平明显降低,提示山慈菇通过抑制PI3K/AKT信号通路磷酸化,进而抑制该通路的活化,影响4T1的增殖和凋亡。
综上所述,本研究借助网络药理学和分子对接方法预测了山慈菇有效活性成分、关键靶点和作用机制,可为山慈菇治疗三阴性乳腺癌的临床应用及深入研发提供依据。
