基于GC-MS和网络药理学研究南柴胡挥发油抗抑郁作用机制
2023-02-17邴一凡李苏楠刘学琴杨小龙王淇漩邹翔曲中原
邴一凡,李苏楠,刘学琴,杨小龙,王淇漩,邹翔,曲中原※
(1.哈尔滨商业大学药学院中药学专业教研室,黑龙江 哈尔滨 150076;2.哈尔滨商业大学药学院药物工程技术研究中心,黑龙江 哈尔滨 150076)
抑郁症是一种临床常见的以长期情绪低落为特征的情感障碍类疾病,主要表现为心情低落、兴趣减少和失眠等症状[1]。据统计,目前全球已有超3亿人深受抑郁症困扰[2],且随着当今新冠肺炎疫情全球性的流行,抑郁症的发病率和死亡率也在逐渐升高[3]。抑郁症与中医古籍记载的“脏躁”和“百合病”等疾病的临床表现相似,属于中医“郁证”范畴[4]。病机在于情志内伤与脏气素虚相互作用,忧愁和哀思等情志不畅导致肝失疏泄,肝气不畅,脾失健运而形成郁证[5]。目前西医主要以口服氟西汀、安非他酮等药物来改善疾病症状,但常伴有短期疗效显著、副作用大及复发率高等问题[6]。而中医药对抑郁症的治疗主要以“虚实兼顾,疏肝解郁”为主,且具有多成分和多靶点协调起效及副作用低等独特优势[7]。
柴胡作为我国常用大宗药材,药用历史悠久,用于治疗寒热往来、胸肋胀痛及月经不调等症,在许多治疗抑郁症的经典方剂如逍遥散、柴胡疏肝散中发挥疏肝解郁的功效[8]。南柴胡为伞形科植物狭叶柴胡(Bupleurum scorzonerifolium Willd.)的干燥根[9],相比于北柴胡(B.chinese DC.),南柴胡药性更加柔和,更长于疏肝解郁,升阳散邪[10]。研究表明以南柴胡入药的逍遥散发挥抗抑郁药效好,起效时间更快[11]。尽管南柴胡抗抑郁作用显著,但其药效物质基础和作用机制尚未阐明。考虑到挥发油是南柴胡中含量较高,且具有解热抗炎、抗惊厥作用的一类有效成分[12,13],本文基于GC-MS和网络药理学方法探讨南柴胡挥发油中抗抑郁的潜在药效成分及作用机制,为其深入开发利用奠定基础。
1 材料与方法
1.1 仪器与材料
GC17A-QP5050A气相色谱 质谱联用仪(日本岛津公司);HP-5MS毛细管气相色谱柱(0.25 mm×30 m×0.25m);挥发油提取器;南柴胡药材购于大庆市林甸县,由哈尔滨商业大学药学院曲中原教授鉴定为伞形科植物狭叶柴胡(B.scorzonerifolium Willd.)的干燥根。
1.2 供试品的提取与制备
精密称取南柴胡50 g于烧瓶中,加入8倍量水,参照《中国药典》2020年版四部“2204挥发油测定”甲法,提取5~7 h,至测定器中油量不再增加,得到淡黄色透明油状液体。将挥发油用石油醚溶解,定容到5mL容量瓶中,移至液相进样小瓶中,封口冷藏,备用。
1.3 气相色谱 质谱测定条件
1.3.1 气相色谱条件 色谱柱:HP-5MS毛细管气相色谱柱(0.25 mm×30 m×0.25m);程序升温:40℃(2 min)10℃/min 250℃(5 min)20℃/min 280℃;进样口温度:250℃;载气:氦气流速:1.0 mL/min;进样方式:分流;分流比:10:1。
1.3.2 质谱条件 离子源:MS离子源;离子源温度:230℃;四级杆温度:150℃;能量:70 eV,扫描范围:m/z 50~550。
1.4 基于网络药理学预测南柴胡挥发油抗抑郁作用机制
1.4.1 主要成分及靶点筛选 将鉴定的挥发油成分分别输入PubChem(https://pubchem.ncbi.nlm.nih.gov/)中获取SMILES号[14],随后导入SwissADME平台(http://www.swissadme.ch)[15]根据“类药五原则”(Lipinski、Ghose、Veber、Egan、Muegge)筛选满足五原则中两个或两个以上条件的活性成分。对于不满足上述条件的化合物,通过进一步查阅文献确定是否为可能的活性成分,随后利用SwissTargetPrediction(http://www.swisstargetprediction.ch/)数据库[15],以P>0为条件筛选活性化合物的靶点信息。
1.4.2 抑郁症相关疾病靶点的筛选 采用GeneCards(https://www.genecards.org/)[16]和DrugBank[17(]https://go.drugbank.com/)数据库,以“depression”为关键词进行检索获得疾病靶点,合并两个数据库的靶点信息,删除重复值,使用UniPro(thttps://www.uniprot.org/)数据库[18]规范靶点名称。
1.4.3 成分 失眠靶点PPI网络构建 将疾病靶点和成分靶点导入Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)中获得交集靶点。将交集靶点导入STRING(https://string-db.org/)数据库[19],构建蛋白质 蛋白质互作(protein-protein interaction networks,PPI)网络,然后导入Cytoscape 3.7.2按大于2倍degree中位数条件筛选获得核心靶点。
1.4.4 GO、KEGG富集分析与构建“活性成分 靶点通路”网络 采用DAVID 6.8(https://david.ncifcrf.gov/)[20]数据库对核心靶点进行基因本体(gene ontology,GO)功能富集分析和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析,并采用微生信平台(http://www.bioinformatics.com.cn/)和OmicShare平台(https://www.omicshare.com/)进行数据可视化。最终构建南柴胡挥发油抗抑郁的“活性成分 核心靶点通路”关联网络。
2 结果与分析
2.1 南柴胡挥发油成分分析
南柴胡挥发油的总离子流图见图1。通过检索NIST14.L质谱库,比对准分子离子峰和二级碎片信息结合相关文献共鉴定和表征出28个化学成分,并以扣除溶剂峰的色谱图的全部峰面积作为100%,利用归一化法确定了各组分在挥发油中的相对含量,结果见表1。
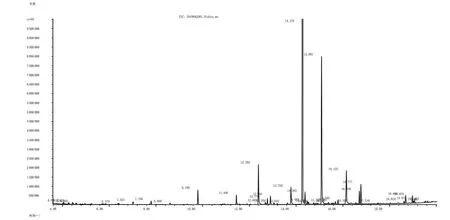
图1 南柴胡挥发油的GC-MS总离子流图Fig.1 The GC-MS TIC diagram of essential oil in Bupleurum scorzonerifolium

表1 南柴胡挥发油成分Table 1 Constituents of volatile oil from Bupleurum scorzonerifolium
2.2 基于网络药理学南柴胡挥发油抗抑郁作用机制
2.2.1 活性成分筛选及靶点预测将鉴定出的成分分别导入SwissADME平台,根据“类药五原则”最终判断这28种成分均为潜在活性成分。采用SwissTargetPrediction数据库最终筛选出358个潜在成分靶点。
2.2.2 筛选疾病靶点在GeneCards数据库中得到抑郁相关靶点13 320个;DrugBank数据库获得抑郁相关靶点1 479个;合并两个数据库的筛选结果后删除重复值,共得到13 552个疾病相关靶点。将358个成分靶点与13 552个疾病靶点导入Venny 2.1.0获得272个交集靶点,作为南柴胡挥发油抗抑郁作用的潜在靶点,见图2。
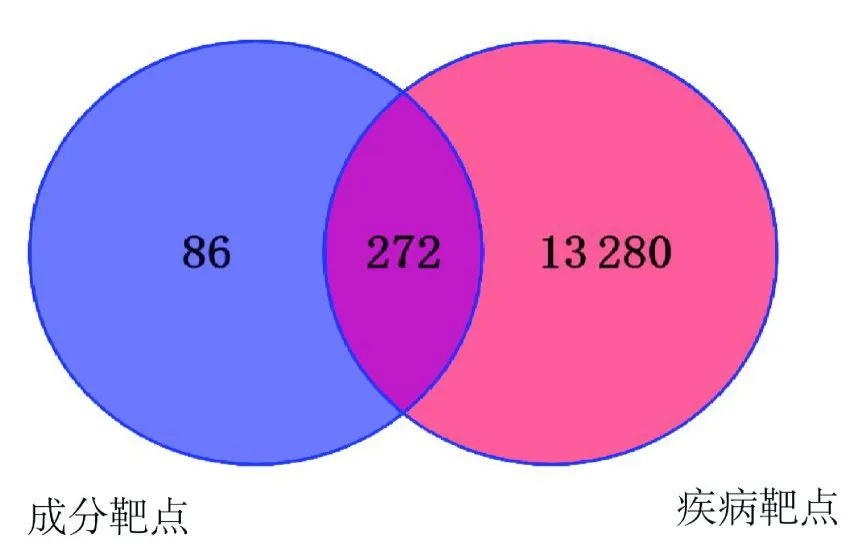
图2 成分靶点与疾病靶点交集韦恩图Fig.2 The intersection venn diagram of compound targets and disease targets
2.2.3 PPI网络的构建及核心靶点筛选用STRING 11.5数据库对272个交集靶点进行靶点间PPI互作关系的分析,见图3。保存TSV文件并导入Cytoscape 3.2.1软件,根据大于2倍degree值的条件最终筛选出45个核心靶点,包括GSK3B、JUN、CXCL8、MMP2、F2R、GNAI3、PRKCA、PTGS2、ESR1、MMP9、EGFR、GNAI1、ESR2、IGF1R、AR、IL6、RXRA和ERBB2等。
图3 交集靶点的PPI网络Fig.3 The PPI network diagram of intersection targets
2.2.4富集分析及“成分靶点通路”网络的构建利用DAVID 6.8数据库对16个核心靶点进行GO分析和KEGG分析。根据P<0.05原则,GO分析最终筛选到264个生物学过程(bioprogress,BP),47个细胞组分(cell components,CC)和57个分子功能(molicular function,MF)。利用微生信平台前10个条目进行可视化,见图4。结果表明,上述核心靶点参与的生物学过程主要包括:MAPK级联的正调节(positive regulation of MAPK cascade)、ERK1和ERK2级联的正调节(positive regulation of ERK1 and ERK2 cascade)、血管平滑肌细胞。KEGG根据P<0.05的条件共筛选到132条通路,利用OmicShare平台对前10条进行可视化分析,结果见图5。结果表明南柴胡挥发油可能通过雌激素信号通路(Estrogen signaling pathway)、Rap1信号通路(Rap1 signaling pathway)、Reaxin信号通路(Reaxin signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)和cAMP信号通路(cAMP signaling pathway)等发挥抗抑郁功效,进一步构建了“成分靶点通路”网络,结果见图6。
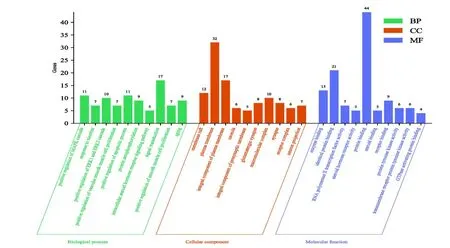
图4 GO富集分析结果Fig.4 Results of GO enrichment analysis

图5 KEGG富集分析结果Fig.5 Results of KEGG enrichment analysis

图6 成分靶点通路网络Fig.6 The diagram of component target pathway network
3 讨论
《丹溪心法·六郁》中记载:“气血冲和,万病不生,一有怫郁,诸病生焉,故人身诸病,多生于郁”,暗示人的情志变化会影响脏腑功能而导致抑郁[21]。研究发现肝失疏泄导致气行不畅,脾胃失调,心肾不交,与情志关系密切,因此目前普遍认为抑郁症的治疗应以疏肝为主,协调四脏为辅[22]。南柴胡作为柴胡传统基源之一,独有“败油气”,功偏于“升”,长于疏肝散热,因此本文从挥发油角度探讨南柴胡治疗抑郁症的潜在活性成分并预测其机制。
文献报道挥发油可通过皮肤和呼吸道直接作用于呼吸系统、循环系统和中枢神经系统,从而起到改善身心健康的作用[23],但目前对挥发油的抗抑郁作用机制仍缺乏系统研究。本试验运用GC-MS在南柴胡挥发油中鉴定了28个化合物,占挥发油总量的99.31%。据报道-蒎烯具有抗焦虑和缓解压力的作用[24,25]。此外-蒎烯和-红没药烯等也是治疗抑郁症的潜在成分[26]。因此推测南柴胡抗抑郁作用与挥发油成分活性有关。进一步通过网络药理学对上述成分的潜在靶点和通路进行预测,结果显示这28种成分主要作用于ESR1、GSK3B、JUN、CXCL8、MMP2、F2R、GNAI3和PRKCA等45个核心靶点,通过雌激素、Rap1、Reaxin、PI3KAkt和cAMP等信号通路发挥抗抑郁作用。ESR1为雌激素受体,是抑郁症治疗的重要靶点,雌激素与脑内受体结合后,会促进神经突触间五羟色胺、去甲肾上腺素等激素的释放,从而改善抑郁症症状[27]。Rap-1由新型cAMP靶分子-Epac激活,其中Epac分为Epac-1和Epac-2,Epac-2主要在脑部和肾上腺中表达,研究表明,抑郁症自杀患者海马体中表现出Rap-1表达和cAMP的结合活性降低[28]。Relaxin-3是Reaxin家族与抑郁症最为相关的一种神经肽,主要在哺乳动物脑中-氨基丁酸(GABA)投射神经元中大量表达,通过与其受体RXFP3结合在抑郁症的治疗中起着重要作用[29]。PI3K/Akt信号通路与抑郁症密切相关,有报道显示PI3K/Akt信号通路的激活会促进IL-1和TNF-等炎症因子的释放,影响患者的睡眠质量,进而加重抑郁的病情[30]。
综上所述,本研究首次采用GC-MS结合网络药理学明确了南柴胡挥发油抗抑郁作用药效的物质基础、潜在作用靶点及通路,可为合理利用南柴胡资源,研发具有抗抑郁作用的大健康产品及提升南柴胡质量标准提供科学依据。
