球囊辅助经皮无名静脉穿刺置入血液透析导管的效果
2023-02-17冯超梁永红陈清周忠信
冯超 梁永红 陈清 周忠信
南方医科大学第三附属医院介入血管外科(广州 510500)
自体动静脉內瘘(arteriovenous fistula,AVF)因通畅率高、并发症少和感染率低,是目前公认的血透通路首选[1-2]。但是,临床中仍然有21% ~73%的患者在开始血液透析时使用中心静脉导管(central venous catheter,CVC),23% ~ 41%患者使用带隧道带涤纶套导管(tunneled cuffed catheter,TCC)行长期血液透析[3-5]。随着导管使用时间的增长,导管相关的感染、静脉血栓及中心静脉狭窄等发生率逐渐增加,患者可用血管资源逐渐耗竭[5]。当这些患者再次就诊时,如何在被损耗的血管基础上重新置入透析导管已成为医务工作者面临的严峻挑战。既往文献报道一些有效的非常规置管方法,如经腰经下腔静脉[3,7]、经肝静脉[8]、经肾静脉等[9-10]。但是因病例数较少、各种条件及技术的限制,未能在各中心常规开展,普及率低。
本中心创新性的通过使用球囊辅助经皮穿刺无名静脉在外周静脉资源枯竭的患者中成功置入带隧道带涤纶套导管获得了良好效果,为长期依赖导管透析的患者提供了建立血液透析通路的新思路。
1 资料与方法
1.1 收集数据 2019年6月至2021年6月在南方医科大学第三附属医院介入血管外科建立血液透析通路患者总共323 例,其中符合本研究纳入标准患者75例(男32例,女43例),年龄26~89岁,平均(62.68±13.04)岁。原发病为糖尿病肾病31 例,肾结石10 例,慢性肾炎6 例,高血压肾病10 例,多囊肾5 例,狼疮性肾炎4 例,肾病综合5 例,病因不详4 例。透析时间2 ~ 216 个月,平均(56.67 ±41.20)个月。32例患者有3次(含3次)以上置管史,见表1。
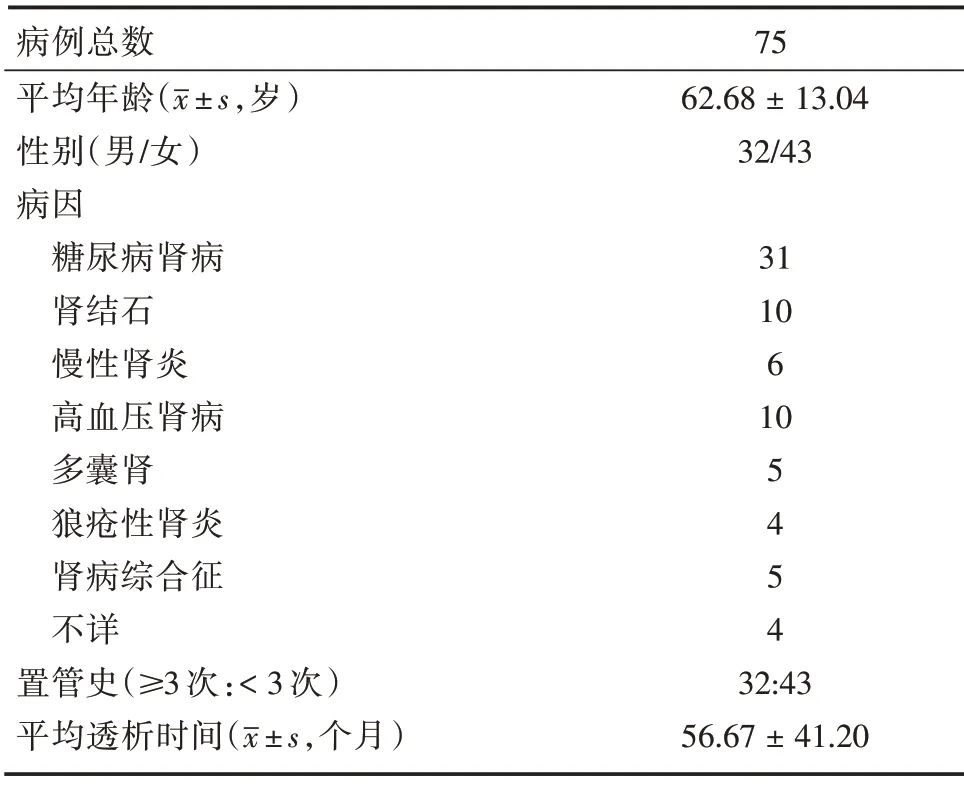
表1 患者一般资料Tab.1 Basic patient demographics 例
本研究中纳入病例均符合以下标准:(1)符合终末期肾病5 期诊断标准;(2)右颈内静脉留置导管史,因感染、导管功能不良、意外脱落等拔除后使用常规方法再次置入导管困难;(3)自体动静脉内瘘或人工血管动静脉内瘘等其他通路建立困难或因手术禁忌证无法建立。排除标准:(1)预期寿命< 6 个月的患者;(2)严重心力衰竭或肝功能衰竭;(3)无法纠正的凝血功能障碍。患者术前签署手术同意书,理解再建通路的获益及风险。术前完善血常规、肝肾功能、凝血功能、胸片、心电图、心脏彩超,排除手术禁忌。
1.2 手术方法[1-2,11-12]患者平卧于DSA(德国西门子AXIOM Artis DSA)检查床上,碘伏常规消毒右侧颈部及双侧腹股沟区铺无菌巾,予以利多卡因(5 mL,0.1 g)行局部浸润麻醉股静脉拟穿刺处;运用赛丁格技术成功穿刺股静脉并置入导管鞘(日本Terumo 公司),引入0.035 inch(1 inch = 2.54 cm)导丝(日本Terumo 公司)及5F VER 导管(美国Cordis 公司)至右无名静脉,造影评估无名静脉、上腔静脉、颈内静脉、锁骨下静脉等情况(图1)。
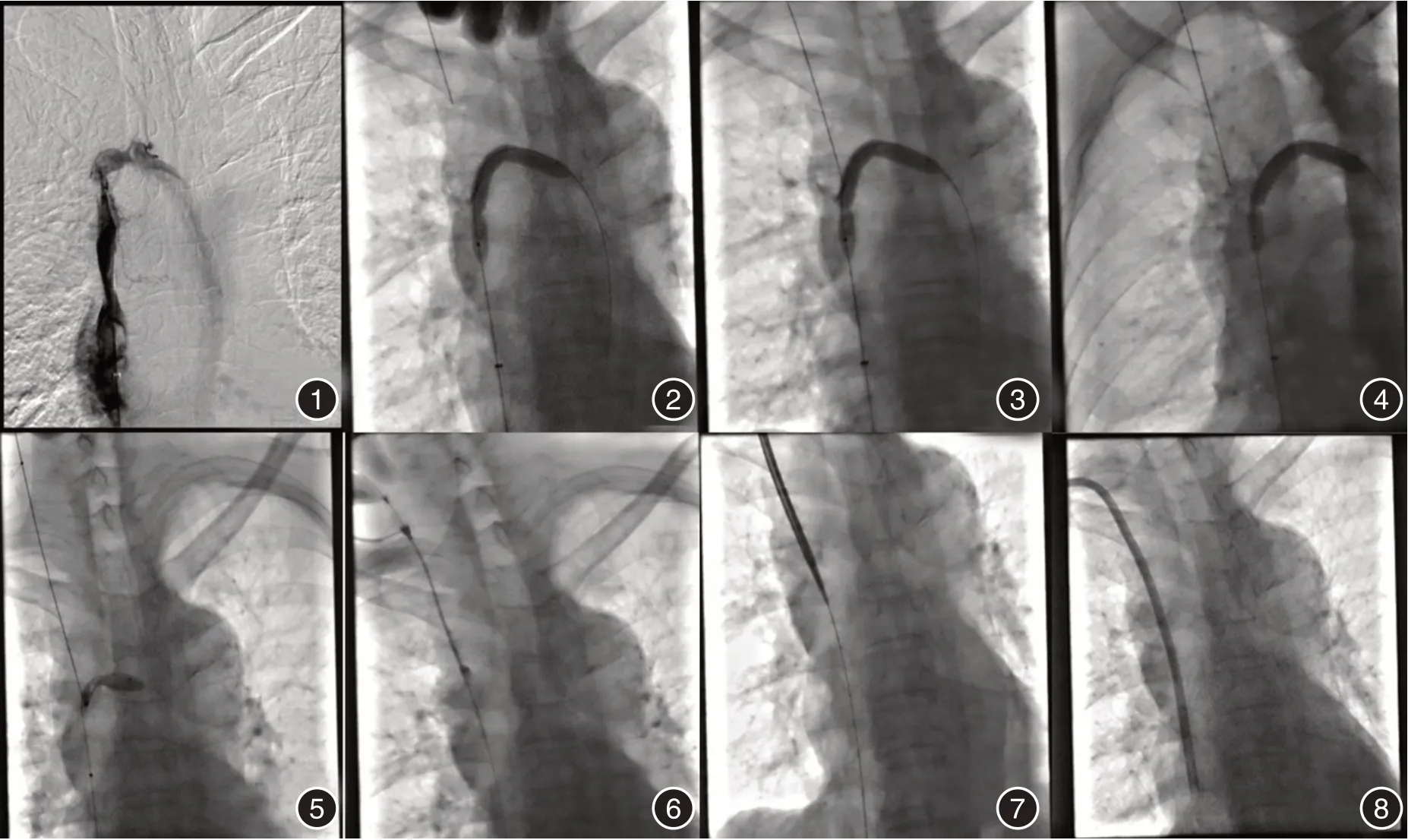
图1 造影见右侧无名静脉闭塞,造影剂经奇回流图2 DSA 定位下选择右侧锁骨上窝皮肤穿刺点图3 正位下见穿刺针接近球囊图4 旋转DSA 球管进一步明确穿刺针与球囊空间关系,见穿刺针与球囊距离较远图5 多角度确认穿刺针成功穿刺球囊,且导丝可送入球囊内图6 导丝送入下腔静脉,经导丝送入血管鞘图7 交换导丝后,逐级扩张穿刺通路图8 成功置入透析导管Fig.1 The right innominate vein was occluded and the contrast flowed back through the azygos veinFig.2 Select the right supraclavicular fossa skin puncture point under DSAFig.3 The puncture needle is close to the balloon on anteroposterior positionsFig.4 Rotate the DSA tube to further clarify the spatial relationship between the puncture needle and the balloon. It can be seen that the puncture needle is far away from the balloonFig.5 Confirm that the puncture needle successfully punctured the balloon,the guide wire can be put into the balloonFig.6 The guide wire is sent into the inferior vena cava and send into the vascular sheath through the guide wireFig.7 After exchanging the guide wire,the puncture path was expanded step by stepFig.8 Successful placement of TCC
经导丝引入ATB 球囊扩张导管(COOK 公司,美国)至右无名静脉;造影剂充盈球囊,旋转球管进一步明确皮肤穿刺点与球囊位置关系,确定最佳穿刺路径(图2)。
利多卡因(5 mL,0.1 g)局部浸润麻醉右锁骨上窝拟穿刺处,透视下使用22 G 软组织活检针(ARGON,美国)经右锁骨上区直穿球囊到位(图3),旋转球管进一步证实(图4),引入0.018 导丝(Boston Scientific,美国)球囊内(图5),后撤球囊时送入导丝至下腔静脉。
沿导丝送入4F 导管鞘(图6)后扩张器逐级扩张扩穿刺通路(图7),按常规方法[1-3]将透析导管(HemoSplit 美国巴德公司或Palindrome,美国美敦力)于皮下隧道置入,导管尖端位于右心房上部(第3 前肋或第3、4 前肋间隙水平)(图8)。回抽导管动、静脉端见血流通畅。
采用10 mg/mL 的普通肝素溶液封管(有出血倾向的患者使用低浓度的肝素溶液封管)。分别缝合上述皮肤切口,将导管固定在皮肤上。无菌敷料包扎。
1.3 术后处理 术后第1 天行常规规律血液透析,并预防性使用抗生素24 h,伤口隔日换药,术后第7 天拆除缝线(除固定缝线外)。
1.4 随访 记录术中、术后并发症,术后1、3、6 个月进行门诊或电话等随访导管通畅情况[1-2](导管血流量< 200 mL/min,或血泵流量< 200 mL/min时,动脉压<-250 mmHg 或者静脉压> 250 mmHg时,无法达到充分性透析)、导管相关性感染等,观察有无颜面部肿胀、上肢肿胀、胸壁浅表静脉扩张等上腔静脉综合征表现。
1.5 统计学方法 采用SPSS 19.0 统计软件进行数据处理,服从正态分布的计量资料以均数±标准差表示;计数资料以例表示;通畅率采用Kaplanmeier 分析法。P<0.05 表示差异有统计学意义。
2 结果
2.1 手术结果 75 例患者中,72 例成功置入导管(成功率96.00%),其中1 例患者因胸椎下段后凸畸形,穿刺过程中出现气胸,术后立即予胸腔穿刺闭式引流,术后第2 天复查胸片气胸消失;1 例术中突发气促、胸闷、血压下降,床边急诊B 超提示心包填塞,给予心包置管引流后,临床症状消失,术后第3 天彩超复查心包内积液消失;1 例高龄患者术中无法配合,中止手术。
2.2 随访结果 所有患者1 个月导管通畅率为100%,3个月通畅率为100%,6个月通畅率94.67%。2 例患者分别于术后4、5 个月时因导管感染再次就诊,予药物治疗后无好转,予拔除导管;4 例患者因导管功能障碍入院,经内科综合治疗后导管均可继续使用。所有患者随访过程中未发生颜面部肿胀、上肢肿胀、胸壁浅表静脉扩张等上腔静脉综合征表现。
2.3 典型病例 见图1。患者男性,59 岁,高血压肾病,既往行左上肢AVF 失败,留置右颈内TCC2年。因TCC 失功入院。
3 讨论
随着血液透析技术的广泛开展与提高,慢性肾脏病患者的透析时间越来越长,多数患者由于反复、长期地接受中心静脉置管,同时高龄及各种合并症(如血管炎、糖尿病及高血压等),透析时血流动力学改变对血管壁的刺激,血管钙化、炎性刺激等,进而导致管腔增生狭窄直至完全闭塞[5,13-15]。据报道,与血液透析相关的中心静脉狭窄闭塞发生率高达25%~40%[13-16]。
在本研究中,患者为长期血液透析患者,平均透析时间为(56.6±41.20)个月,常常合并一种或多种慢性疾病,有多次血液透析通路史,合并有不同程度的中心静脉狭窄或闭塞,预期AVF 或AVG 效果差,甚至会出现颜面部水肿等风险。本研究中所有患者均存在颈内静脉或锁骨下静脉置管史,42.67%的患者有3 次(含3 次)以上置管史,这同样说明反复多次静脉置管可导致中静脉狭窄或闭塞,甚至会导致透析血管通路的丧失,这是导管使用中最严重并发症。本研究中43例患者血管条件差,自体动静脉内瘘(arteriovenous fistula,AVF)或人工血管动静脉内瘘(arteriovenous graft,AVG)建立困难,20 例患者及家属对AVG 建立费用及需要反复维护的特点难以接受,拒绝AVG。另外,12 例患者心功能差,如采用AVF 或AVG,发生心力衰竭的风险高。当这些患者再次就诊时,如何置入有效的血液透析导管是面临的一个重要挑战。
针对周围血管枯竭的慢性肾脏病患者按常规方法置入透析导管异常困难,既往文献报道了一些有效的非常规置管方法[17-20],如经颈侧支经中心静脉、经颈闭塞静脉经中心静脉、直穿阻塞中心静脉、经腰经下腔静脉、经肝静脉、经皮经肾静脉等。POWER 等[3]报道26 例患者行39 次经腰下腔静脉穿刺透析导管置入,技术成功率100%,1 例术后出现自限性腹膜后血肿。导管6 个月一期通畅率为81%,12 个月一期通畅率为73%。HUR 等[9]报道6 例患者行6 次经肾静脉穿刺中心静脉导管置入及4 次原位导管更换。导管平均通畅时间为(107.3 ± 70.9)d。随访中[平均随访时间(141.2 ±137.1)d],有4 例患者因导管失功(2 例)及导管移位(2 例),在成功移除导管后行肾移植。虽然针对周围血管耗竭患者,再次置入血液透析导管的方法很多,但是因病例数较少、各种条件及技术等的限制,尚未能在各中心常规开展,普及率低。
周芹等[21]报道19 例患者在DSA 下行经皮右无名静脉技术建立长期血液透析通路的临床研究,所有患者顺利穿刺并成功置入透析导管,术后所有患者导管功能良好,未发生置管相关的严重并发症。同侧的锁骨下静脉和颈内静脉汇合形成无名静脉,无名静脉位于胸锁关节后方,为上腔静脉最粗大的属支,周围结构支撑好、解剖位置相对固定,这为穿刺无名静脉置管提供了有利条件[22-23]。本中心在以往的操作方法上进一步优化,采用球囊辅助成功穿刺无名静脉并置入TCC取得良好效果,随访过程中,1 个月导管通畅率为100%,3个月通畅率为100%,6个月通畅率94.67%。本术式的主要优点在于:(1)相对于B 超、CT 和MR 检查,血管造影可以更直观、全面的评估股静脉、下腔静脉、上腔静脉、无名静脉、颈内静脉等情况;(2)通过充盈球囊引导穿刺,可以增加血管真腔可穿刺范围,进而提高穿刺成功率;(3)DSA 下实时操作,降低手术风险(气胸、血胸、纵膈出血、空气栓塞及心脏破裂);(4)置入导管过程中,可全面了解导丝头端位置,引导导管头端精确定位;及时调整导管尖端至合理位置,降低腔房交界处中心静脉疾病发生率;(5)针对中心静脉狭窄病变,及时行球囊扩张充分撕裂导管所致纤维鞘,延长血液透析导管的使用寿命。
由于本中心病例数及随访时间等的限制,仍存在许多不足之处。首先,由于缺乏前瞻性研究,无法比较球囊辅助穿刺无名静脉入路建立血管通路与其他方式建立通路的优劣;其次,因为随访时间短,导管相关并发症及导管通畅率还有待进一步观察研。最后,因为病例数有限及无名静脉的特殊解剖位置,球囊辅助下无名静脉穿刺有发生严重术中/术后并发症的风险,此类技术须在具有丰富的血管通路及介入经验基础下谨慎开展,同时需要多学科的协助。
本研究证实了球囊辅助穿刺无名静脉并成功置入透析导管的可行性、安全性和有效性,为长期依赖导管透析的患者提供了建立血液透析通路的新思路。
