应激诱导磷蛋白1可能通过调节Cx43表达影响低温缺血再灌注后心室肌电传导
2023-02-17安丽高鸿刘艳秋钟毅曹莹易菁刘旸佟睿潘志军王圣钊吴昊刘美言
安丽 高鸿 刘艳秋 钟毅 曹莹 易菁 刘旸佟睿 潘志军 王圣钊 吴昊 刘美言
1贵州医科大学麻醉学院(贵阳 550004);2贵州医科大学附属医院麻醉科(贵阳 550004);3贵州医科大学转化医学研究中心(贵阳 550025);4贵阳市第四人民医院麻醉科(贵阳 550007)
再灌注心律失常(reperfusion arrhythmia,RA)是心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)后较为常见的并发症之一[1]。我们前期研究发现[2],低温缺血再灌注后,RA 的发生与心肌细胞间缝隙连接通道的连接蛋白43(connexin 43,Cx43)表达减少有关,但Cx43 下调的机制尚不明确。文献报道大部分在内质网合成的初生肽蛋白,需借助分子伴侣完成折叠与组装,初生肽蛋白最初与分子伴侣热休克蛋白40(heat shock protein 40,HSP40)和热休克蛋白70(heat shock protein 70,HSP70)形成复合物,通过应激诱导磷蛋白1(stress induced phosphoprotein 1,STIP1)与热休克蛋白90(heat shock protein 90,HSP90)结合后完成折叠组装[3],HSP90 可与Cx43 结合,发挥心脏保护作用[4],而未折叠或错误折叠的Cx43 易被泛素化降解[5]。另有研究[6]表明STIP1 在缺氧处理的心肌细胞中低表达,而STIP1 基因敲除的小鼠可致胚胎死亡[7],这表明该分子是必不可少的辅助伴侣。然而,RA 的发生及心肌细胞Cx43 蛋白的下调是否与STIP1 有关,目前未见相关报道。本研究通过建立大鼠Langendroff 离体心脏灌注模型,采用Mapping Lab 矩阵式电生理标测系统及Western blot 和免疫组化检测STIP1、Cx43 蛋白表达和分布,探究STIP1 通过调节Cx43 表达影响低温缺血再灌注后心室肌电传导的机制,为寻求防治RA 的新靶点提供实验依据。
1 材料与方法
1.1 实验动物及模型制备 本研究已获贵州医科大学动物伦理委员会的批准(审核批号:NO.2200996)。选择体质量250 ~ 350 g,健康清洁级2~3月龄雄性SD 大鼠16 只,腹腔注射3%肝素3 125 U/kg 进行抗凝10 min 处理后,再腹腔注射1%的戊巴比妥钠0.4 mL/100 g 完成麻醉,待麻醉生效之后,开胸迅速取出心脏,并置于4 ℃的K-H 液(mmol/L:NaCl 118、CaCl21.26、KCl 4.5、MgSO4·7H2O 1.22、KH2PO41.18、C6H12O611.1、NaHCO324.99、pH 值7.4)中,冲洗主动脉内的残留血液,显露并修剪主动脉后,固定主动脉于IH-SR,844 型Langendorff 灌注装置(德国HUGO SACHS ELEKTRONIK-HARVARD APPA RATUS GmbH D-79232 March-Hugstetten)上,主动脉插管深度距主动脉瓣距离>2 mm,用95%O2-5%CO2预充K-H 液,设置灌流恒温(36.5~37.5 ℃)、恒压(8.65 kPa)后进行逆行非循环式灌注。Langendroff 离体心脏灌注模型制备成功标准为:在平衡灌注上述K-H 液10 min 内离体心脏恢复正常节律跳动且心率(heart rate,HR)>180 次/min。
1.2 实验分组 将建立成功的离体心脏模型16个,通过数字表法随机分成两组,每组8 个。对照组(C 组):持续灌注37 ℃K-H 液120 min;低温缺血再灌注组(IR组):持续灌注37 ℃K-H液30 min后,经主动脉根部注射4 ℃20 mL/kg Thomas 停跳液(mmol/L:NaCl 110、KCl 16.1、CaCl21.26、NaHCO39.99、MgCl 15.96、pH 值7.8)使心脏停搏后停灌K-H液60 min,心脏在停跳期间,被置于4 ℃K-H 液中,在心脏停灌的30 min 时,被追加半量4 ℃10 mL/kg Thomas 液经主动脉根部注射,停跳60 min 结束后经主动脉根部再灌注37 ℃K-H 液30 min。
1.3 微电极阵列测定心室肌前壁电传导 持续灌注15 min 后,于左心室前壁放置64 矩阵式电极固定,放置参考电极于主动脉根部,随后将电极导线与Mapping Lab 矩阵式电生理标测系统的信号输入线连接,根据采集的局部场电位调整矩阵式电极与心脏贴合情况,记录左心室局部的电传导情况。分别采集持续灌注15 min(T0)、持续灌注30 min(T1)、再灌注15 min 即C 组持续灌注105 min(T2)、再灌注30 min 即C 组持续灌注120 min(T3)各时点的HR、传导速度(conduction velocity,CV)和电传导图。分别记录并观察心脏复跳的时间和再灌注30 min 内心律失常发生的类型及其持续时间,参照文献[8]行心律失常评分。再灌注结束立刻取左心室心肌组织置于液氮冻存,待心肌组织冰冻后转至-80 ℃冰箱保存,另取心肌组织用多聚甲醛溶液(10 g/L)固定后放置于-4 ℃冰箱保存待后续检测。
1.4 Western blot 法检测STIP1 和Cx43 的表达取出-80 ℃冰箱中的心室肌组织,冰上研磨后加入裂解液(RIPA)提取各组心肌组织的总蛋白,通过BCA 试剂盒来检测各组的总蛋白浓度后定量。在12%的SDS-PAGE 分离胶进行电泳后转膜,洗膜后用5%脱脂牛奶封闭2 h,彻底清洗后分别用抗Cx43兔抗大鼠一抗(1∶1 000,Affinity 公司,美国),抗STIP1 兔抗大鼠一抗(1∶1 000,Affinity 公司,美国)4 ℃孵育过夜。第2 天加入标记为HRP 的二抗(1∶1 000,北京博奥森生物技术有限公司,中国)后,置于室温振荡器中孵育1 h,随后ECL 显影并应用全自动化学放光成像系统(Tanon-5200 上海天能科技有限公司,中国)曝光。通过Image J 图像软件分析各组条带的灰度值,以GAPDH(1∶1 000,Bioword公司,美国)为内参并计算其相对的蛋白表达量。
1.5 免疫组化检测Cx43 蛋白分布 取出-4 ℃冰箱中多聚甲醛溶液固定的心室肌组织,用EDTA 脱钙液脱钙,乙醇脱水并石蜡包埋后切片,用灭活内源性酶将切片放置在体积分数为20%H2O2的蒸馏水中5~10 min,随后在枸橼酸盐缓冲液中浸泡,并用高压锅将其加热沸腾修复抗原后,滴加5%牛血清白蛋白(BSA)的封闭液置于37 ℃的温箱15 min,之后滴加稀释的抗Cx43 的一抗(1∶100,Affinity 公司,美国),抗STIP1 的一抗(1∶100,Affinity 公司,美国)置于4 ℃温箱过夜,次日滴加辣根过氧化物酶的二抗IgG1(1∶1 000,北京博奥森生物技术有限公司)置于37 ℃的温箱中20 min 后,滴加免疫组化试剂SABC 染色,随后用DAB 显色剂显色和苏木精复染、然后将其脱水后透明并封片。置于全玻片的光学显微镜下(OLYMPUS SLIDEVIEW VS200,仪景通光学科技上海有限公司)观察,其中阳性为棕黄色染色,阴性为不着色。用Image J 图像分析软件分析各着色蛋白的平均光密度值。
1.6 统计学方法 应用SPSS 19.0 软件进行统计学分析,正态分布计量资料用()表示,组间比较采用单因素方差分析,各时点组间比较用重复测量方差分析,P<0.05 差异有统计学意义。
2 结果
2.1 两组心律失常的发生情况 C 组:持续灌注期间无心律失常发生;IR 组:再灌注时8 例在30 s内均恢复心跳,发生心律失常有7 例,心律失常的发生类型、持续时间及心律失常的评分见表1。
表1 两组大鼠心律失常及评分比较Tab.1 Comparison of arrhythmias and scores between two groups of rats ±s
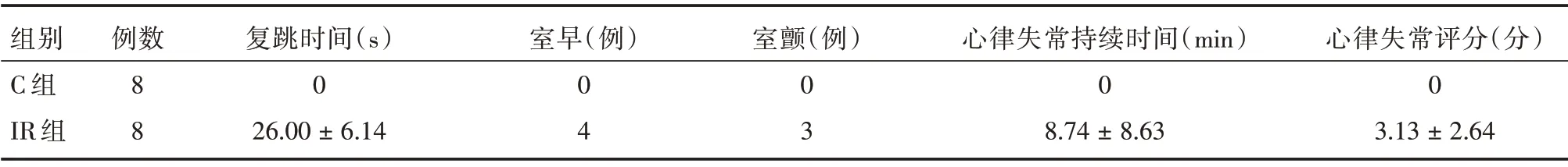
表1 两组大鼠心律失常及评分比较Tab.1 Comparison of arrhythmias and scores between two groups of rats ±s
注:IR 组心律失常发生率为87.5%
组别C 组IR 组例数8 8复跳时间(s)0 26.00±6.14室早(例)0 4室颤(例)0 3心律失常持续时间(min)0 8.74±8.63心律失常评分(分)0 3.13±2.64
2.2 两组不同时点HR 及CV 的比较 C 组:各时点的HR 及CV 未见明显的差异(P> 0.05),IR 组:T2与T3时点与T0与T1时点比较,其HR 及CV 出现明显减慢(P<0.05),见表2、3。
表2 两组大鼠不同时点HR 的比较Tab.2 Comparison of HR between two groupst rats at different times ±s,次/min
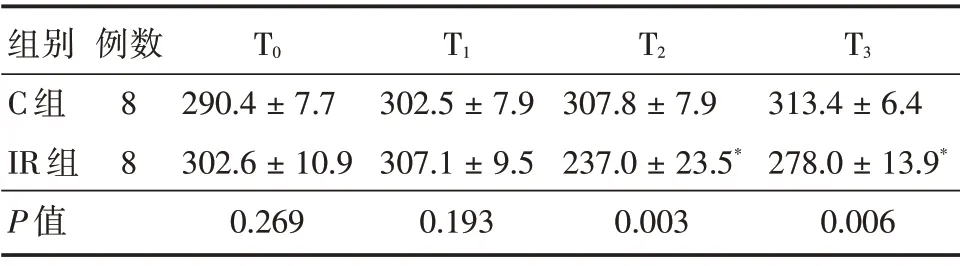
表2 两组大鼠不同时点HR 的比较Tab.2 Comparison of HR between two groupst rats at different times ±s,次/min
注:与C 组比较,IR 组,T2、T3与T0、T1比较,*P<0.05
组别C 组IR 组P 值例数8 8 T0 290.4±7.7 302.6±10.9 0.269 T1 302.5±7.9 307.1±9.5 0.193 T2 307.8±7.9 237.0±23.5*0.003 T3 313.4±6.4 278.0±13.9*0.006
表3 两组大鼠不同时点CV 的比较Tab.3 Comparison of CV between two groups rats at different times ±s,mm/ms

表3 两组大鼠不同时点CV 的比较Tab.3 Comparison of CV between two groups rats at different times ±s,mm/ms
注:与C 组比较,IR 组,T2、T3与T0、T1比较,*P<0.05
组别C 组IR 组P 值例数8 8 T0 2.2±0.3 2.5±0.4 0.118 T1 2.4±0.2 2.5±0.1 0.281 T2 2.3±0.1 1.7±0.1*0.001 T3 2.9±0.1 1.9±0.1*0.001
2.3 不同时点左心室肌前壁传导方向 Mapping Lab 64 矩阵式电生理指标测示可见,C 组:与T0时点相比,T1、T2、T3时点传导方向未见改变。IR 组:与T0时点相比,T1时点传导方向未见明显改变,T2、T3时点传导方向呈发散改变,见图1。

图1 两组离体心脏不同时点传导方向Fig.1 The conduction direction of two groups of isolated hearts at different time points
2.4 Western blot 检测STIP1、Cx43 蛋白表达 与C 组比较,IR 组STIP1、Cx43 蛋白表达均明显降低(P<0.05),见图2。

图2 两组大鼠心室肌Cx43、STIP1 蛋白表达Fig.2 Expression of Cx43 and STIP1 proteins in ventricular muscle of two groups rats
2.5 左心室肌免疫组化检测STIP1、Cx43 蛋白分布 免疫化学分析两组间心肌组织内STIP1 和Cx43 阳性着色细胞的平均光密度。呈棕黄色颗粒状为阳性着色,蓝色表示心肌细胞的细胞核。与C 组比较,IR 组STIP1、Cx43 蛋白的阳性分布减少(P<0.05),另Cx43 蛋白的阳性分布有从端端转为侧侧的链接情况,并呈凌乱排列,黑色箭头为闰盘处的Cx43,红色箭头为Cx43 的侧偏化。见图3。

图3 两组大鼠心室肌免疫组化染色结果(×200)Fig.3 Results of immunohistochemical staining in ventricular muscle of two groups rats(×200)
3 讨论
在体外循环下实施心内直视手术过程中,虽对心肌进行了低温高钾停跳液等保护措施处理,但心脏复跳时RA 仍是较常见的并发症,使此类手术的成败和患者预后常受到影响[9]。如何改善RA 的发生,是目前一直研究的热点。笔者前期研究发现[2]:低温缺血再灌注后,RA 的发生与Cx43表达减少有关,但对其机制不清,是否通过改善心肌缺血再灌注后Cx43 下调,从而减少RA 的发生,是本实验预探究的问题。
位于心肌细胞闰盘(intercalated disc,ID)的Cx43 是哺乳动物心室肌细胞膜上表达最丰富一种特殊的通道连接蛋白[10-11],大量文献证实在RA 的发生发展中,Cx43 发挥着重要作用[12]。MAHONEY
等[13]研究报道,小鼠心肌细胞中心室CV 下降与Cx43 的表达下降有关。JUNG 等[14]研究认为,大鼠心脏的Cx43 基因被敲除后,可致心肌细胞间的电传导出现障碍,引起恶性心律失常。李伟超等[15]研究认为七氟醚可稳定心肌细胞间Cx43 的分布与表达,减轻RA 的发生。另有研究[16]表明,初生肽蛋白最初由HSP40 和HSP70 形成的复合物募集,然后在STIP1 的帮助下转移到HSP90 上完成折叠与组装,而未折叠或错误折叠的蛋白易被泛素化降解[17]。在真核生物中,HSP90 作为伴侣蛋白与HSP70 一起控制蛋白质稳态[18]。WEI 等[19]研究发现异丙肾上腺素可通过抑HSP70/HSP40 的表达来促进Cx43 的表达,从而改善心肌肥厚。RODRIGUEZ-SINOVAS 等[20]发现HSP90 与Cx43 结合,通过TOM20 途径促进Cx43 线粒体易位,发挥其心脏保护功能。Cx43 的折叠与组装也依赖于HSP90[21-22]。STIP1(也称为HSP70-HSP90 组织蛋白或HOP)作为热休克蛋白HSP70 和HSP90 之间相互作用的介质,参与客户蛋白形成成熟的结构蛋白[23],另一项研究[24]表明,STIP1 可防止缺血介导的细胞凋亡,具有神经保护作用,XIN 等[6]发现大鼠心肌H9c2 细胞进行缺氧复氧处理后,STIP1的表达明显降低。故本研究通过建立大鼠心脏Langendroff 离体灌注模型,采用Mapping Lab 矩阵式电生理标测系统检测了心室肌表面传导方向及速度,并应用Western blot 和免疫组化检测STIP1及Cx43 蛋白的表达和分布情况,以探讨低温缺血再灌注心律失常的发生及Cx43 表达下调是否与STIP1 有关。
本研究结果表明,C 组8 只大鼠持续灌注期间均未发生心律失常,而IR 组,再灌注期间心律失常发生率较高,室早和室颤均有发生,该结果进一步证实再灌注心律失常是缺血再灌注较为常见的并发症,与BERNIKOVA 等[25]研究发现一致。另IR 组在T2、T3的HR 和心室壁CV 均显著减慢,并伴随传导方向的改变,该结果电传导的改变可能因缺血再灌注后心肌损伤引起心肌细胞间缝隙连接通道的Cx43 减少使缝隙连接电阻增加所致。通过Western blot 和免疫组化进一步验证,IR 组相比C 组,STIP1 及Cx43 蛋白水平的表达均明显下调,另C 组中,可见Cx43 阳性着色的棕黄色颗粒在心肌闰盘处呈规律分布并表达量较多,而IR 组Cx43蛋白的分布出现从心肌细胞间的端端转向侧侧连接的偏侧化现象,说明低温缺血再灌注后STIP1低表达可能影响了Cx43 的表达和分布,从而影响心肌细胞间离子通道功能,引起心室肌电传导的改变。根据上述结果推测低温全心缺血再灌注后,心室肌电传导减慢、传导方向改变,这可能与低温缺血再灌注后心室肌STIP1 表达下调致Cx43表达减少有关。本研究结果为RA 中Cx43 的低表达提供了一个可能的解释,其机制仍需进一步研究。
综上所述,低温缺血再灌注心律失常大鼠心室肌Cx43 下调可能与STIP1 的下调有关,STIP1 可能通过调节Cx43 表达影响低温缺血再灌注后心室肌电传导,STIP1 可能是探究再灌注心律失常的新靶点。
