METTL3/AMPK通路在七氟烷诱发小鼠认知功能损伤中的作用
2023-02-17钟照明曹磊姚立群黄永珍
钟照明 曹磊 姚立群 黄永珍
海南省中医院麻醉科(海口 570203)
七氟烷(sevoflurane,SEV)是儿童最常用的麻醉剂之一,可能导致神经元凋亡、突触缺陷、神经炎症、Tau 磷酸化、髓鞘形成的破坏以及认知障碍[1-2]。尽管许多研究发现SEV 麻醉会导致大脑各个区域的基因表达发生巨大变化,但是否会发生信使RNA 水平的转录后调节尚不清楚。mRNA可以进行各种不同的化学修饰,包括N6 位腺苷的甲基化,从而导致N6-甲基腺苷(N6-methyladenosine,m6A)的形成[3]。m6A 是成人大脑中最丰富的可逆mRNA 修饰[4-5]。越来越多的证据表明,m6A RNA 甲基化在RNA 的产生/代谢中起着至关重要的作用,并参与了多种疾病的发病机制[6]。m6A 甲基转移酶(methyltransferase-like protein 3,METTL3)作为m6A RNA 甲基化的关键调节酶,已发现其在中枢神经系统中发挥多种生物学作用,例如调节轴突引导,并且METTL3 在脊髓连合神经元中的特异性消融导致预交叉轴突引导缺陷并导致学习缺陷和记忆[7]。然而,METTL3 是否参与SEV 诱发的认知功能损伤尚未明确。因此,本研究建立了SEV 损伤大鼠模型,以证实METTL3 在诱发的认知功能损伤上的意义,并对其潜在机制进行探索。
1 材料与方法
1.1 动物和治疗 体质量18 ~ 22 g(8 周龄)的C57BL/6小鼠购自南京大学模式动物研究所。动物在受控条件[(22 ± 2)℃,12∶12 h 光照:黑暗循环]下分组饲养,自由饮水和食物,并允许在实验开始前适应实验室条件至少1 周。交配时雌雄比例为2∶1。出生后6 d 小鼠随机分为两组(每组8 只):对照组(Ctrl)和SEV 组。SEV 组小鼠在出生后第6、7 和8 天用3%SEV 在湿润的20%氧气载气中进行麻醉,每天2 h,持续3 d。对照组中的新生小鼠在相同的腔室中仅以相同的流速接受20%的氧气。基于先前的研究[8],这些经SEV 处理或未长大至出生后65 d 的新生小鼠被定义为成年小鼠。此外,为了考察METTL3 敲低对SEV 诱发的认知功能损伤的影响,将出生后6 d 小鼠随机分为4 组(每组8 只):Ctrl+sh-NC 组、SEV+sh-NC 组、Ctrl+sh-METTL3 组和SEV+sh-METTL3 组。SEV+sh-NC 组和SEV+sh-METTL3 组在出生后第6、7、8 天用3%SEV 在湿润的20%氧气载气中进行麻醉,每天2 h,持续3 d,并在出生后第9 天注射sh-METTL3 病毒。Ctrl+sh-NC 组和Ctrl+sh-METTL3 组出生后第6、7 和8 天以相同的流速接受20%的氧气,并在出生后第9 天注射sh-NC 病毒。研究经本院伦理委员会批准同意(批件号:20190526)。
1.2 病毒包装和立体定向注射 CMV-METTL3 shRNA(sh-METTL3)和METTL3 过表达腺相关病毒由山东维真生物科技有限公司构建和包装。对于sh-METTL3 病毒包装,合成小鼠METTL3 的shRNA序列(5'-GATCCGGGCAGGACAAAGCAATATTGTTCAAGAGACAATATTGCTTTGTCCTGCCCTTTTTTA-3')并克隆到pAV-U6-GFP 质粒中以产生pAV-U6-eGFP-METTL3 shRNA。 Scramble 腺相关病毒作为对照病毒(sh-NC)。通过定量PCR测定的基因组滴度为4.72×1013TU/mL。对于METTL3过表达,合成小METTL3的编码序列并克隆到PAG-CAG-eGFP 质粒中以产生PAG-CAG-METTL3-P2A-eGFP。产生eGFP 质粒病毒作为对照病毒(Vector)。通过碘克沙醇逐步梯度超速离心纯化病毒颗粒。通过定量PCR 测定的基因组滴度为4.68×1013TU/mL。
对于病毒注射,通过腹膜内注射用氯胺酮(100 mg/kg)和甲苯噻嗪(8 mg/kg)麻醉小鼠并置于立体定向框架中。通过玻璃微量移液器以缓慢的速率(10 nL/min)。动物实验中,幼鼠在SEV 麻醉后第9 天注射病毒(100 nL)。所有小鼠的Morris水迷宫试验均为在出生后第65 天进行。
1.3 Morris 水迷宫测试 在SEV 暴露和其他实验之后,通过使用如前所述的Morris 水迷宫测试在出生后60 ~ 65 d 评估空间记忆[9]。圆形黑色水池(直径:120 cm;深度:21 cm)用不透明的水填充,使用白色无毒墨水达到平台表面(直径,10 cm)以上1.0 cm,水温保持在22 ℃。在训练阶段,所有动物每天接受4 次训练试验,总共4 d。将老鼠放在一个特殊的起始位置的水池中,让它们在60 s 内发现隐藏的平台。如果小鼠在1 min 内无法找到平台,则将其引导至平台。记录延迟时间(到达隐藏平台的时间)以评估空间学习。在测试阶段,移去平台,让每只老鼠在水池中自由游泳2 min。记录平台穿越时间和象限时间以测量记忆功能。
1.4 组织收获 在Morris 水迷宫测试后第65 天收获小鼠的脑组织。用2%戊巴比妥钠(40 mg/kg,i.p.)麻醉动物的大脑。然后,切开右心房并用肝素化的0.9%盐水和4%甲醛进行经心灌注。提取脑组织并在4%甲醛中固定过夜,在含15%蔗糖的0.1 mmol/L 盐缓冲液(pH 7.4)中固定24 h,然后在含30%蔗糖的0.1 mmol/L 磷酸盐缓冲液中固定48 h。
1.5 高尔基染色 使用Hito Golgi-Cox OptimStainTMPreKit(美国Hitobiotec Corp 公司)在齿状回(dentate gyrus,DG)中研究神经元树突和树突棘的形态。处死后获得脑组织。用等体积的溶液A 和B浸渍脑组织,避光保存(室温,2 周)。然后,将脑组织转移到溶液C 中在4 ℃黑暗中储存72 h。使用冷冻切片机生成脑切片(100 μm)。使用溶液C 将每个切片固定在涂有明胶的显微镜载玻片上,然后让切片在室温下自然干燥3 d。使用Olympus BX61 荧光显微镜(日本Olympus 公司)观察海马DG 亚区的树突。
1.6 蛋白质免疫印迹 使用RIPA 缓冲液(上海Beyotime 公司)和1×蛋白酶抑制剂混合物(上海Beyotime 公司)对不同组的海马组织进行匀浆。通过离心(12 000 ×g,20 min)收集上清液,并通过二辛可宁酸蛋白质测定试剂盒(上海Beyotime 公司)测量蛋白质浓度。通过SDS-PAGE 分离50 μg 蛋白质的等分试样并转移到硝酸纤维素膜上,然后用磷酸盐缓冲盐水(PBS,pH 7.4)中的5%脱脂牛奶封闭。将膜与针对METTL3(1∶1 000)、BDNF(1∶500)、FTO(1∶1 000)、METTL14(1∶500)、WTAP(1∶500)、YTHDF2(1∶1 000)、p-AMPK(1∶800)、AMPK(1∶800)和微管蛋白α(1∶10 000,均购自美国Abcam 公司)一抗在4 ℃下孵育过夜。在室温下将印迹在辣根过氧化物酶偶联的兔IgG(1∶5 000;美国CST 公司)二抗中孵育2 h。图像由VersaDoc 4000MP 系统(美国Bio-Rad 公司)捕获,条带密度用自带Quantity One 软件分析。
1.7 斑点印迹法分析mRNA m6A 甲基化 参照文献方法进行mRNA m6A 甲基化的斑点印迹分析[10]。使用Trizol 方法分离总RNA,并使用GenEluteTMmRNA Miniprep Kit(美国Sigma 公司)富集mRNA。通过NanoDrop 2000 测量mRNA 的浓度和纯度。通过在95 ℃下加热5 min 使mRNA 变性,然后立即在冰上冷却。将mRNAs(100 ng)直接点样到带正电荷的尼龙膜(美国GE Healthcare 公司)上并风干5 min。然后将膜用5%脱脂牛奶在TBST 中封闭,在4 ℃下与抗m6A 抗体孵育过夜。将HRP缀合的抗兔IgG 二抗在室温下加入膜中2 h,用增强的化学发光显色。亚甲蓝染色用于验证膜上是否发现了等量的mRNA。
1.8 细胞培养和分组 本研究中使用的小鼠海马神经元细胞系(HT-22)获自上海汇盈生物科技有限公司,接种在含有10%(v/v)FBS 的Dulbecco's Modified Eagle's Medium(DMEM,美国Hyclone 公司)中培养。将细胞分为Vector 组和METTL3 组,分别转染Vector 或METTL3 质粒,并在转染48 h 后收集细胞进行相关测试。
1.9 双荧光素酶测定 将萤火虫荧光素酶报告基因与海肾报告质粒共转染到HT-22 细胞中4 h。用Vector 或METTL3 质粒转染48 h。使用Dual-Luciferase®Reporter Assay System(美国Promega 公司)测量萤火虫和海肾萤光素酶活性。
1.10 mRNA 稳定性分析 参照文献方法进行mRNA 稳定性分析[11]。HT-22 细胞用5 μg/mL 放线菌素D(美国Sigma-Aldrich 公司)处理以抑制整体mRNA 转录。分别在处理后3、6 和9 h 收集细胞,用于RNA 提取和逆转录。通过qPCR 定量AMPK mRNA 水平。
1.11 统计学方法 所有数据均使用SPSS 18.0 软件进行分析,并表示为均数±标准差。使用非配对Student'st检验分析两组之间的差异,并通过重复测量的单因素或双向方差分析分析多组之间的差异,然后进行Bonferroni 事后检验。P< 0.05 认为差异有统计学意义。
2 结果
2.1 SEV 会损害新生小鼠的空间记忆 与对照组相比,SEV 组小鼠在Morris 水迷宫试验中具有更长的逃避潜伏期,较低的平台穿越时间和更短的象限时间(P<0.01,图1A-D)。树突棘充当突触强度的存储位点,并帮助将电信号传输到神经元的细胞体。树突棘的数量被认为是衡量神经元活动的有效方法。研究通过高尔基染色确定了两组树突棘数量,SEV 组海马DG 区树突棘的数量显著低于Ctrl 组(P<0.01,图1E-F)。

图1 SEV 损害新生小鼠的空间记忆并减少海马神经发生Fig.1 SEV damaged the spatial memory of newborn mice and reduced hippocampal neurogenesis
2.2 SEV 增加海马中的m6A 水平 斑点印迹分析显示暴露于SEV 的小鼠海马组织中m6A 水平显著增加(P< 0.01,图2A)。同时,去甲基化酶FTO水平显著下降(P<0.05),而甲基转移酶METTL3、METTL14、WTAP 和结合蛋白YTHDF2 水平显著增加(P<0.05,图2B)。
2.3 SEV诱导的年轻小鼠认知缺陷需要METTL3 sh-METTL3 在小鼠中消除了METTL3 蛋白的表达(图3A)。在接受sh-NC 病毒的小鼠中,与Ctrl 组相比,SEV 组小鼠在Morris 水迷宫试验中具有更长的逃避潜伏期,较低的平台穿越时间和更短的象限时间(P<0.01)。与sh-NC+SEV 组相比,sh-METTL3+SEV 组逃避潜伏期显著缩短,平台穿越时间和象限时间显著增加(P< 0.05,图3B-E)。此外,在接受sh-NC 病毒的小鼠中,与Ctrl 组相比,SEV 组小鼠DG 区树突棘的数量和BDNF 表达均显著降低(P< 0.01)。与sh-NC+SEV 组相比,sh-METTL3+SEV 组DG 区树突棘的数量和BDNF 表达均显著增加(P<0.05,图3F-G)。

图3 SEV 诱导的年轻小鼠认知缺陷需要METTL3Fig.3 METTL3 was needed for SEV-induced cognitive impairment in young mice
2.4 METTL3上调抑制海马中的AMPK通路 与Ctrl 组相比,SEV 组小鼠海马中AMPK 表达显著降低(P<0.01)。与sh-NC+SEV 组相比,sh-METTL3+SEV 组海马中p-AMPK 表达显著增加(P< 0.05)(图4)。体外研究中,METTL3 过表达质粒显著增加了HT-22 细胞中的m6A 水平(P< 0.01,图5A),同时显著增加了METTL3 的表达并降低了BDNF和p-AMPK 表达(P< 0.05,图5B)。AMPK 3'UTR报告荧光素酶测定显示,METTL3 上调显著降低了含有AMPK 3'UTR 的构建体的荧光素酶活性(P<0.05),这些m6A 位点(A 到T)的突变导致荧光素酶活性显著增加(P< 0.05),并对METTL3 上调作用产生抗性(图5C)。此外,METTL3 上调显著降低了AMPK mRNA 稳定性(P<0.05,图5D)。

图4 蛋白质印迹检查DG 亚区AMPK 表达Fig.4 The expression of AMPK in DG subregion was examined by protein blotting
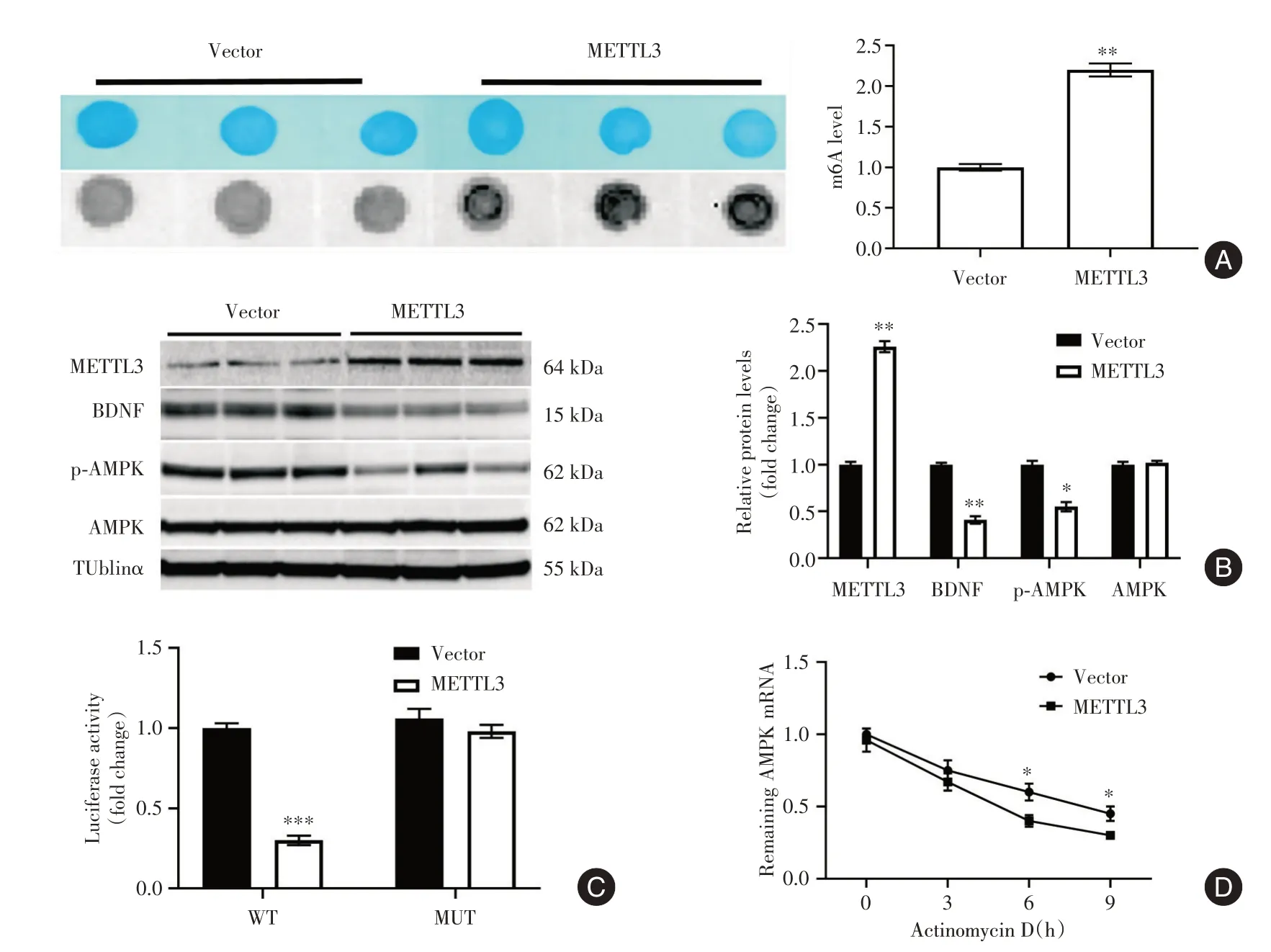
图5 METTL3 上调增加AMPK 3'UTR 中的m6A 修饰并降低HT-22 细胞中的AMPK mRNA 稳定性(n=3)Fig.5 Up-regulation of METTL3 increased m6A modification in AMPK 3'UTR and decreased the stability of AMPK mRNA in HT-22 cells(n=3)
3 讨论
有明确的证据表明,生命早期麻醉暴露与随后持续神经行为缺陷的风险增加之间存在联系[12]。本研究对P6-P8 小鼠进行每天2 h 的3%SEV 麻醉,并在小鼠成年期观察到认知缺陷。在许多动物模型中报告了类似的行为改变,包括从1~3 周龄暴露于SEV 的C57BL/6 小鼠,以及Wistar大鼠从出生后第4 天暴露于SEV 3 d,均表现出焦虑样行为增加和认知障碍[13-14]。因此,SEV 会损害新生小鼠的认知功能。此外,本研究发现SEV 增加小鼠海马中的m6A 水平,同时伴随着FTO 减少和METTL3、METTL14 和WTAP 增加。这些结果提示m6A 甲基化增加和SEV 暴露诱导小鼠认知行为受损之间可能存在联系。
m6A 甲基化在调节应激反应和大脑功能中发挥重要作用[4]。研究表明,m6A RNA 甲基化在AD中异常高,这归因于METTL3 水平升高和FTO 受损[15]。还有研究报道海马METTL3 异常表达不利于小鼠的长期记忆维持和巩固,其可能通过m6A RNA 甲基化减弱神经元早期反应基因的翻译[16]。本研究利用METTL3 shRNA 病毒来改变METTL3在海马中的表达。METTL3 沉默病毒减轻了SEV引起的年轻小鼠空间记忆障碍,并改善了DG 区树突棘的数量和BDNF 表达。BDNF 在大脑中的表达可能有助于脑损伤后的保护和再生作用[17]。已显示树突棘数量受BDNF 表达的影响[18]。目前的研究结果进一步强调METTL3 是SEV 诱导的对年龄敏感的学习能力障碍的易感性所必需的。
m6A RNA 甲基化控制与记忆和学习功效以及神经元分化相关的基因的表达和形态发生。然而,作为一种新发现的表观遗传调控方法,m6A RNA 甲基化可能是SEV 暴露中一小部分基因表达抑制的原因。值得注意的是,m6A 在5'UTR 而不是在3'UTR 或其他区域的富集,在调节基因表达中起重要作用。5'UTR 处的m6A 残基通过规避m7G 帽要求[19],实现了翻译起始的帽独立模型,而成熟多腺苷酸化mRNA 的3'末端m6A 的富集与另一种多腺苷酸化相关[20]。因此,笔者推测在海马神经元细胞系统中,m6A 介导的翻译过程占据了最终基因表达的主导阶段。研究接下来探讨了METTL3 对可能参与SEV 诱导认知行为受损相关靶点的影响。AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)充当能量传感器,其是蛋白激酶级联反应的下游组分,在维持能量稳态中起主要作用[21-22]。已经报道了AMPK 对酒精性肝损伤的保护作用[23]。此外,AMPK 过表达可改善老年大鼠的术后认知功能障碍[24-25]。本研究发现METTL3 沉默病毒逆转了SEV 引起的AMPK 表达降低,METTL3上调抑制HT-22细胞中AMPK、BDNF的表达。此外,AMPK 3'UTR 含有对METTL3 上调反应的功能性m6A 修饰位点,这些m6A 位点的高甲基化导致AMPK mRNA稳定性降低。本研究结果表明,METTL3 上调通过m6A 介导的AMPK mRNA稳定性的降低抑制BDNF 表达,从而导致海马依赖性记忆形成受损。
综上所述,本研究探讨了SEV 暴露导致小鼠认知功能损伤中的潜在机制,并发现SEV 暴露导致海马组织中m6A 水平和METTL3 增加。METTL3敲低减轻了SEV 诱导的幼鼠认知功能损伤,其可能通过m6A 介导的AMPK mRNA 稳定性的降低导致海马依赖性记忆形成受损。本研究为N6 甲基腺苷修饰在麻醉诱导的神经毒性中的作用提供数据支持,需要进一步了解N6 甲基腺苷修饰在麻醉相关行为缺陷中的作用机制。
