软枣猕猴桃休眠芽超低温保存技术
2023-02-17黄淑华本溪市林业发展服务中心辽宁本溪117000
●黄淑华(本溪市林业发展服务中心 辽宁 本溪 117000)
软枣猕猴桃俗称软枣子、猕猴梨,是猕猴桃科猕猴桃属藤本落叶植物,果实营养价值极高,且具有较高的经济价值、药用价值。当前软枣猕猴桃常规繁殖方法为种子繁殖、组织培养、扦插与嫁接,其中组培具有生根率高、成活率高、优良性状多的特点,但是,因组培出瓶炼苗期间缺乏适宜的休眠芽保存环境,对组培效果造成了较大的负面影响。 为解决休眠芽保存问题,提高软枣猕猴桃组培出瓶炼苗效果,对休眠芽超低温保存进行研究。
1 材料与方法
1.1 材料
软枣猕猴桃休眠芽采自中国农业科学院特产研究所软枣猕猴桃种质资源圃。0.1%氯化汞、5%次氯酸钠、无菌水、0.3~0.7 mol/L 蔗糖、MS(有机硅改性聚醚胶)、1~2 mol/L 甘油、0.5 mol/L 山梨醇、15%乙二醇、7%~15%二甲基亚砜、15%聚乙二醇、Partec HR-A溶液(分离细胞核的柠檬酸)、Partec HR-B溶液(分离细胞核的柠檬酸)等。
1.2 试验设计
在实验室环境进行以下操作。
1.2.1 剥休眠芽依据再生能力强、遗传稳定、成活率高的标准,选择采摘于12月中下旬到1月中下旬的休眠枝条(25年生软枣猕猴桃树),利用湿毛巾包裹枝条剪口并存放到4℃冰箱内。
1.2.2 预培养根据休眠芽在生理状态(抗冻性)改善需求,利用预培养方法,进行材料处理。其中,预培养主要是在蔗糖高渗培养液(或山梨醇高渗液、甘油高渗液、二甲基亚砜高渗液)内,调整环境温度在23~27℃,光照为12 h/d(双管冷白色荧光灯管),诱导休眠芽细胞脱水1~6 d,使休眠芽组织细胞内自由水含量下降到较低的水平,促使休眠芽抗冻性提升[1]。
1.2.3 冻存在室温下,用0.4 mol/L 蔗糖、MS、2 mol/L 甘油配制高浓度混合装载液(或0.5 mol/L山梨醇、2 mol/L甘油、15%聚乙二醇、7%二甲基亚砜、0.6 mol/L 蔗糖、MS),装载 10~60 min,降低软枣猕猴桃休眠芽组织细胞自由水含量。在室温(23~27℃)下,用0.5 mol/L山梨醇、2 mol/L甘油、15%乙二醇、7%二甲基亚砜、15%聚乙二醇、0.4 mol/L蔗糖、MS配制玻璃化液A;若温度低于0℃,则利用15%乙二醇、0.4 mol/L蔗糖、MS、15%二甲基亚砜配制玻璃化液B(植物玻璃化保护液),无菌调节下浸入软枣猕猴桃休眠芽,进一步提高软枣猕猴桃休眠芽的抗冻性。脱水处理后更换新鲜的玻璃化液,并在无菌条件下将软枣猕猴桃休眠芽转入2 mL冻存管内,每管10芽,将其浸入液氮中,冻存24 h。或者将脱水后的软枣猕猴桃休眠芽放入铝箔条上玻璃化液滴内进入液氮保存24 h及以上,促使软枣猕猴桃休眠芽进入生机停顿状态。
1.2.4 解冻培养在37~40℃温水中(一般为38℃),水浴处理软枣猕猴桃休眠芽2 min,使其在短时间内升高温度并通过冰晶生长区,规避软枣猕猴桃休眠芽细胞内再次结冰而死亡。解冻后利用1.2 mol/L蔗糖、MS配制而成的卸载液处理软枣猕猴桃休眠芽20~30 min,卸除软枣猕猴桃休眠芽细胞内存在毒害作用的玻璃化液[2]。随后利用2 mg/L 6-BA(6- 苄氨基嘌呤)、GA3(赤霉素)、0.02 mg/L NAA(萘乙酸)配制培养基(或者 MS、0.01 mg/L NAA、1 mg/L 6-BA),暗处培养3~8 d,促进软枣猕猴桃休眠芽修复,提高软枣猕猴桃休眠芽的生长速度。
1.3 测试方法
1.3.1 倍性鉴定方法以未应用超低温保存技术的软枣猕猴桃休眠芽发育的植株为对照,鉴定应用超低温保存技术后的软枣猕猴桃休眠芽发育成植株倍性[3]。即在洁净的培养皿内放入1 cm2幼嫩叶片,加入0.1 mL 的 Partec HR-A 裂解液,利用无菌刀片破碎软枣猕猴桃休眠芽组织,处理5 min。裂解处理后,将软枣猕猴桃休眠芽组织经100 μm孔径的滤网过滤到小试管内,向试管内加入 1.6 mL 的 Partec HR-B 溶液,暗处理 2 min,在Partec倍性分析仪内分析软枣猕猴桃休眠芽发育的植株倍性水平。
1.3.2 成活率测试方法为判定预培养液对软枣猕猴桃休眠芽成活率的影响,其他因素不变(预培养时间2 d、装载时间20 min,玻璃化溶液B),以蔗糖、甘油为渗透保护物质,调整蔗糖浓度、甘油浓度。
为判定预培养时间对软枣猕猴桃休眠芽成活率的影响,其他因素一定(蔗糖浓度为0.3 mol/L、甘油浓度为1 mol/L,装载时间20 min,玻璃化溶液B),调整软枣猕猴桃休眠芽预培养时间分别为2,3,4,5,6 d。
为判定装载时间对软枣猕猴桃休眠芽成活率的影响,其他因素一定(蔗糖浓度为0.3 mol/L、甘油浓度为1 mol/L,预培养时间2 d,玻璃化溶液B),调整软枣猕猴桃休眠芽装载时间分别为10,20,30,40,50 min。
为判定玻璃化保护液对软枣猕猴桃休眠芽成活率的影响,其他因素一定(蔗糖浓度为0.3 mol/L、甘油浓度为 1 mol/L,预培养时间 2 d,装载时间20 min),分别在玻璃化溶液A、玻璃化溶液B内处理软枣猕猴桃休眠芽。
2 结果与分析
2.1 倍性鉴定结果
倍性鉴定结果表明:软枣猕猴桃休眠芽低温处理前后的染色体倍性均为二倍体(58)。
2.2 成活率测试结果
当预培养时间、装载时间一定,而蔗糖浓度与甘油浓度变化时,软枣猕猴桃休眠芽成活率变化,见表1。
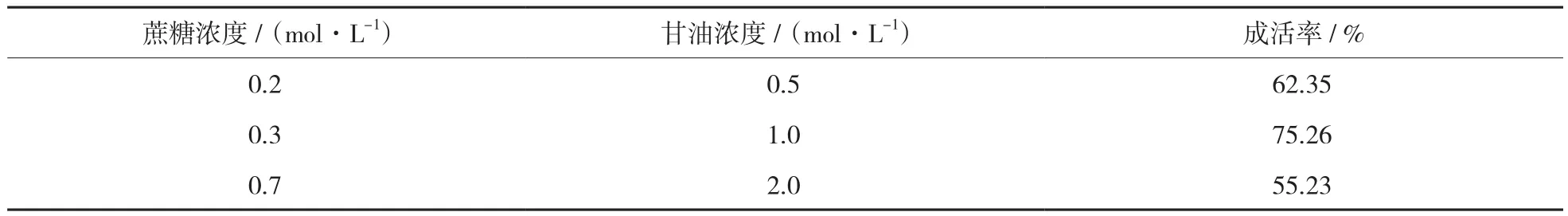
表1 不同蔗糖浓度与甘油浓度下软枣猕猴桃休眠芽成活率
由表1可知,蔗糖浓度与甘油浓度对软枣猕猴桃休眠芽成活率具有一定影响。软枣猕猴桃休眠芽成活率随着蔗糖浓度、甘油浓度的升高先上升后下降,在蔗糖浓度为0.3 mol/L、甘油浓度为1.0 mol/L时,软枣猕猴桃休眠芽成活率最高。
当蔗糖浓度与甘油浓度、装载时间一定,而预培养时间变化时,软枣猕猴桃休眠芽成活率变化,见表2。

表2 不同预培养时间下软枣猕猴桃休眠芽成活率
由表2可知,预培养时间对软枣猕猴桃休 眠芽成活率具有较大影响。随着预培养时间的延长,软枣猕猴桃休眠芽成活率不断下降。在预培养时间为2 d时,软枣猕猴桃休眠芽成活率最高。
当蔗糖浓度与甘油浓度、预培养时间一定,而装载时间变化时,软枣猕猴桃休眠芽成活率变化,见表3。

表3 不同装载时间下软枣猕猴桃休眠芽成活率
由表3可知,装载时间对软枣猕猴桃休眠芽成活率的影响较大。装载时间为20 min时,软枣猕猴桃休眠芽成活率最高。
在玻璃化溶液A处理下,软枣猕猴桃休眠芽成活率为43.25%;玻璃化溶液B下,软枣猕猴桃休眠芽成活率为75.26%,表明玻璃化溶液B更适用于软枣猕猴桃休眠芽超低温处理。
3 结论
通过对比应用超低温保存技术前后的软枣猕猴桃休眠芽发育的植株倍性水平,得出两者染色体倍性水平一致,表明超低温冷冻保存技术不会影响软枣猕猴桃休眠芽发育倍性水平。
当蔗糖浓度为 0.3 mol/L、甘油浓度为 1.0 mol/L时,软枣猕猴桃休眠芽成活率可以达到75.26%,调高或调低蔗糖与甘油浓度均会导致软枣猕猴桃休眠芽成活率下降。当蔗糖浓度为0.7 mol/L、甘油浓度为2.0 mol/L时,软枣猕猴桃休眠芽成活率最低,为55.23%,可能是由于甘油、蔗糖作为渗透保护物质对休眠芽产生渗透胁迫,破坏软枣猕猴桃休眠芽组织结构,致使组织细胞丧失活性。
预培养时间为2 d时,软枣猕猴桃休眠芽成活率最高,为75.26%。随着预培养时间的延长,软枣猕猴桃休眠芽成活率下降。预培养时间为6 d时,软枣猕猴桃休眠芽成活率下降到6.89%,这可能是由于长时间培养致使休眠芽解除休眠时间提前,在后续低温处理时失去活性,无法顺利发芽。
装载时间为20 min时,软枣猕猴桃休眠芽成活率最高,为75.26%。在装载时间为50 min时,软枣猕猴桃休眠芽成活率最低,为30.20%。在装载时间为10,30,40 min时,软枣猕猴桃休眠芽成活率分别为70.01%,61.20%,51.27%,表明装载时间对软枣猕猴桃休眠芽成活率具有较大影响。在后续软枣猕猴桃休眠芽处理技术研究时,应进一步缩短装载间隔,确定软枣猕猴桃休眠芽发芽率最高时对应的精确装载时间。
玻璃化溶液B可以提高软枣猕猴桃休眠芽低温处理成功率,改善软枣猕猴桃休眠芽低温处理时可溶性固形物下降的情况,提高软枣猕猴桃休眠芽发芽率,可在后续软枣猕猴桃休眠芽低温处理时大规模应用。
综上,软枣猕猴桃休眠芽超低温保存技术具有操作便捷、成功率高的特点,对仪器无特殊要求,且处理工序较少,可以确保处理后软枣猕猴桃成活率处于较高水平。因此,在软枣猕猴桃组培期间,可以采用超低温保存休眠芽技术,将源于软枣猕猴桃植物的休眠芽放入预培养液中无菌装载,进而在0℃以下环境内冻存,冻存后水浴解冻培养,提高软枣猕猴桃组培成功率。
