EMS诱变对谷子萌发及幼苗生长的影响
2023-02-17闫锋
闫 锋
(黑龙江省农业科学院齐齐哈尔分院,黑龙江齐齐哈尔 161006)
谷子(Setariaitalica)起源于我国,据考古遗存证明谷子在我国已经有7 000多年的栽培历史,在我国悠久的农耕文明中占有重要地位。谷子具有耐瘠薄、营养丰富、耐旱等优点,种植区域主要分布在黄河以北干旱、半干旱地区,是该地区重要的粮饲兼用作物[1-2]。长久以来我国谷子主产区生产上应用的品种不抗除草剂,田间除草主要依靠人工,费时费力,是限制谷子产业化发展的限制因素之一[3]。随着20世纪90年代,河北省农林科学院在世界上率先创制出并大力推广抗拿扑净、咪唑啉酮等不同抗性谷子除草剂品种(冀谷系列),我国谷子育种及谷子产业迎来了革命性的变革[4-5]。由于目前生产上推广应用的抗除草剂谷子品种多为夏谷,且生育期普遍较长,因此,选育适合春谷区种植的早熟抗除草剂春谷品种不仅能够为当地农民脱贫致富提供帮助,而且能够大力推进当地谷子产业发展。
在长期的人工种植驯化过程中,尤其是近几十年育种家们对谷子育种目标的趋同化,经过不断的人工选择,致使谷子遗传基础越来越狭窄,一些特异谷子资源慢慢消失。种质资源是生物多样性的重要组成部分,是新品种选育和种质创新的重要物质基础[6]。种质资源创新的手段有多种,传统的杂交、回交、系圃选择等方式,育种周期较长,且不易选择到目标性状。化学诱变开始于20世纪初期[7],氮化钠(NaN3)、甲基磺酸乙酯(EMS)、秋水仙素等化学药剂在作物诱变育种中得到广泛应用[8]。其中,EMS是一种最常用的烷化剂,可直接使鸟嘌呤N-7的位置发生改变,从而导致DNA结构产生诱变效果,EMS诱变不仅具有突变频率高的优点,而且使用成本较低、操作简单[9]。目前,已经在藜麦、水稻、玉米、大豆等多种作物诱变育种中得到广泛应用,对推动作物遗传改良和资源创新起到了重要作用[10]。
目前,有关谷子EMS诱变效应方面的研究报道较少。李颜方等对晋谷21进行不同浸种浓度及时间的诱变处理,结果表明,晋谷21号种子的发芽势与发芽率均随着EMS浓度的增大而降低,且茎长和胚根长受抑制,最终确定1.0% EMS处理10 h为晋谷21号种子的最佳诱变条件;M1代植株出现白化苗、黄化苗、分蘖等现象[11]。李伟等采用裂区试验设计,以诱变时间为主区,EMS浓度为副区,对豫谷1号种子进行诱变处理,研究发现豫谷1号的适宜诱变条件为清水浸种过夜,1.0% EMS处理8 h[12]。
公谷88因适口性好、产量高、外观品质佳,己成为吉林省的主栽谷子品种,但受生育期限制,难以在黑龙江地区推广。本研究以抗除草剂春谷品种公谷88为材料,拟通过研究不同浸种时间及EMS浓度对谷子萌发、幼苗生长、幼苗理化指标等产生的影响,从而确定公谷88的EMS诱变适宜条件,以期为创建谷子突变体库及拓宽中早熟春谷抗除草剂种质资源奠定基础。
1 材料与方法
1.1 供试材料与试剂
试验于2021年在黑龙江省农业科学院齐齐哈尔分院试验室进行,选取由吉林省农业科学院作物资源研究所选育的公谷88作为试验材料,该品种2019年通过国家非主要农作物品种登记,EMS诱变剂由美国麦克林公司生产。
1.2 试验设计
1.2.1 EMS处理方法 选取成熟度好的公谷88种子,用蒸馏水浸种3 h吸胀后沥干水分备用。用0.1 mol/L磷酸缓冲液(pH值为7.0)配制体积分数分别为0.4%、0.8%、1.2%的EMS溶液,以磷酸缓冲液为对照。每个处理取100粒吸胀后的种子,置于200 mL三角瓶中,每个瓶中加入50 mL不同体积浓度的EMS溶液,置于100 r/min的摇床中均匀摇晃6、10、14 h,重复3次。将诱变处理后的谷种置于水龙头下冲洗2 h,播种于直径为10 cm的塑料花盆中(每盆播10粒种子),播种深度为1.5 cm。然后将花盆置于湿度为60%、温度为28 ℃、光照—黑暗比为10 h—14 h的人工气候培养箱内,发芽期间各处理浇水量一致。
1.2.2 种子发芽及幼苗形态指标测定 播种5 d后调查各处理发芽势、10 d后调查发芽率,出苗 10 d 后在各处理中随机挑选10株幼苗测量茎长、根长。出苗20 d后统计成苗率,计算公式如下:
发芽势=播种5 d后发芽数/供试种子总粒数×100%;
发芽率=播种10 d后发芽数/供试种子数×100%;
成苗率=成活苗数/供试种子数×100%。
1.2.3 电导率的测定 取每个诱变处理后的种子50粒,称质量,用自来水冲洗2 h后,置于小烧杯中,倒入 10 mL 蒸馏水浸泡,30 min后测定种子浸出液电导率,以空白蒸馏水为对照。
1.2.4 生理指标测定 出苗5 d后选取幼苗第1张叶片进行各项理化指标的测定。超氧化物歧化酶(SOD)活性采用氮蓝四唑法进行测定[13],过氧化物酶(POD)活性采用愈创木酚法进行测定[14],丙二醛(MDA)含量采用硫代巴比妥酸法测定[15]。
1.2.5 SPAD值测定 出苗后5 d在每个处理中随机选取10株幼苗,采用日本柯尼卡美能达公司生产的 SPAD-502 型测定仪测定谷子第1张叶片的叶绿色相对含量(SPAD值)。
1.2.6 半致死剂量的确定 参照王兆玉等的分析方法[16],对谷子成苗率与EMS浓度进行回归分析,计算不同处理时间下EMS浓度的半致死剂量。
1.3 数据分析
采用Excel 2007对试验数据进行统计及作图,采用DPS 7.05软件进行方差分析。
2 结果与分析
2.1 EMS处理对电导率的影响
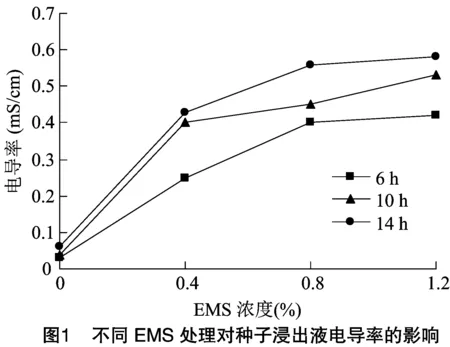
由图1可知,当EMS浓度为0时,种子浸出液电导率处于较低的水平(电导率<0.1 mS/cm),经过EMS处理后,种子浸出液电导率相比对照大幅升高,随着EMS浓度升高及浸种时间延长,电导率也随之增加,但是总体增长幅度有所放缓,6、10、14 h 3种浸种时间处理下,电导率均在EMS浓度为1.2%时达到最高,分别为0.43、0.56、0.58。说明随着EMS浓度增加及浸种时间延长,细胞质膜受害严重,细胞内物质渗漏。
2.2 EMS处理对谷子萌发的影响
2.2.1 EMS处理对发芽势的影响 由表1可知,随着浸种时间延长及EMS处理浓度增加,谷子种子的发芽势呈逐渐降低的变化规律,均显著低于对照,说明EMS对谷子种子萌发有抑制作用。在同一浸种时间下,不同浓度EMS处理之间谷子的发芽势存在一定差异。当处理时间为6 h时,EMS各浓度处理之间的发芽势均呈显著性差异;当浸种时间为10 h时,1.2% EMS处理下谷子的发芽势显著低于0.4% EMS处理和0.8% EMS处理,0.4% EMS处理和0.8% EMS处理之间差异不显著;当处理时间为14 h时,0.4% EMS处理与0.8% EMS处理间发芽势差异不显著,0.4%浓度处理下发芽势显著高于1.2%浓度处理。说明不同浸种时间及EMS浓度对谷子种子发芽势的影响不同。
2.2.2 EMS处理对发芽率的影响 由表1可知,不同浸种时间及EMS浓度对谷子发芽率有较大影响,其变化规律基本与发芽势相同,随着浸种时间延长及EMS浓度增加,发芽率逐渐降低。在同一浸种时间下,不同浓度EMS处理之间谷子的发芽率存在一定差异。当处理时间为6 h时,0.4% EMS处理的发芽率与对照差异不显著,但是显著高于0.8%、1.2% EMS处理;当浸种时间为10 h时,EMS各浓度处理之间的发芽率均呈显著性差异;当处理时间为14 h时, 0.8% EMS处理与1.2% EMS处理间发芽率差异不显著,但均显著低于0.4% EMS处理。
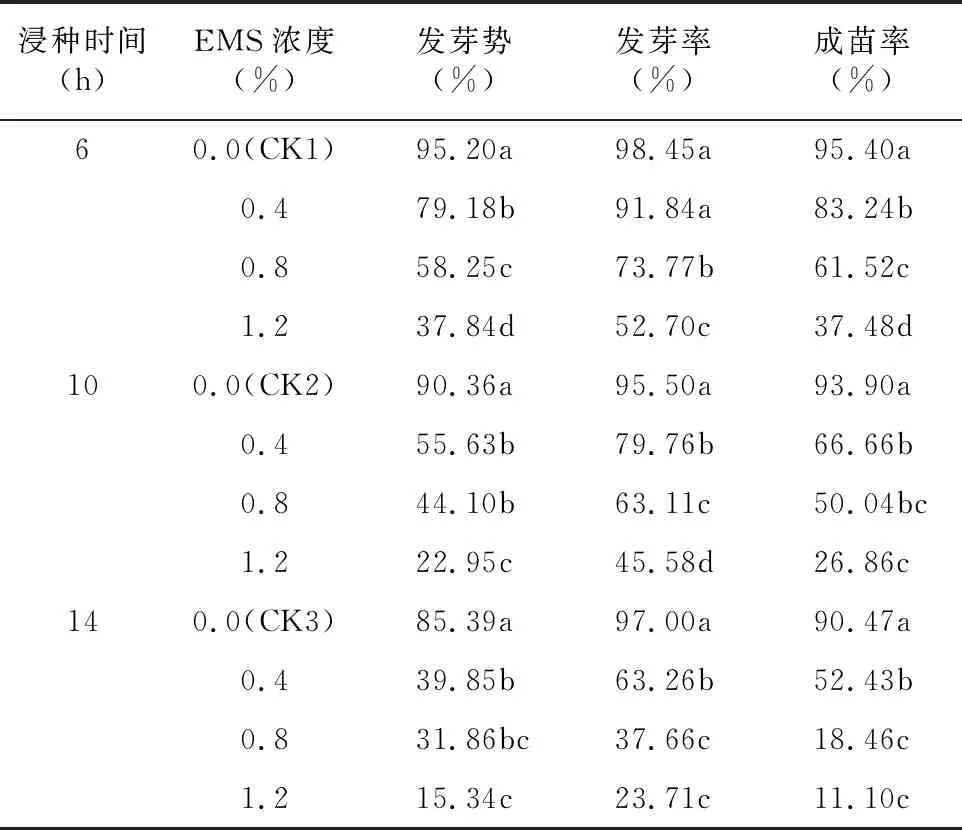
表1 EMS处理对谷子发芽的影响
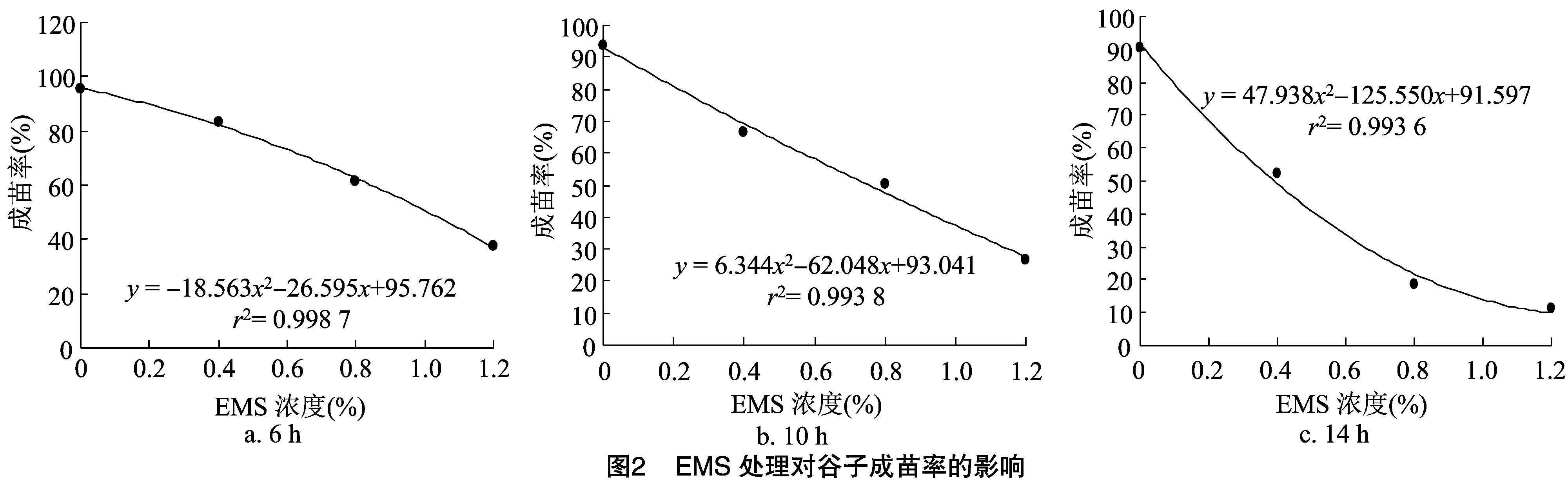
2.2.3 EMS对成苗率的影响及半致死剂量的确定 由图2可知,不同浸种时间及EMS浓度对谷子成苗率影响较大,其变化趋势与发芽率大体一致。不同浸种时间下,同一浓度EMS处理下谷子的成苗率存在一定差异。浸种14 h处理下,各EMS处理浓度下的成苗率均大幅低于浸种6 h及10 h处理。以成苗率为因变量(y),EMS浓度为自变量(x),通过回归方程(图2)统计出公谷88在浸种6、10、14 h下EMS处理的半致死剂量分别为1.01%、0.75%、0.39%。
2.3 EMS处理对谷子幼苗生长的影响
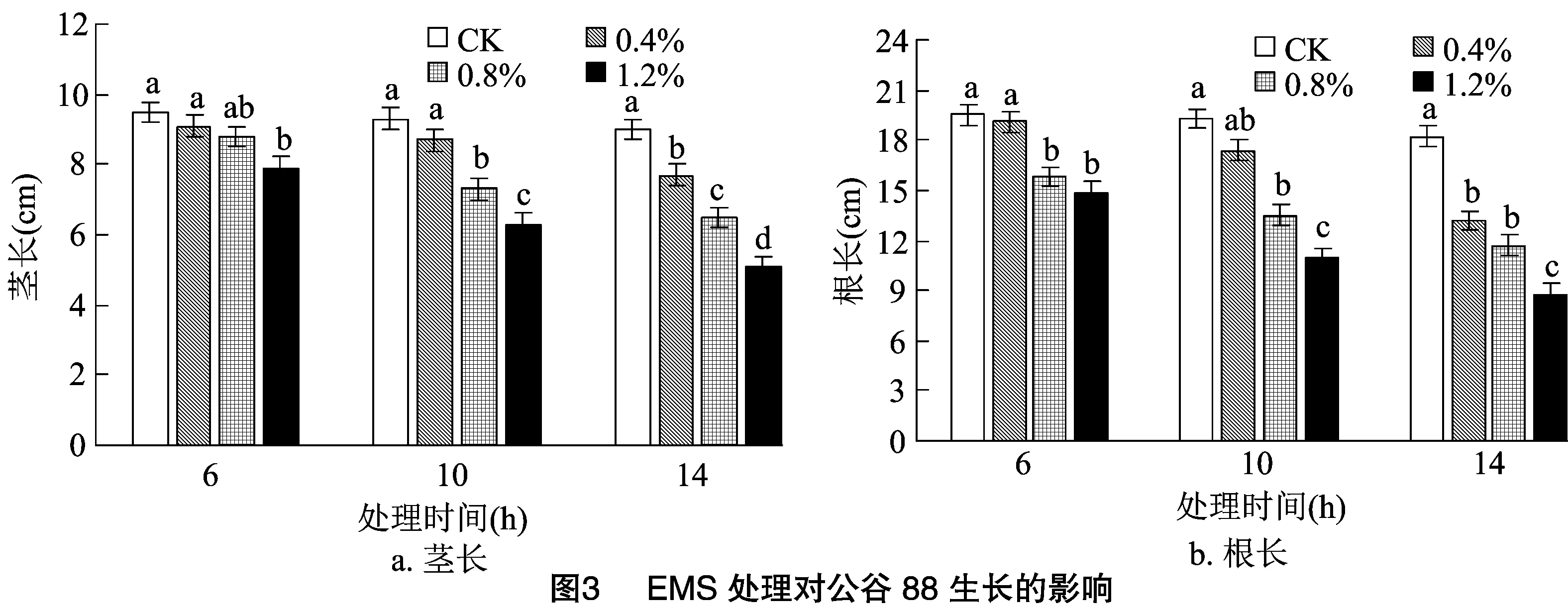
2.3.1 EMS处理对苗高的影响 由图3可知,谷子种子经过EMS处理后,茎长随着浸种时间的延长及EMS处理浓度的增加呈逐渐下降的趋势,但是在相同的浸种时间下,不同EMS处理之间茎长下降的程度不同,在6 h浸种时间下,只有1.2% EMS处理的茎长显著低于对照,另外2个处理与对照差异不显著;10 h浸种时间下,0.4% EMS处理的茎长与对照差异不显著,但显著高于其他2个处理;14 h浸种时间下,各EMS处理之间均呈显著性差异。由此随着浸种时间的延长及EMS处理浓度的增加,谷子地上部生长受到的抑制作用越来越大,1.2% EMS浸种14 h处理下的茎长最小,为5.1 cm,比对照降低43.3%。
2.3.2 EMS处理对根长的影响 谷子经过EMS处理后根长的变化规律与茎长大体一致(图3),总体来看谷子根长随着EMS浓度升高及处理时间延长逐渐受到抑制。在6 h和10 h浸种时间下,0.4%EMS处理下的根长生长受到抑制作用不显著,与对照差异不显著,但显著高于另外2个EMS处理;随着浸种时间延长,谷子根长受到抑制作用逐渐加大,10 h浸种时间下对照与各处理的根长达显著性差异。综合来看,1.2% EMS浸种14 h处理下的根长最小,为8.8 cm,比对照降低51.6%。
2.4 EMS处理对幼苗生理指标的影响
2.4.1 EMS处理对幼苗抗氧化酶活性的影响 由图4可知,经过EMS浸种处理后,同一浸种时间下谷子幼苗叶片中SOD活性变化规律并不一致,但随着EMS处理浓度的增加,总体呈逐渐上升的趋势,在浸种时间为6 h时,SOD活性呈逐渐上升的趋势,0.4% EMS处理下与对照差异不显著,但是显著低于其他处理。10 h和14 h浸种时间下,SOD活性呈先上升后下降的变化趋势,10 h浸种时间下,SOD活性在0.8% EMS处理下达到最高,但与1.2% EMS处理间差异不显著。14 h浸种时间下SOD活性在EMS浓度为0.4%时达到最高。总体来看随着浸种时间的延长SOD活性峰值出现的EMS浓度逐渐降低。
经过EMS处理后POD活性的变化规律与SOD大体一致(图4),同一浸种时间下,各EMS处理的POD活性均显著高于对照。6 h浸种时间下,POD活性随浸种浓度增加而升高,并在1.2% EMS处理下达到最大值。10 h浸种时间下,POD活性呈先升高后降低的变化规律,POD活性在EMS浓度为0.8%时达到最高,随后下降,但与1.2% EMS处理差异不显著。14 h浸种时间下,POD活性同样呈先升高后降低的变化规律,只是POD活性峰值出现在EMS浓度为0.4%时。
2.4.2 EMS处理对幼苗过氧化产物的影响 由图5可知,不同的浸种时间下,谷子幼苗叶片中MDA含量随着浸种时间延长及EMS浓度增加,均呈逐渐上升的变化趋势。6 h浸种时间下,0.4% EMS处理的MDA含量与对照差异不显著,但显著低于其他处理;10 h浸种时间下, 各处理间MDA含量均呈显著性差异;14 h浸种时间下,0.4%和0.8% EMS处理的MDA含量差异不显著。所有处理中浸种 14 h,浓度为1.2%时,MDA含量最高,为7.1 μmol/L,显著高于对照45.8%。
2.5 EMS处理对幼苗SPAD值的影响
叶绿素含量的消长规律是反映叶片生理活性变化的重要指标之一,与叶片光合能力有密切关系。由图6可知,随着浸种时间延长及EMS处理浓度增加,公谷88的SPAD值呈逐渐下降的趋势,除了0.4% EMS浓度下浸种6 h处理下的SPAD值与对照差异不显著外,其他处理均与对照呈显著性差异。在1.2% EMS浓度中浸种14 h的SPAD值最低,为19.4,比对照低40.7%。



3 讨论与结论
EMS诱变不仅能够抑制种子萌发,还会抑制幼苗生长。前人的研究结果表明,EMS浓度越高,其溶解的过程中产生的有机酸越多,对种子的毒害作用越强,但是在低浓度EMS处理下胁迫作用较弱[17]。浸种时间和浓度是决定诱变效果的关键因素,研究显示,不同物种对EMS的敏感度不同,这可能与种子的结构、种皮的透水性、种子的大小及种子内部的休眠机制有关。云娜等研究发现,以成苗率达半致死量为衡量标准,1.5% EMS浸种15 h和1.1% EMS浸种21 h可作为EMS诱变蒙农红豆草建立突变体库的适宜条件[18]。秦思思等的研究结果表明,EMS浓度为3.0%、处理时间为8 h时,其相对发芽率最接近半致死浓度的相对发芽率,为醉鱼草EMS诱变体库建立的适宜条件[19]。前人利用EMS对谷子也做过一些相应研究,长农35号和豫谷1号的EMS最佳诱变条件是1.0% EMS浸种 8 h[12,20],本研究以公谷88相对成苗率达到半致死剂量为标准,通过回归方程计算出公谷88在浸种时间6、10、14 h条件下EMS处理浓度的半致死剂量分别为1.01%、0.75%、0.39%,可作为EMS诱变谷子建立突变体库的适宜条件。
郭晓珊等对番茄种子进行6种EMS浓度处理,结果表明EMS处理对不同品种番茄的胚轴和胚根生长有明显的抑制作用[21]。伊风艳等用9种浓度EMS对苜蓿种子进行处理,结果表明,低浓度EMS对苜蓿幼苗高无显著影响,随着EMS处理浓度的升高,幼苗生长逐渐被抑制[22]。本研究分析结果显示,在0.4%EMS浓度下浸种6 h处理下公谷88幼苗的茎长、根长与对照差异不显著。随着EMS浓度的增加及浸种时间延长,谷子幼苗生长逐渐受到抑制,1.2%EMS浓度下浸种14 h对公谷88生长抑制程度最严重。
植物种子经过不同浓度EMS处理后,细胞膜会受到不同程度的损伤,导致细胞内容物渗漏,而使种子浸出液电导率不同[23]。超氧化物歧化酶(SOD)和过氧化物酶(POD)是植物体内主要的抗氧化酶,植物受到的胁迫,抗氧化酶活性增高,用于清除活性氧,这是植物体对自身的重要保护机制[24]。EMS处理后植物细胞内会发生一些生化反应,产生有害物质,而抗氧化酶可有效地清除这些有害物质,因此,在一定EMS浓度范围内对种子进行处理,SOD、POD活性会增加,但当EMS浓度过大时,会造成植物细胞失活,从而使SOD、POD活性下降。本研究中SOD、POD活性随着浸种时间和EMS处理浓度的上升呈先上升后下降的变化趋势,这与前人的研究结果相一致。
本研究针对EMS诱变的浓度和时间2个因素对谷子种子萌发和幼苗生长的影响做了研究,初步确定了适合公谷88诱变的EMS浓度和时间组合,可为今后建立谷子突变体库、丰富适宜黑龙江省生态条件谷子育种材料及加快谷子育种进程提供参考。但如何对诱变后的植株进行鉴定分析,如何筛选具有目的性状的变异植株,需要进一步探究。另一方面,由于本研究中只有1个品种,所有研究结论都只适用于公谷88,其分析结果是否具有普遍性、指导性还须通过进一步研究加以验证。
EMS处理对谷子种子萌发、幼苗生长、理化指标及存活率具有抑制作用,低剂量处理(0.4%、6 h)下,对公谷88的发芽势、发芽率、茎长、根长及各项理化指标(POD活性除外)影响不显著。随着浸种时间及EMS浓度增加,种子萌发指标与幼苗生长指标与对照相比显著降低;生理指标中SOD和POD活性随着浸种时间及EMS浓度增加呈先升高后降低的变化趋势,MDA呈逐渐升高、SPAD值呈逐渐降低的变化趋势。以成苗率达到半致死剂量为标准,通过回归方程计算出在浸种时间6、10、14 h下EMS处理浓度的半致死剂量分别为1.01%、0.75%、0.39%,可作为EMS诱变公谷88建立突变体库的适宜条件。
