枯草芽孢杆菌J22拮抗姜瘟阴沟肠杆菌的效果与机理研究
2023-02-17姜艳鹏胡振华张翠静隋业伟陆洪省
姜艳鹏, 胡振华, 张翠静, 隋业伟, 陆洪省
(山东科技大学安全与环境工程学院,山东青岛 266590)
姜是一种普遍种植的香辛类保健蔬菜,具有广泛的医用效果[1]和较高的经济价值[2]。但随着连年种植,种植区姜瘟病的发病率逐年升高[3],姜瘟病的发生通常认为是由青枯劳尔氏菌[4]引起的,该病原体可以在土壤中存活很久。其发病地块一般减产10%~20%,严重时导致绝产[5-6],对生姜的种植生产造成了严重威胁。
在我国通常采用化学法防治姜瘟病的发生[7],目前广泛使用土壤熏蒸剂如甲基溴、棉隆及氯化苦进行土壤消毒,能有效控制土传病虫害,但对环境和人体健康都造成了负面影响,因此化学防治姜瘟病的方法正逐步被淘汰[8]。生物防治是化学杀菌剂的一种潜在替代方法[9-10],筛选对姜瘟病病原菌的拮抗菌株,对生姜的种植具有重要意义[11-12]。枯草芽孢杆菌被认为是应用最广泛、研究最充分的生防菌之一[13-14],具有很强的竞争活力,如与镰刀菌竞争营养物质或分泌抗菌物质来抑制镰刀菌[15],且对葡萄灰霉病、稻瘟病等具有良好的抑菌效果,其基因组的4%~5%负责合成抗生素,如环脂肽(LPs)、丰霉素[16]等。
本研究于2020年9月采集山东省安丘市凌河镇生姜种植基地患病地块的土样,并进行病原菌分离,根据16S rDNA与致病性试验,鉴定其为阴沟肠杆菌。阴沟肠杆菌作为内生菌,在有利于细菌生存或者宿主敏感的条件下,会影响姜根茎的质量,造成其腐烂[17-18],然而研究枯草芽孢杆菌对阴沟肠杆菌的抑制效果尚未见报道。本研究的主要目的是在实验室条件下评估枯草芽孢杆菌对阴沟肠杆菌的抑制效果,为后期生物防治提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试材料 试验土样采自山东省安丘市凌河镇生姜种植基地(119.07°E、36.36°N),拮抗菌枯草芽孢杆菌J22为笔者所在实验室之前分离得到的菌株。
1.1.2 供试培养基 致病菌筛选培养基(LB):蛋白胨10 g,NaCl 10 g,酵母浸粉5 g,琼脂20 g,水补充至1 000 mL,pH值7.2。蛋白酶培养基:脱脂奶粉100 g,琼脂15~20 g,水补充至1 000 mL[19]。
1.2 试验方法
1.2.1 致病菌的分离和鉴定 取发病地块姜土样品,委托生工生物工程(上海)股份有限公司进行高通量测序,扩增区域为V3~V4(细菌)[20]。配制土壤梯度浸出液,并在LB固体培养基上涂布培养 48 h,培养温度为30 ℃,经多次纯化培养,共分离到12个菌株,对分离到的菌株进行16S rDNA测序,PCR扩增引物为27F(5′-A G A G T T T G A T C C T G G C T C A G-3′)和1492R(5′-T A C G G C T A C C T T G T T A C G A C T T-3′)[21]。利用美国国立生物技术信息中心(National Center for Biotechnology Information,简称NCBI)数据库对测得的 16S rDNA 进行同源性比对,并通过MEGA 6.0构建系统进化树,鉴定种属[22]。
1.2.2 细菌菌株的致病性分析 姜根茎清洗后,用0.5%次氯酸钠消毒,再用无菌水洗净。切成 3 mm 厚的薄片,用顶端涂有致病菌菌液的牙签对薄片进行接种,未涂有菌液的薄片为对照[23-24],30 ℃ 下静置培养,观察其致病性。
1.2.3 枯草芽孢杆菌J22的抑菌能力测定 (1)液体培养抑菌法:将阴沟肠杆菌和枯草芽孢杆菌J22分别在LB液体培养基中振荡培养48 h,转速为 120 r/min,培养温度为30 ℃,得到富集液。取 15 mL 阴沟肠杆菌和枯草芽孢杆菌J22富集液分别加入270 mL LB 液体培养基中进行培养,培养条件同上,每隔6 h在520 nm处测定吸光度,单独培养阴沟肠杆菌测得的吸光度为对照。利用公式(1)计算抑菌率:抑菌率=(D对照-D处理)/D对照×100%[25]。(2)平板培养抑菌法:分别取 10 μL 枯草芽孢杆菌J22与阴沟肠杆菌富集液均匀涂布在LB固体培养基上,30 ℃培养48 h得到菌落,再用0.6 cm的打孔器取阴沟肠杆菌菌饼置于LB固体培养基中央,同时取枯草芽孢杆菌J22菌饼与阴沟肠杆菌菌饼置于LB固体培养基两侧,每处理重复3皿,30 ℃培养3 d,测量菌斑直径。利用公式(2)计算抑菌率:抑菌率=[菌落直径(CK)-菌落直径(处理) ]/[菌落直径(CK)-菌丝块直径]×100%[26]。
1.2.4 枯草芽孢杆菌J22代谢物测定 蛋白酶检测:在每张6 mm的灭菌滤纸片上滴枯草芽孢杆菌J22发酵液5 μL,放置在蛋白平板中央,每处理重复3皿,30 ℃培养,观察有无透明圈产生[27]。红外光谱测定:分别对阴沟肠杆菌、枯草芽孢杆菌及阴沟肠杆菌和枯草芽孢杆菌(阴沟-枯草)富集液 4 000 r/min、离心5 min,得到沉淀物,60 ℃条件下烘干沉淀物10 h,研磨成粉末并与溴化钾以质量比1 ∶100的比例混合均匀,压片制样,采用Nicoiet 380傅立叶红外光谱仪在4 000~500 cm-1下进行扫描[25]。
1.2.5 抑菌物质高效液相色谱-质谱联用仪(LC-MS)测定 分别对阴沟肠杆菌、枯草芽孢杆菌以及阴沟-枯草的共培养液8 000 r/min离心 15 min,收集上清液,用HCl调节pH值为2.0,在 4 ℃ 下过夜,对处理液8 000 r/min离心15 min,得到沉淀物,并用甲醇对沉淀物进行溶解,用NaOH将pH值调至7.0后,8 000 r/min离心15 min,收集上清液,在50 ℃条件下对上清液旋转浓缩,用甲醇给浓缩液定容至50 mL,采用 LC-MS进行分析[28]。
1.2.6 高通量测序分析 在10 g姜瘟发病土壤中加入20 mL枯草芽孢杆菌 J22培养液,30 ℃培养 7 d,委托生工生物工程(上海)股份有限公司进行高通量分析,扩增区域为 V3~V4(细菌),对测序结果进行物种分类分析和菌群差异分析,以未加入枯草芽孢杆菌J22培养液的土壤样品为对照。
2 结果与分析
2.1 阴沟肠杆菌的鉴定
对分离得到的致病菌进行16S rDNA测序,用NCBI数据库对测得的序列进行同源性分析,并构建系统树(图1)。从图1可以看出,分离菌株与阴沟肠杆菌SN19(JQ904624.1)碱基序列相似度为98%,暂鉴定该分离致病菌为阴沟肠杆菌-SKD(Enterobactercloacae-SKD)。

2.2 阴沟肠杆菌的致病性分析
涂有阴沟肠杆菌-SKD的姜切片以及未涂菌液的切片(对照),在30 ℃条件下培养14 d,结果如图2所示。涂有阴沟肠杆菌-SKD的姜片组织内部明显出现发黄、质地变软、腐烂病状(图2-a)。以无菌水为对照的姜片上未出现变色腐烂等症状(图2-b)。

2.3 枯草芽孢杆菌的抑菌能力测定
2.3.1 液体培养的抑菌效果 对阴沟肠杆菌-SKD单独培养液以及阴沟-SKD+枯草J22共培养液进行吸光度(D520 nm)测定,绘制生长曲线(图3)。结果表明,阴沟肠杆菌-SKD最大吸光度为1.173,阴沟-SKD+枯草J22共培养时最大吸光度为0.961,降低了0.212,根据公式(1)计算得到抑菌率为18.07%。

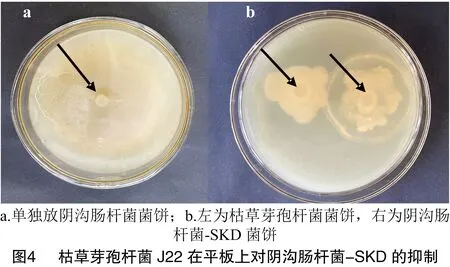
2.3.2 平板对峙 在LB培养基中培养3 d,阴沟肠杆菌-SKD单独培养时的菌饼直径为10 cm(图 4-a),共培养时菌饼直径为6 cm(图4-b),根据公式(2)得到J22对阴沟肠杆菌-SKD的抑菌率为42.55%。
2.4 枯草芽孢杆菌J22产酶与代谢物质的分析
2.4.1 产酶能力分析 如图5所示枯草芽孢杆菌J22在蛋白酶平板中培养3 d后,平板中出现明显透明圈,表明枯草芽孢杆菌J22能分泌蛋白酶,可将奶粉蛋白质降解成小分子可溶性物质。
2.4.2 代谢产物的红外吸收光谱测定 对枯草芽孢杆菌J22富集液(a)、阴沟肠杆菌-SKD富集液(b)、阴沟-SKD+枯草J22共培养液(c)进行离心,采用红外光谱测定离心后的沉淀物,测定结果如图6所示。(a)在1 656.79 cm-1出现吸收峰。(b)在1 654.79 cm-1出现吸收峰,其吸收峰均落在1 700~1 600 cm-1范围内,为酰胺谱带Ι,表明样品中含有肽键[29]。(c)的吸收峰移出现在1 651.59 cm-1,表明共培养时分子内氢键被破坏,使峰位向低波数移动[29]。相较于(a)和(b),(c) 代表酰胺基(—CONH—)的吸收峰明显增强,在1 560.16 cm-1出现明显吸收峰。(a)在1 231.51 cm-1、(b)在 1 234.51 cm-1出现特征吸收峰,证明样品中含有脂肽类物质[30]。从(a)的吸收峰1 065.33 cm-1和(b)的吸收峰1 086.53 cm-1移至(c)的吸收峰 1 117.37 cm-1,证明了(c)中谷氨酸/天冬氨酸的羧基侧链(O—H伸缩)和酰胺基的—NH键的存在[31]。从图6可以看出,(c)在 700~500 cm-1处的宽峰相比于(a)和(b)的红外光谱图发生了较明显的变化,这可能是枯草芽孢杆菌J22产生的脂肽物质给阴沟肠杆菌-SKD带来了影响[31]。观察到的峰值与Das等报道的脂肽生物表面活性素的峰值[32-33]相似。脂肽生物表面活性素也产生了类似的红外吸收模式,并在大致相同的波数位置被吸收[32]。


2.5 抑菌活性物质的LC-MS测定
2.5.1 枯草芽孢杆菌J22单独培养条件下 对培养5 d后的J22菌液进行离心,收集上清液,利用 LC-MS 对上清液中的抑菌活性物质进行测定,结果如图7、图8所示。从图7可以看出,色谱峰主要出现在13.39、14.32、14.91、16.77 min,结合图8质谱图,得到其分子质荷比(m/z)分别为1 008.658 8、1 022.673 9、1 036.689 8、1 036.690 7,根据高学文等的研究[34]推测均为表面活性素。
2.5.2 阴沟肠杆菌-SKD单独培养条件下 对培养5 d后的阴沟肠杆菌-SKD菌液进行离心,收集上清液,利用LC-MS对上清液的物质进行测定,结果如图9、图10所示。在9.52 min处峰主要分子质荷比为946.399 5,在10.14 min处峰主要分子质荷比为727.392 5,通过Xcalibur软件进行元素组成分析,元素组成为C27H55O13N10,根据刘邮洲等的研究[35]推测质荷比 1 029.533 4为杆菌霉素,质荷比 1 447.714 8为泛革素;10.61 min处峰主要分子质荷比为1 036.689 8,推测其为表面活性素;11.04、12.43 min处主要分子质荷比分别为739.411 3、463.320 7,元素组成分别为 C25H59O15N10、C29H41O2N3,结构有待进一步鉴定。13.51、13.88、14.86 min 处主要分子质荷比分别为994.643 4、1 008.658 6、1 022.674 9,均为表面活性素。



2.5.3 阴沟-SKD+枯草J22共培养条件下 阴沟-SKD+枯草J22共培养5 d后进行离心,收集上清液,利用LC-MS对上清液中的抑菌活性物质进行测定,结果如图11、图12所示。10.09、10.67、11.87 min处峰主要分子质荷比为579.341 9、563.346 5、463.320 1,通过Xcalibur软件进行元素组成分析,元素组成分别为C18H47O11N10、C28H51O11N2、C29H41O2N3,12.28 min处峰主要分子质荷比为463.320 5、503.313 0,元素组成分别为C29H41O2N3、C29H39O3N6;结构有待进一步鉴定。13.57 min处峰主要分子质荷比为683.543 4,元素组成为C27H59O10N10;13.88、14.78、15.36 min处峰主要分子质荷比为 1 008.659 4、1 022.674 5、1 036.690 4,推测其均为表面活性素。
综上所述,3种培养条件下,均出现表面活性素的离子峰,分子质荷比值相差14,分别为1 008.7、1 022.7 和1 036.7, 证明这3种活性肽均为脂肪酸链同系物,且相差1个亚甲基(—CH2)。同时,阴沟-SKD+枯草J22共培养时产生了较多新物质,如 C18H47O11N10、C28H51O11N2、C29H41O2N3、C29H39O3N6、C27H59O10N10,具体结构有待进一步鉴定。




2.6 高通量测序分析
对加入枯草芽孢杆菌J22和未加入枯草芽孢杆菌J22的土壤分别进行高通量分析,结果如图13所示。加入枯草芽孢杆菌J22的土壤样品中,在目水平上,假单胞菌目相对丰度升高了14.17百分点,茎杆菌目相对丰度升高了13.97百分点,肠杆菌目相对丰度降低了10.71百分点;在科水平上,假单胞菌科相对丰度升高了23.47百分点,成为优势菌,茎杆菌科相对丰度升高了13.86百分点,肠杆菌科相对丰度减少了10.71百分点,莫拉菌科相对丰度减少了9.31百分点;在属水平上,假单胞菌属相对丰度增加了23.48百分点,成为优势菌,短链单胞菌相对丰度增加了14.28百分点,肠杆菌属相对丰度减少10.39百分点,不动杆菌相对丰度减少9.31百分点;在种水平上,恶臭假单胞杆菌相对丰度增加了23.06百分点,成为优势菌,鞘氨醇杆菌相对丰度增加了4.44百分点,阴沟肠杆菌相对丰度减少了10.39百分点。
高通量分析结果表明,枯草芽孢杆菌J22在目、科、属、种水平上对土壤菌落结构的影响一致,其中假单胞菌、鞘氨醇单胞菌、茎杆菌相对丰度均变大,姜瘟病致病菌(阴沟肠杆菌-SKD)相对丰度出现明显降低,证明枯草芽孢杆菌J22对土壤中肠杆菌具有抑制作用,具有一定的姜瘟病防治潜力。

3 讨论
本研究通过对发病地块进行病原菌的分离、培养、纯化,筛选出1株能够使姜切片患病的菌株,根据16S rDNA确定姜瘟致病菌为阴沟肠杆菌-SKD。阴沟肠杆菌可在患病玉米、洋葱[36]、水稻植株等植物中分离出来[37],同时,阴沟肠杆菌可以作为生姜内生菌,在有利于细菌生存或者宿主敏感的条件下,会影响根茎的质量,造成其腐烂[18]。目前,暂未见对由阴沟肠杆菌引起的姜瘟病进行生物防治的报道。枯草芽孢杆菌抑菌能力强,应用范围广。因此,本试验研究了枯草芽孢杆菌J22对阴沟肠杆菌-SKD的抑制效果,结果表明,枯草芽孢杆菌J22在液体培养、平板对峙试验中均显示对阴沟肠杆菌-SKD有一定的抑制作用,同时,蛋白酶作为抑菌物质也在本试验中通过透明圈得到证明[38]。
表面活性素是已知最有效的抑菌物质之一,可显著抑制细菌、病毒、真菌、支原体的生长[39]。本试验通过红外光谱与LC-MS分析枯草芽孢杆菌产生的脂肽类物质,主要分子质量在460~1 500 u 区间,其中含量最多的为表面活性素。桑建伟等的研究结果显示,解淀粉芽孢杆菌 BEB17也可以产生表面活性素[40]。Chen等研究发现,解淀粉芽孢杆菌FZB42 产生的脂肽类物质可抑制病原真菌的生长,对由欧文氏菌引起的梨火疫病具有防治效果[41]。目前国内外对表面活性素的研究越来越广泛,多数研究者认为表面活性素具有很强的抗菌活性,能够改变细菌的表面疏水性,破坏膜结构,从而导致代谢物质外泄[42]。本试验中通过傅立叶红外光谱和LC-MS检测到枯草芽孢杆菌粗提物中也存在表面活性素,从而从机理上证明了枯草芽孢杆菌对阴沟肠杆菌-SKD具有抑制作用。
通过高通量测序分析土壤中的细菌群落构成,发现加入枯草芽孢杆菌后,阴沟肠杆菌在目、科、属、种的水平上均有所降低,在土壤中主要的优势菌为假单胞菌、鞘氨醇单胞菌和茎杆菌,为下一步进行田间试验提供了理论依据。
试验表明枯草芽孢杆菌对阴沟肠杆菌-SKD有显著的抑制作用, 为开发具有环境安全的生物农药[43]以及姜瘟病防治的实际应用提供了一定的理论基础和应用前景。
4 结论
本试验从山东省安丘市分离纯化出姜瘟病的致病菌,经16S rDNA和致病性试验鉴定致病菌为阴沟肠杆菌-SKD,可作为生姜内生菌,引起姜根茎腐烂。通过液体培养和平板对峙试验,枯草芽孢杆菌J22对阴沟肠杆菌均有抑制效果,抑制率分别为18.07%、42.55%,通过蛋白酶平板的透明圈验证了枯草芽孢杆菌J22能够分泌蛋白酶类抑菌物质。枯草芽孢杆菌J22发酵液经离心提取的抑菌物质,经红外光谱测定为内酯类的环状脂肽,再经酸沉降,高效液相色谱和质谱鉴定其分子质量范围为460~1 500 u,有效成分为枯草芽孢杆菌表面活性素。高通量分析枯草芽孢杆菌J22对姜瘟病土壤中的细菌菌群影响,表明加入枯草芽孢杆菌后枯草芽孢杆菌对肠杆菌-SKD在目、科、属、种水平上的相对丰度分别降低了10.71、10.71、10.39、10.39百分点,且前后优势菌群没有发生变化。为后续进行田间试验提供了理论依据。
