单硫代丙二酸酯在有机催化不对称反应中的应用*
2023-02-17马艳榕王晓晨王炳福张立新
马艳榕,王晓晨,王炳福,金 辉,张立新
(沈阳化工大学 功能分子研究所,辽宁省绿色功能分子设计与开发重点实验室,沈阳市靶向农药重点实验室,辽宁 沈阳 110142)
丙二酸酯1(图1)是有机合成中重要的中间体,作为亲核试剂在有机催化[1]的不对称反应中也得到了广泛应用。但丙二酸酯的α氢酸性相对较弱,较难在温和条件下烯醇化进行亲核反应,使其参与的有机催化反应通常需要较长的反应时间[2]。近年来,单硫代丙二酸酯2(monothiomalonates,MTMs)(图1)作为高活性的丙二酸酯的类似物在不对称有机催化中得到了很好的应用。硫酯(thioester)作为一种性质活泼的羧酸衍生物,其羰基的C(2p)和S(3p)轨道重叠度较小,因此,其α氢的酸性比氧酯更强[3],能在温和的条件下烯醇化。单硫代丙二酸酯的高反应活性使其参与的有机催化不对称反应可在温和、较低催化剂量的条件下进行。此外,产物中的硫酯基团还可方便地转化为醛、酮、酯、酰胺等官能团[4,5],在有机合成中具有重要价值。本文综述了单硫代丙二酸酯(MTMs)的合成方法及其参与的有机催化不对称反应的研究进展。

图1 丙二酸酯和单硫代丙二酸酯Fig.1 Simple thioesters and monothiomalonates
1 单硫代丙二酸酯的制备方法
目前,单硫代丙二酸酯的合成方法主要有3种(图2)。(1)以丙二酸3为原料,首先进行单酯化生成丙二酸半酯4,然后4再进行硫酯化获得单硫代丙二酸酯2(图2a)[6]。但该方法中丙二酸的选择性单酯化反应并不容易实现,因为很难避免副产物丙二酸酯的生成。(2)丙二酸二硫酯5在水杨酸Cu(Ⅱ)配合物的催化下选择性地进行单醇解,直接制备单硫代丙二酸酯2[7](图2b)。(3)Meldrum酸衍生物6与硫醇发生亲核开环反应,首先生成丙二酸半硫酯7,再通过O-烷基化得到单硫代丙二酸酯2(图2c)[8]。

图2 MTMs的合成方法Fig.2 Synthetic methods for MTMs
2 单硫代丙二酸酯参与的不对称Michael加成反应
不对称Michael加成反应是构建手性中心最常用的反应之一[9,10]。2012年,Wennemers课题组报道了奎尼丁衍生的硫脲C1催化单硫代丙二酸酯2a与硝基烯烃8的不对称Michael加成反应(图3)[6],得到的加成产物在三氟乙酸条件下选择性的水解其PMB酯,后经碱性条件下的脱羧反应,以高产率(91%~98%)和高ee值(91%~99%)得到了一系列γ-硝基硫酯产物9。在该反应中具有吸电子取代基的芳香硝基烯烃参与的反应效果较好,可在1(mol)%催化剂量下,以ee值高达99%获得产物。而富电子的芳香硝基烯烃和脂肪族硝基烯烃也能在3%~20(mol)%的催化剂量下,以高立体选择性得到产物。此外,作者还进行了γ-硝基硫酯产物9的衍生化研究,以证明该方法的应用前景。如γ-硝基硫酯9经硝基还原、环合反应,以95%的产率得到了γ-丁内酰胺10。硫酯官能团经Fukuyama反应得到了γ-硝基醛11和γ-硝基酮12。

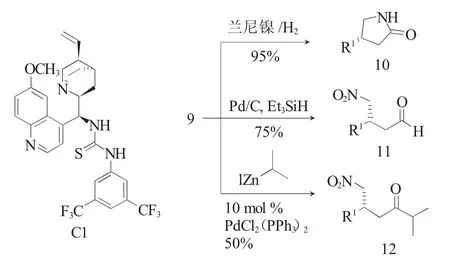
图3 MTMs与硝基烯烃的Michael加成反应Fig.3 Michael addition reaction of MTMs with nitroolefins
在药物分子中,引入氟原子可以调节其酸度、亲油性、代谢稳定性等。由于氟原子的以上独特性质,在药物研究领域引起了研究者们越来越多的关注。2016年,Wennemers课题组报道了辛可宁衍生的脲C2(1(mol)%)催化α-氟取代单硫代丙二酸酯2b(FMTMs)与硝基烯烃8的Michael加成反应(图4)[11],以较好的产率(61%~98%)、高立体选择性(dr高达>20∶1,ee值高达99%)合成了具有邻位季碳-叔碳双立体中心的α-氟代-γ-硝基硫酯13。值得注意的是,具有挑战性的脂肪族硝基烯烃作为底物时,反应也能以良好的产率(>80%)和高立体选择性(dr≥20∶1,ee≥99%)得到目标产物。最后为了证明α-氟-γ-硝基硫酯的应用价值,作者使用此方法合成了PAR-2激动剂AC-264613的氟代类似物14。
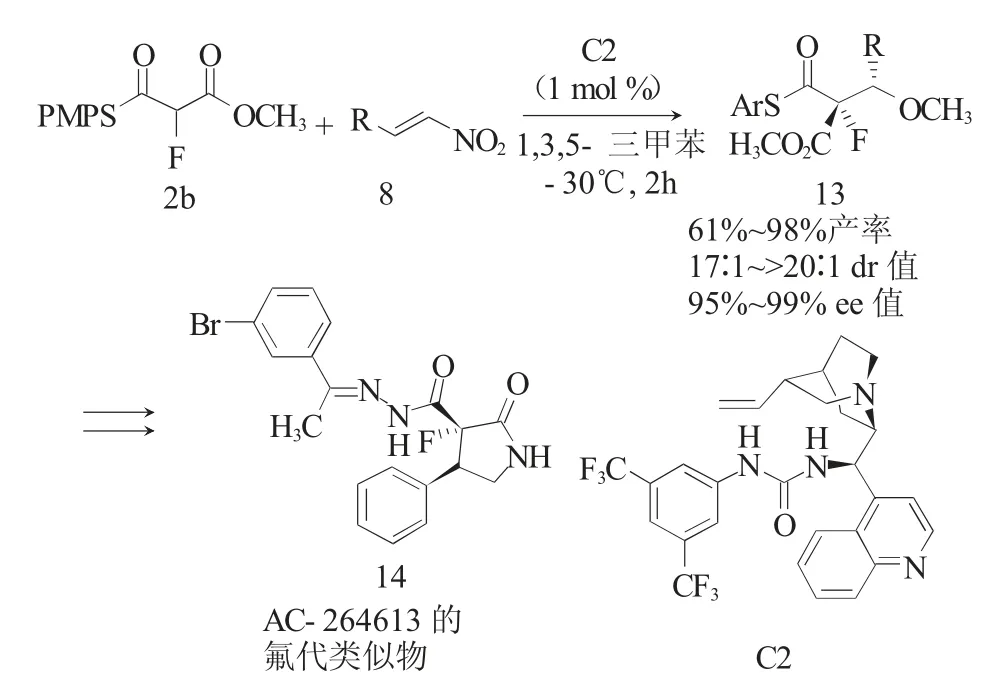
图4 F-MTMs与硝基烯烃的Michael加成反应Fig.4 Michael addition reaction of F-MTMs with nitroolefins
在自然界中,硫酯化合物的α碳官能团化和SN、S-O酰基转移反应广泛存在于多种生物合成途径中。2018年,金辉和Ryu等[12]通过仿生途径实现了香豆素衍生的单硫代丙二酸酯2c与β,γ-不饱和-α-酮酸酯15的Michael加成-内酯化串联反应(图5)。该反应使用了基于脯氨酸的脲C3作为催化剂,在催化剂量低至1 mol%的条件下,以优异的立体选择性(ee高达99%,单一非对映异构体)得到了3,4-二氢香豆素螺3',4'-二氢吡喃酮产物16。产物的绝对构型通过X射线单晶衍射得到了确定。
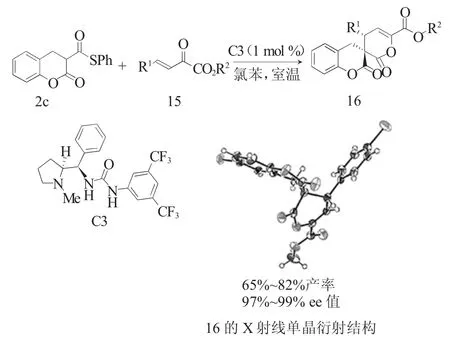
图5 MTMs与β,γ-不饱和-α-酮酸酯的Michael加成-内酯化串联反应Fig.5 Michael addition-lactonization reactions of MTMs withβ,γ-unsaturatedα-keto esters
3 单硫代丙二酸酯参与的不对称Mannich反应
通过单硫代丙二酸酯与亚胺或亚胺等价物的不对称Mannich反应可以获得手性β-氨基硫酯等具有重要价值的分子。2014年,Annette Bahlinger[13]等报道了二氢奎宁和奎宁衍生的脲C4和C5催化单硫代丙二酸酯2d与醛亚胺17的高立体选择性Mannich反应(图6)。作者首先将α-无取代的单硫代丙二酸酯MTM作为底物,在仅有1(mol)%C4的存在下,与Cbz取代的醛亚胺17反应得到了加成产物18。得到的加成产物18不经分离,在三氟乙酸条件下选择性地水解其PMB酯,后经碱性条件下的脱羧反应,以高产率(93%)和高光学纯度(ee高达99%)获得了β-氨基硫酯19。作者又将α-烷基取代的MTM与醛亚胺17反应,在5 mol%C5催化下以高产率(51%~99%)和较好立体选择性(87%~>99%ee;5∶1~>20∶1 dr)获得了具有邻位季碳-叔碳双立体中心的加成产物20。加成产物20同样在三氟乙酸条件下水解其PMB酯,后经碱性条件下的脱羧反应,得到了syn构型的β-氨基硫酯产物21,其光学纯度得到了保持(99%ee;20∶1 dr)。
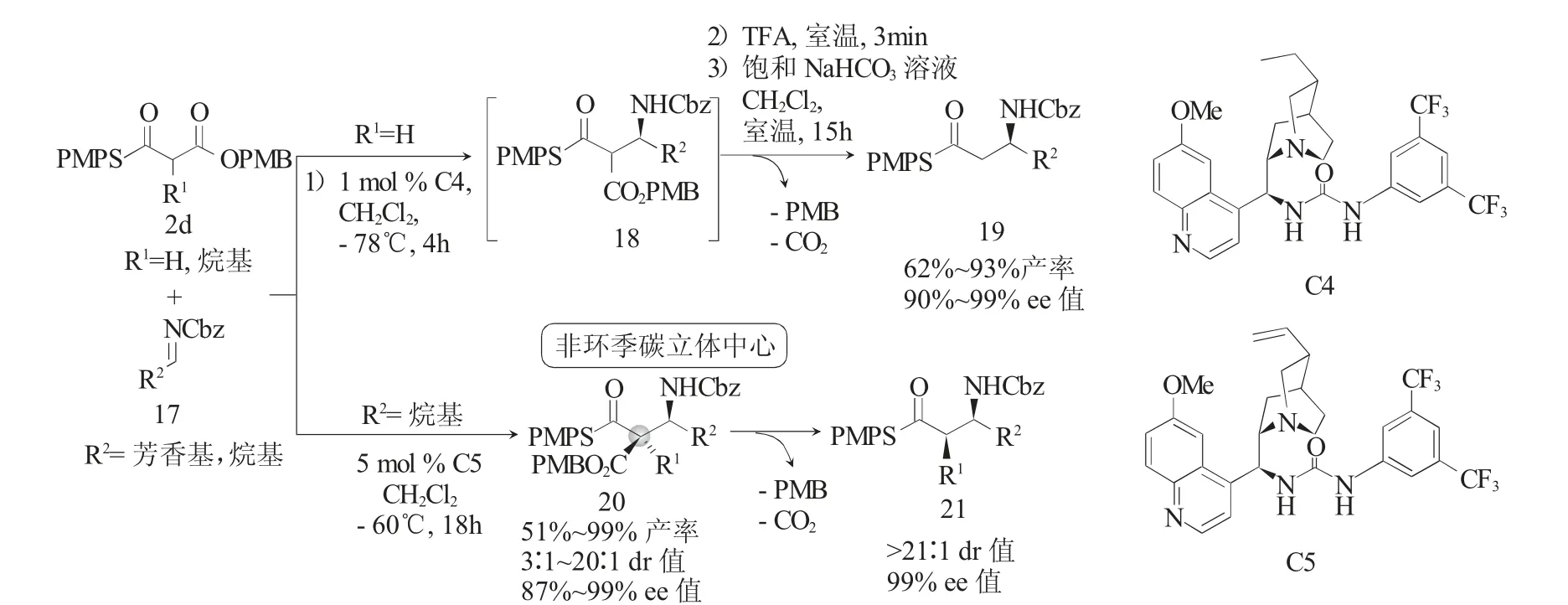
图6 MTMs与醛亚胺的不对称Mannich反应Fig.6 Asymmetric Mannich reaction MTMs with aldimines
在药物化学界,季碳中心结构通常与药物的药效和代谢稳定性有关。但受限于高度拥挤的化学反应环境,全碳季碳中心[14]的对映选择性合成具有很大难度。2015年,Wennemers[15]课题组报道了在温和条件下使用辛可尼丁衍生的脲C6或Takemoto's催化剂C7催化α-烷基取代的单硫代丙二酸酯(MTMs)2d与靛红衍生的N-Cbz酮亚胺22的不对称Mannich反应(图7),以高产率(51%~95%)、高立体选择性(87%~>99%ee;5:1~>20:1 dr)得到了手性吲哚酮类化合物23。该方法仅需要较低的催化剂使用量(2(mol)%)就可实现邻位季碳-叔碳双立体中心的高效构建。通过更换催化剂C6和C7,可分别以高立体选择性获得两种对映异构体产物23和ent-23。最后作者使用加成产物ent-23合成了具有抗癌等多种生物活性的AG-041R的甲基化衍生物24。
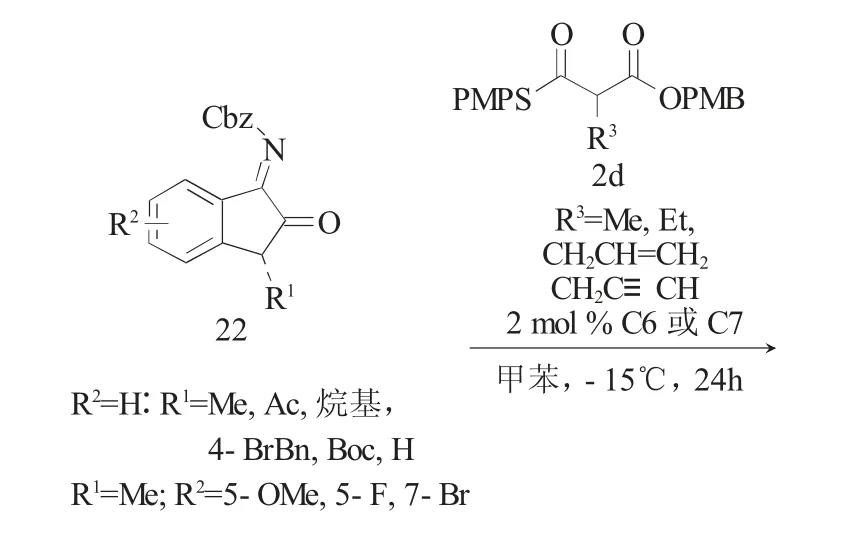
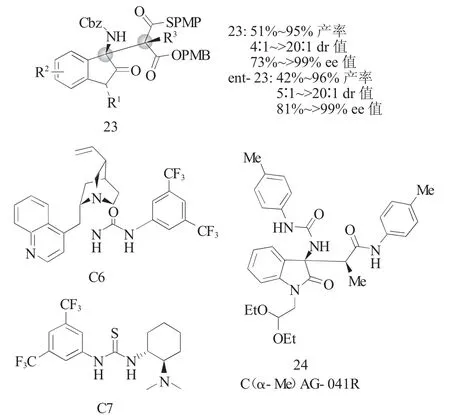
图7 MTMs与靛红衍生的酮亚胺的不对称Mannich反应Fig.7 Asymmetric Mannich reactions of MTMs to isatin-derived N-Cbz ketimines
近年来,多肽药物的研究受到了广泛关注。采用氟化的非天然β-氨基酸合成多肽是增强多肽水解稳定性和控制其构象的有效手段。因此,开发高效合成α-氟代-β-氨基酸的方法具有重要意义。2016年,Wennemears[16]课题组报道了奎宁衍生的方酰胺C8催化N-Cbz-和N-boc取代的醛亚胺(17和25)与α-氟代MTMs 2b的不对称Mannich反应(图8),以普遍较高的收率(70%~99%)和高立体选择性得到了α-氟代-β-氨基硫酯26(95%~99%ee;4:1~>20:1 dr)。该反应中催化剂的使用量仅为1(mol)%,所得加成产物26可在固相和溶液中进行无偶联试剂条件下的多肽合成,以66%~82%的产率得到二肽27,并以86%的产率得到了三肽28。在类似于自然化学连接(Native Chemical Ligation,NCL)[5]的条件下用半胱氨酸与26反应,以75%的产率得到了二肽29。
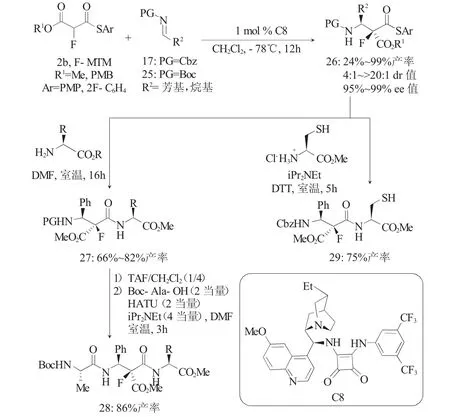
图8 F-MTMs与醛亚胺的不对称Mannich反应Fig.8 Asymmetric Mannich reaction between F-MTMs and aldimines
炔丙胺是合成多功能氨基化合物、天然产物及生物活性分子的重要中间体。2015年,邵志会[17]等报道了以C-炔基N-Boc-N,O-羧醛胺30作为一种新的亚胺前体与MTM 2g在Takemoto's催化剂C7的催化下进行的不对称Mannich反应(图9),以高对映选择性得到了手性炔丙胺产物31。在该反应中,催化剂C7作为手性Br nsted碱催化N,O-羧醛胺30原位生成炔基醛亚胺参与Mannich反应。虽然该反应的对映选择性很高(高达98∶2 er),但由于产物31的α-立体中心容易差向异构化,所得产物31均为1∶1的非对映异构体混合物。31通过在三氟乙酸条件下PMB酯水解、碱性条件下的脱羧反应,再经过N-Boc保护,以高产率(87%)得到了β-炔基-β-氨基硫酯32,且对映异构体纯度未受损失。此外,作者还尝试了使用N,O-羧醛胺30为原料一锅法制备β-炔基-β-氨基硫酯32,总产率为68%,er值与分步法相同,达到了98∶2。
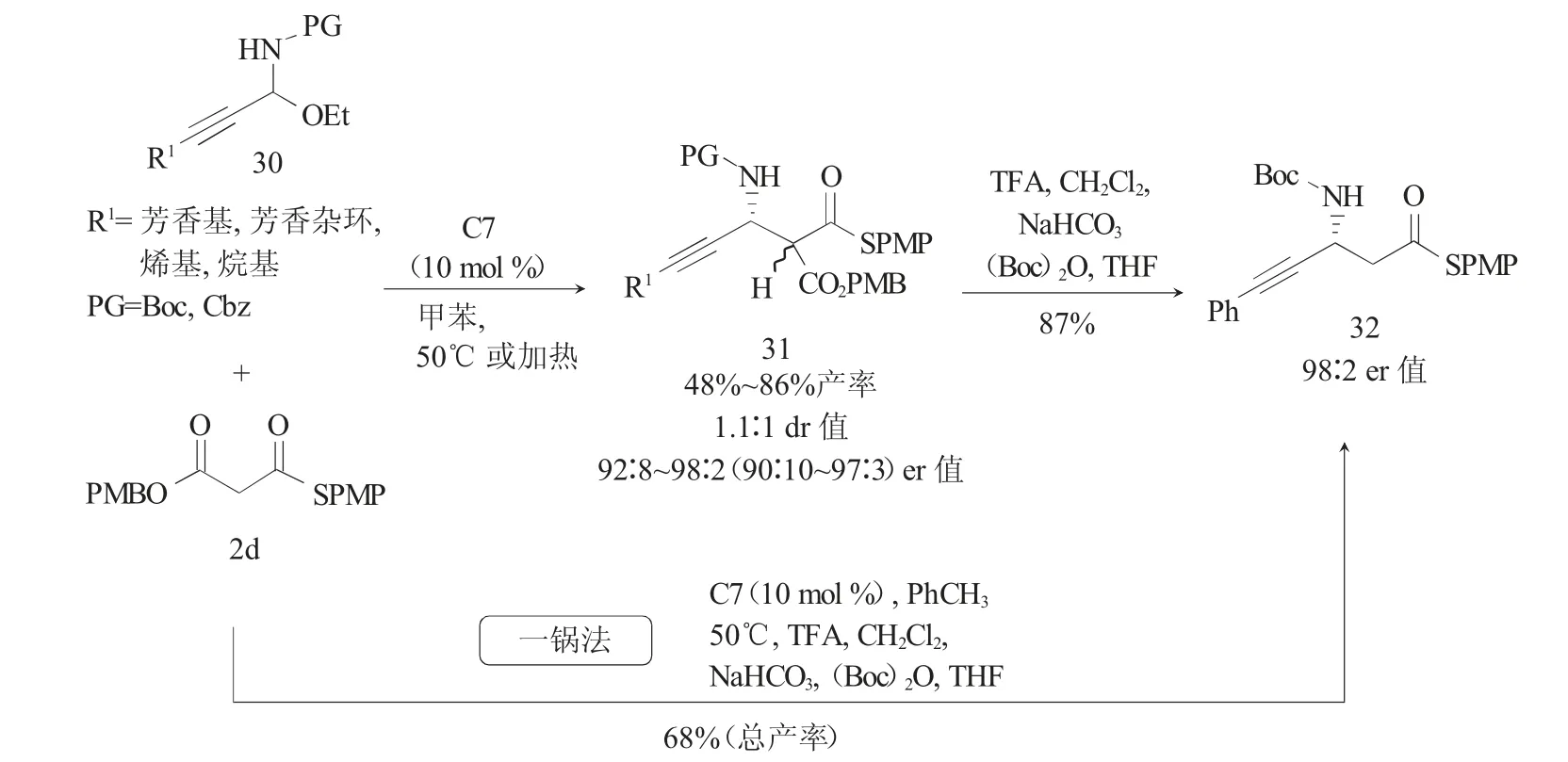
图9 不对称Mannich反应合成手性丙炔胺Fig.9 Synthesis of chiral proparynamines with asymmetric Mannich reaction
4 结论
单硫代丙二酸酯具有α碳亲核活性高、硫酯基团易被衍生化、易制备、易储存等优点。近年来在不对称合成反应中得到了很好的应用,反应中得到的手性产物还被应用在了合成一些如β-氨基酸等具有潜在生物活性的分子中。但目前单硫代丙二酸酯的应用反应类型还局限于不对称Michael加成反应和Mannich反应中,还有较大的发展空间。随着化学家们对单硫代丙二酸酯这一中间体研究的深入,其在不对称有机合成中将得到越来越多的应用。
