度普利尤单抗治疗成人中重度特应性皮炎有效性和安全性的系统评价Δ
2023-02-16何涯含冷衍恩冯先虎
何涯含,冷衍恩,周 玺,冯先虎,李 虹,侯 益#
(1.四川省中江县人民医院皮肤科,四川 德阳618100; 2.四川省中江县人民医院药剂科,四川 德阳 618100; 3.南充市中心医院药学部,四川 南充637000; 4.四川大学华西临床医学院,成都 610000)
特应性皮炎(atopic dermatitis,AD)的临床特征为皮肤干燥、剧烈瘙痒,是一种典型的慢性炎症性皮肤疾病[1-3]。AD全球成人患病率为1%~20%,其中中重度患者约占20%,近年来,我国AD的发病率为7.8%,相比于以往的研究有所升高[4]。虽然AD的发病机制尚不完全清楚,但较多研究发现其与免疫失调、表皮屏障功能障碍和皮肤微生物菌群生态失调有着密切的联系[5-6]。目前,各国指南均推荐在基础治疗的基础上,采取局部外用药物治疗、物理措施治疗和全身性系统治疗的阶梯方式[7]。但其病情仍容易复发。度普利尤单抗是一种靶向白细胞介素4Rα(IL-4Rα)的单克隆抗体,通过选择性结合白细胞介素4(IL-4)和白细胞介素13(IL-13)的共同受体的α亚单位,影响辅助型T细胞2(Th2)炎症轴的调控[8-10]。该药于2020年6月获得我国国家药品监督管理局批准用于成人AD[11]。本研究对国内外发表的度普利尤单抗治疗AD的有效性和安全性的相关研究进行系统评价,以期为其临床应用提供循证医学证据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型:英文或中文的度普利尤单抗治疗中重度AD的随机对照试验(RCT)。
1.1.2 研究对象:确诊为中度或重度AD,病程至少为6个月,湿疹面积及严重程度指数(EASI)评分≥12分,体表受累面积(BSA)≥10%,特应性皮炎严重程度积分(SCORAD)评分≥20分,研究者整体评估(IGA)评分≥3分,瘙痒指数(NRS)评分≥6分,年龄≥18岁;种族和性别不限。
1.1.3 干预措施:研究组患者给予度普利尤单抗,剂量为度普利尤单抗300 mg、1周1次,或300 mg、2周1次;对照组患者给予安慰剂。
1.1.4 结局指标:EASI评分较基线下降≥75%的患者比例(EASI75);EASI评分较基线下降≥50%的患者比例(EASI50);IGA评分为0或1分(清除/几乎清除)(IGA0/1)的患者比例;NRS评分较基线下降≥3分(NRS≥3)的患者比例;SCORAD评分较基线下降的百分比;患者全面严重程度(GISS)评分较基线下降的百分比;患者的湿疹测量(POEM)评分较基线下降的百分比;特应性皮炎体表面积的百分比(BSA)较基线下降的百分比;总不良反应发生率;因不良反应退出率;严重不良反应发生率;注射部位反应发生率;上呼吸道感染发生率;鼻咽炎发生率;头痛发生率;口腔疱疹发生率;皮肤过敏发生率等。
1.1.5 排除标准:非RCT、交叉试验、动物实验、自身对照试验、开放性研究以及综合类文献。
1.2 检索策略
计算机检索 PubMed、Embase、Cochrane 图书馆、中国知网、维普数据库、万方数据库等数据库。检索时限均为建库起至2022年6月。中英文检索词包括“Dupilumab” “Dupixent” “REGN668” “SAR231893” “Atopic Dermatitis”“度普利尤单抗”“达必妥”和“特应性皮炎”。检索采取主题词和自由词相结合的方式。
1.3 文献筛选和资料提取
本研究由2名研究者根据纳入与排除标准独立进行文献的筛选纳入,如遇分歧,则通过讨论并由第3名研究者裁决。提取的资料包括作者、发表年份、两组患者的基线情况(病例数、年龄、性别)、干预措施、随访时间和结局指标等。
1.4 文献质量评价
根据Cochrane系统评价员手册5.1.0推荐的偏倚风险评估工具对纳入的文献从以下方面进行质量评价:随机序列生成、分配隐藏、对受试者和干预提供者施盲、对结局评估者施盲、结果数据不完整、选择性报告以及其他偏倚[12]。
1.5 统计学方法
以RevMan 5.3软件进行统计学分析。计数资料采用相对危险度(RR)作为效应量,计量资料采用均数差(MD)为效应量,区间估计均采用95%CI表示。采用χ2检验对纳入研究进行异质性检验,检验水准为α=0.1,同时结合I2进行判断,若各研究间有统计学异质性(P<0.1,I2>50%),采用随机效应模型进行分析;反之,则认为各研究间无统计学异质性,采用固定效应模型进行分析。采用倒漏斗图进行发表偏倚风险分析。P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果
在所有文献库中初步筛选出文献1 368篇,利用EndNote X9软件去除重复文献411篇,经过复筛最终纳入符合标准的研究共10项(来自8篇文献[13-20]),共3 383例患者,均为英文文献。文献筛选流程及结果见图1;纳入研究的基本特征见表1。
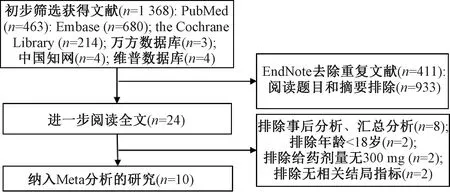
图1 文献筛选流程及结果

表1 纳入研究的基本特征
2.2 纳入研究的质量评价
本研究纳入的10项研究[13-20]均为双盲的RCT,所有研究描述了随机序列生成的具体方案、分配隐藏的具体方案以及退出/失访情况,其偏倚风险见图2—3。
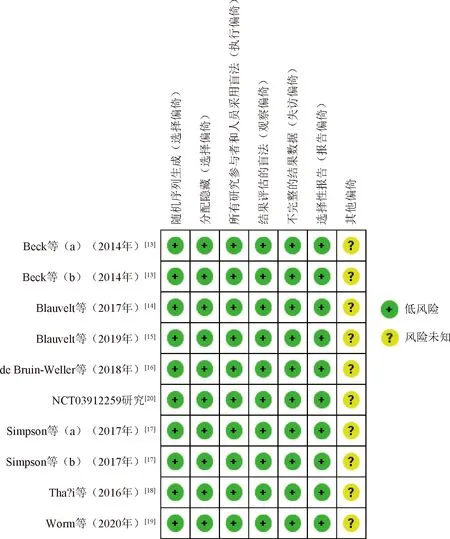
图2 纳入研究的偏倚风险条图
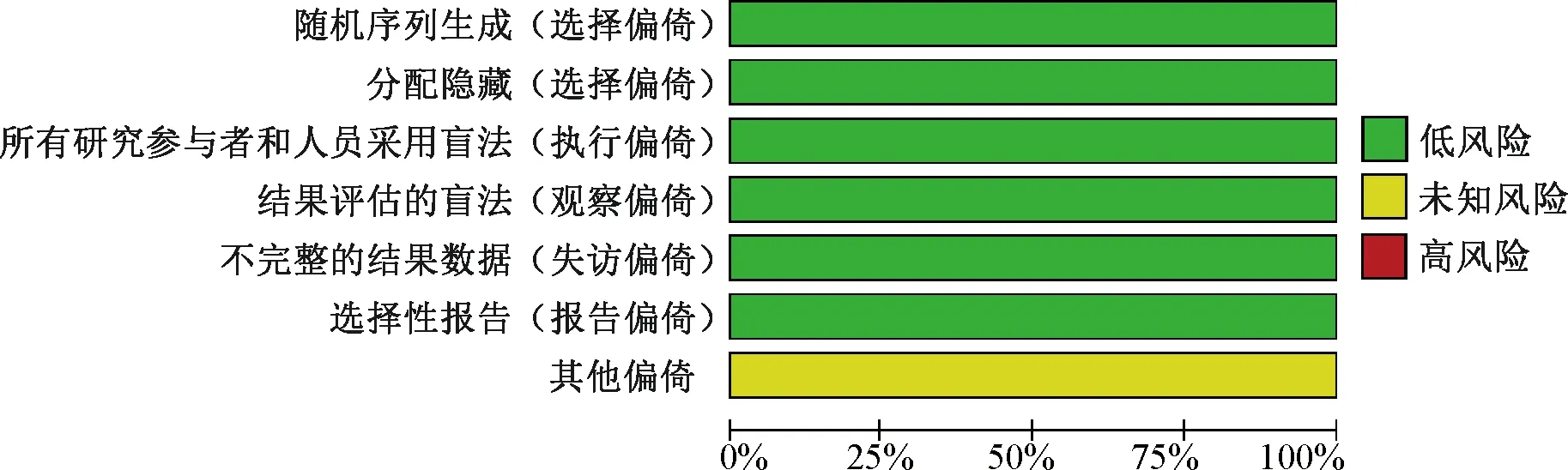
图3 纳入研究的偏倚风险总图
2.3 Meta分析结果
2.3.1 EASI75:10项研究[13-20](共3 372例患者)报告了EASI75。各研究间有统计学异质性(P=0.02,I2=48%),采用随机效应模型合并效应量进行分析。结果显示,研究组患者的EASI75显著高于对照组,差异有统计学意义(RR=3.01,95%CI=2.62~3.46,P<0.000 01);根据给药频次进行亚组分析,结果表明,度普利尤单抗300 mg、1周1次亚组(RR=2.91,95%CI=2.38~3.55,P<0.000 01)和300 mg、2周1次亚组(RR=3.16,95%CI=2.56~3.89,P<0.000 01)患者的EASI75与对照组比较,差异均有统计学意义,见图4。5项研究[14,16-18]报告了度普利尤单抗300 mg、1周1次亚组与300 mg、2周1次亚组患者治疗后的EASI75,各研究间无统计学异质性(P=0.61,I2=0%),采用固定效应模型合并效应量进行分析。结果显示,度普利尤单抗300 mg、1周1次亚组与度普利尤单抗300 mg、2周1次亚组患者的EASI75比较,差异无统计学意义(RR=1.01,95%CI=0.93~1.10,P=0.81),见图5。
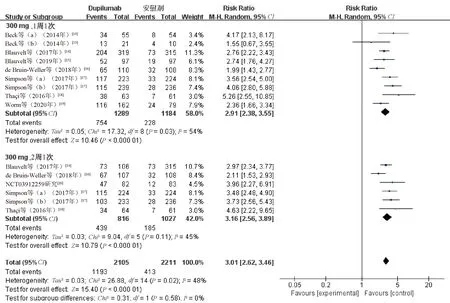
图4 两组患者EASI75比较的Meta分析森林图

图5 度普利尤单抗300 mg、1周1次亚组与300 mg、2周1次亚组患者EASI75比较的Meta分析森林图
2.3.2 EASI50:9项研究[13,15-20](共2 643例患者)均报告了EASI50。各研究间无统计学异质性(P=0.17,I2=27%)采用固定效应模型合并效应量进行分析。结果显示,研究组患者的EASI50显著高于对照组,差异有统计学意义(RR=2.43,95%CI=2.24~2.64,P<0.000 01);根据给药频次进行亚组分析,结果表明,度普利尤单抗300 mg、1周1次亚组(RR=2.32,95%CI=2.09~2.59,P<0.000 01)和度普利尤单抗300 mg、2周1次亚组(RR=2.58,95%CI=2.27~2.93,P<0.000 01)患者的EASI50与对照组比较,差异均有统计学意义,见图6。4项研究[16-18]报告了度普利尤单抗300 mg、1周1次亚组与度普利尤单抗300 mg、2周1次亚组患者的EASI50,各研究间无统计学异质性(P=0.31,I2=16%),采用固定效应模型合并效应量进行分析。结果显示,度普利尤单抗300 mg、1周1次亚组与度普利尤单抗300 mg、2周1次亚组患者的EASI50比较,差异无统计学意义(RR=0.95,95%CI=0.88~1.02,P=0.14),见图7。
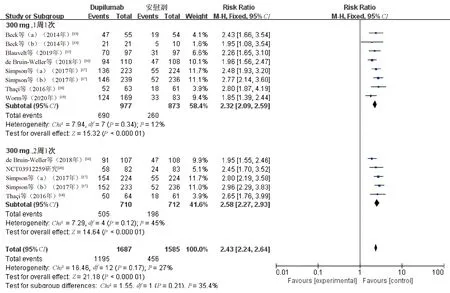
图6 两组患者EASI50比较的Meta分析森林图
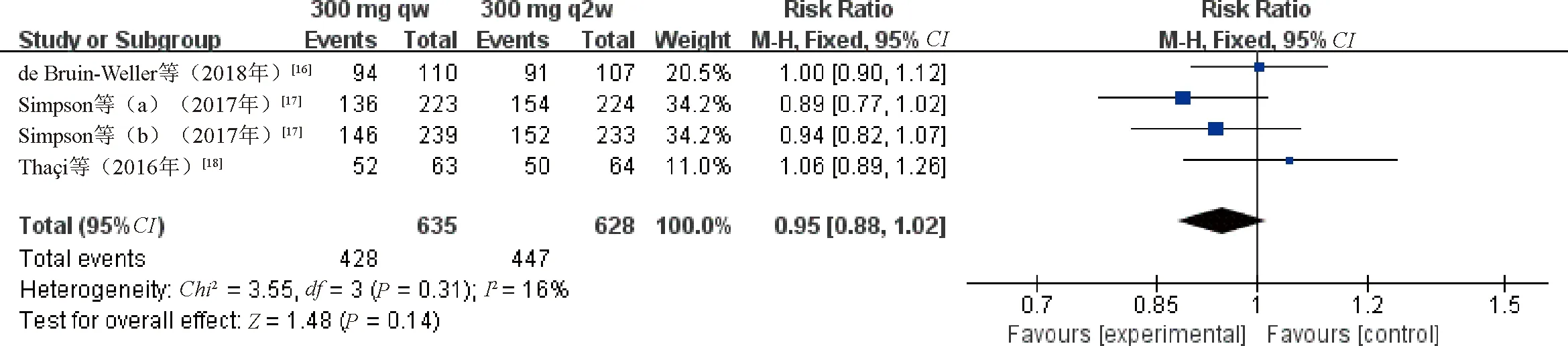
图7 度普利尤单抗300 mg、1周1次亚组与300 mg、2周1次亚组患者EASI50比较的Meta分析森林图
2.3.3 其他结局指标:在SCORAD评分较基线下降的百分比等6项有效性指标疗效方面,度普利尤单抗300 mg、1周1次亚组和度普利尤单抗300 mg、2周1次亚组均优于对照组,差异均有统计学意义(P<0.000 01),见表2。

表2 两组患者其余有效性结局指标比较的Meta分析结果
2.3.4 安全性指标:(1)总不良反应发生率。9项研究[13-19](共3 212例患者)报告了总不良反应发生率。各研究间无统计学异质性(P=0.31,I2=13%),采用固定效应模型合并效应量进行分析。结果显示,研究组与对照组患者总不良反应发生率的差异无统计学意义(RR=1.00,95%CI=0.97~1.04,P=0.90);根据给药频次进行亚组分析,结果表明,度普利尤单抗300 mg、1周1次亚组(RR=0.99,95%CI=0.95~1.04,P=0.79)和度普利尤单抗300 mg、2周1次亚组(RR=1.02,95%CI=0.96~1.08,P=0.59)患者的总不良反应发生率与对照组比较,差异均无统计学意义,见图8。5项研究[14,16-18]报告了度普利尤单抗300 mg、1周1次亚组与度普利尤单抗300 mg、2周1次亚组患者的总不良发生率,各研究间无统计学异质性(P=0.60,I2=0%),采用固定效应模型合并效应量进行分析。结果显示,度普利尤单抗300 mg、1周1次亚组与度普利尤单抗300 mg、2周1次亚组患者的总不良反应发生率比较,差异无统计学意义(RR=0.97,95%CI=0.92~1.03,P=0.39),见图9。(2)其他安全性指标。研究组患者的严重不良反应发生率和皮肤过敏发生率显著低于对照组,头痛发生率、注射部位反应发生率和口腔疱疹发生率显著高于对照组,差异均有统计学意义(P<0.05);研究组与对照组患者其余安全性指标的差异均无统计学意义(P>0.05);度普利尤单抗300 mg、1周1次亚组与300 mg、2周1次亚组患者在各安全性指标方面的差异均无统计学意义(P>0.05),见表3。

表3 两组患者其余安全性指标比较的Meta分析结果

图8 两组患者总不良反应发生率比较的Meta分析森林图

图9 度普利尤单抗300 mg、1周1次亚组与300 mg、2周1次亚组患者总不良反应发生率比较的Meta分析森林图
2.4 发表偏倚分析
通过漏斗图对EASI50进行偏倚分析,结果显示,散点图呈现对称性分布,表明所纳入的研究不存在发表偏倚,见图10。
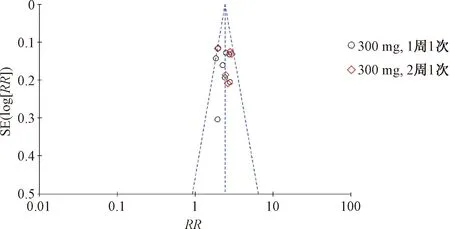
图10 EASI50的漏斗图
3 讨论
IL-4/IL-13细胞通路在AD免疫应答的过程中发挥了关键作用[6]。Th2细胞的过度活化和增殖促进了IL-4和IL-13的分泌,激活下游相关炎症细胞因子,从而影响角质细胞分化、抑制皮肤屏障蛋白和抗微生物肽的产生,导致皮肤瘙痒等症状。度普利尤单抗是一种靶向IL-4Rα的新型单克隆抗体,其能够阻断Th2细胞的IL-4/IL-13细胞通路,避免Th2细胞的过度激活[8-10]。
本研究对度普利尤单抗治疗成人中重度AD的有效性和安全性进行了系统评价。EASI75、EASI50等8项结局指标的分析结果表明,度普利尤单抗300 mg、1周1次和300 mg、2周1次的有效性均显著优于安慰剂,差异均有统计学意义(P<0.05)。亚组分析结果显示,度普利尤单抗300 mg、1周1次亚组与度普利尤单抗300 mg、2周1次亚组患者的所有有效性结局指标比较,差异均无统计学意义(P>0.05)。Blauvelt等[14]进行了一项长达52周的临床试验,结果显示,度普利尤单抗的各项指标均明显优于安慰剂,进一步证明了度普利尤单抗的疗效。
安全性方面,通过对总不良反应发生率等9项结局指标进行分析,发现度普利尤单抗的严重不良反应发生率和皮肤过敏发生率明显低于安慰剂,差异均有统计学意义(P<0.05),表明度普利尤单抗在患者出现过敏的不良反应方面优于安慰剂,这可能是由于度普利尤单抗抑制了Th2的过度激活。但是,在注射部位反应发生率、头痛发生率和口腔疱疹发生率方面,度普利尤单抗均高于安慰剂,差异均有统计学意义(P<0.05),提示临床用药过程中应注意该类不良反应的发生。亚组分析结果显示,度普利尤单抗300 mg、1周1次亚组与度普利尤单抗300 mg、2周1次亚组患者的安全性指标比较,差异均无统计学意义(P>0.05)。结合疗效和安全性,美国食品药品监督管理局批准的度普利尤单抗的临床给药方案为皮下注射,首次600 mg,之后每间隔1周给药300 mg[11]。
本研究共纳入了8篇RCT文献,质量均较高,所得到的Meta分析结果可靠性较高。与之前的Meta分析相比[21-22],本研究纳入了更多高质量以及国内外最新的RCT研究,新增了SCORAD评分、GISS评分和POEM评分等有效性指标,对给药方式进行了亚组分析,并对呼吸道感染、注射部位反应等具体的不良反应进行了分析。但本研究仍然存在不足:(1)纳入的研究较少,未与阳性药物进行比较,仅纳入了安慰剂的比较,尚需设计并分析更多的有关阳性药物的临床对照试验;(2)仅选择了18岁以上的成年人作为研究人群,没有纳入针对儿童或青少年的RCT研究,数据缺乏一定的完整性。
综上所述,度普利尤单抗在治疗成人中重度AD方面的效果优于安慰剂,不良反应轻微,患者可耐受。
