苹果树腐烂病生防链霉菌A144的鉴定及其代谢产物的抑菌活性
2023-02-15鲁致远马昊翔张丽娟
王 宁,黄 伟,鲁致远,罗 义,马昊翔,张丽娟,王 玮
(新疆农业科学院 微生物应用研究所/新疆特殊环境微生物实验室,乌鲁木齐 830091)
苹果树腐烂病(Apple tree valsa cancer)是由壳囊孢(Valsamalivar.mali)侵染引起的一种真菌性病害,主要造成树皮、树干、枝条腐烂,导致树势衰弱、苹果品质和产量下降,严重时可致整棵树枯死[1-2]。目前该病的防治主要通过化学农药,但长期使用化学农药不仅会使病原菌产生抗药性,还会产生环境污染和农药残留等问题,对人类健康造成潜在威胁[3-4]。因此,利用生物防治植物病害成为当前的研究热点,特别是利用微生物防治植物病害越来越受到人们的重视。
放线菌是一类具有重要经济价值的微生物资源,从微生物中发现的生物活性物质约70%由其所产生,其中约50%来自链霉菌[5-6]。利用链霉菌产生的次级代谢产物进行植物病害的防治,因其具有高效、低毒无污染、不易使病原菌产生抗药性等特点,更符合现代农业的绿色可持续发展思路[7-9]。链霉菌能产生多种具有生物活性的次级代谢产物,包括脂肽类抗生素、挥发性物质和抗菌蛋白(如细胞壁降解酶:几丁质酶、蛋白酶和纤维素酶等)[10-11],在植物病害的生物防治方面具有巨大的应用价值。目前已有较多学者对这方面进行了相关研究,Li等[12]筛选获得了一株链霉菌,经鉴定命名为杨凌糖丝菌,其发酵液对苹果树腐烂病菌具有明显的抑菌作用,抑菌带宽度达20.2 mm。Prabavathy等[13]从链霉菌PMS的代谢产物中分离出脂肽类化合物SPM5C-1,浓度为25 μg/mL时完全抑制稻瘟病和水稻纹枯病的生长。基于此,本研究通过形态学观察、生理生化特征以及16S rDNA序列分析确定菌株A144的分类地位,并研究了菌株A144的发酵滤液、脂肽粗提物、蛋白粗提物以及挥发性物质对苹果树腐烂病菌的抑制效果,旨在为今后苹果树腐烂病的生物防治提供菌株资源和理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 菌株A144由新疆农业科学院微生物应用研究所耐辐射微生物资源库保藏。
植物病原真菌:马铃薯黑痣病菌(Rhizoctoniasolani)、西瓜枯萎病菌(Fusariumoxysporum)、水稻恶苗病菌(Fusariummoniliforme)、棉花枯萎病菌(Fusariumoxysporum)、番茄早疫病菌(Alternariasolani)、苹果树腐烂病菌(Valsamailvar.mail)由中国农业大学李健强教授 赠予。
1.1.2 培养基 高氏一号培养基、PDA培养基、PDB培养基、LB培养基、TSB培养基、MRS肉汤培养基、ISP4培养基均购自海博生物技术有限公司。海生菌肉汤2216E培养基购自美国BD公司。ISP2培养基、ISP3培养基按参考文献[14]配置,大米浸液Ⅰ、小米浸液Ⅰ和小米浸液Ⅱ培养基按参考文献[15]配置。
1.1.3 主要试剂与仪器 供试试剂:细菌基因组DNA提取试剂盒,甲醇,盐酸,硫酸铵,磷酸盐缓冲剂,0.22 μm微孔滤膜均购自北京鼎国昌盛生物技术有限责任公司。
供试仪器:超净工作台(浙江孚夏,型号SW-CJ-1F),气浴振荡培养箱(上海天呈,型号TS-2102C),高压蒸汽灭菌锅(上海申安,型号LDZM-60KGS-Ⅲ),旋转蒸发仪(Buchi,型号R-300),扫描电镜(日本电子,型号JEM-1230HC),全自动菌落分析仪(泽析生物,型号ZX-400),正置荧光数码显微镜(Nikon,型号Ci-L)。
1.2 菌株A144的鉴定
1.2.1 形态学观察 将斜面保藏的菌株A144接种至ISP4固体培养基上,于30 ℃培养5~7 d观察菌株生长状态,挑取菌丝进行革兰氏染色,记录菌落颜色形态、气生菌丝颜色、基内菌丝颜色以及可溶性色素的有无。采用插片法在显微镜和扫描电镜下观察菌丝、孢子形态。
1.2.2 生理生化特征 参照《链霉菌鉴定手册》[16]和《放线菌快速鉴定和系统分类》[17]中的方法进行生理生化指标的测定。
1.2.3 16S rDNA序列测定 挑取菌株A144的单菌落接种于100 mL/250 mL三角瓶的ISP4液体培养基,30 ℃、160 r/min培养3 d,10 000 r/min离心1 min收集菌丝体,液氮速冻后研磨,用细菌基因组提取试剂盒提取基因组。菌株的16S rDNA序列测定选择通用引物27F和1492R进行扩增测序,引物序列27F:5′-AGAGTTTGATCCTGGCTCAG-3′ ;1492R:5′-TACCTTGTTACGACTT-3′。PCR扩增采用30 μL扩增体系(模板DNA 2 μL,上下游引物各1 μL,Mix 15 μL,ddH2O 11 μL),扩增程序:94 ℃预变性 4 min;94 ℃变性30 s,54 ℃退火40 s,72 ℃延伸 90 s,30个循环;72 ℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测,目标条带经切胶回收后委托北京鼎国昌盛生物技术有限责任公司测序。测序结果在NCBI数据库上进行BLAST比对,通过MEGA7.0软件采用邻接法(Neighbor-Joining)构建系统发育树,Bootstrap值设为1 000,确定菌株A144的分类地位。
1.3 菌株A144抑菌谱的测定
挑取菌株A144的单菌落接种于50 mL/100 mL三角瓶的2216E液体培养基中,30 ℃、160 r/min震荡培养3 d作为种子液。将种子液接种于新鲜的2216E液体培养基中,发酵条件为接种量2%、装液量100 mL/250 mL三角瓶、发酵温度30 ℃、转速160 r/min、培养时间14 d,即得到菌株A144的发酵液。将发酵液在4 ℃高速冷冻离心机中,10 000 r/min离心10 min,收集上清,过0.22 μm微孔滤膜得到无菌发酵滤液。
采用含药平板法[18]检测无菌发酵滤液的抑菌活性。将无菌发酵滤液与冷却至50 ℃左右的PDA培养基以体积比1∶10混合倒板,制成含发酵滤液的PDA平板。在含药平板中心接种直径为5 mm的供试真菌菌饼,以不含发酵滤液的平板作为对照,30 ℃培养5 d,测量病原菌菌落直径,计算抑菌率,所有试验均设置3个重复。
抑菌率=(对照组病原真菌菌落直径- 处理组病原真菌菌落直径)/对照组病原真菌菌落直 径×100%
1.4 菌株A144代谢产物的抑菌活性
1.4.1 菌株A144不同培养基发酵滤液对苹果树腐烂病菌的抑菌活性测定 将菌株A144的种子液以2%的接种量,接种于不同培养基中, 30 ℃、160 r/min震荡培养14 d。按照“1.3”中的方法收集无菌发酵滤液并制成含发酵滤液的PDA平板。以苹果树腐烂病病原菌为指示菌,将直径为5 mm的菌饼接种于含药平板中央,以不含发酵滤液的PDA平板作为对照,每组3个重复,30 ℃培养5 d,测量病原菌菌落直径,根据 “1.3”中的公式计算抑菌率,筛选菌株A144最佳发酵培养基。
1.4.2 菌株A144脂肽粗提物对苹果树腐烂病菌的抑菌活性测定 按照“1.3”中的方法收集菌株A144的ISP2培养基无菌发酵滤液,采用酸沉淀法提取脂肽,使用6.0 mol/L的盐酸调节pH至2.0,4 ℃静置过夜,4 ℃、10 000 r/min离心30 min后收集沉淀,用等体积100%甲醇萃取2~3次,合并萃取液,然后在旋转蒸发仪中减压浓缩得到脂肽提取物[19]。用无水甲醇溶解,分别配制成浓度为1 mg/mL、10 mg/mL、50 mg/mL的脂肽粗提物溶液,并置于4 ℃冰箱保存,备用。
采用平板涂抹法[20]检测脂肽粗提物的抑菌效果。取100 μL不同浓度的菌株A144脂肽粗提物均匀涂抹于PDA平板上,然后将苹果树腐烂病病原菌接种于PDA平板中央,以未涂抹脂肽类粗提物的PDA平板为对照,每组3个重复,30 ℃培养5 d,测量病原菌菌落直径,计算抑 菌率。
1.4.3 菌株A144蛋白粗提物对苹果树腐烂病菌的抑菌活性测定 按照“1.3”中的方法收集菌株A144的ISP2培养基无菌发酵滤液,在无菌发酵滤液中缓慢加入固体硫酸铵至80%饱和度, 4 ℃静置过夜,10 000 r/min离心20 min收集蛋白沉淀,用少量灭菌的0.01 mol/L PBS缓冲液(pH 7.2)进行溶解,再置于透析袋(截留分子质量为 7 000 u)放入装有PBS缓冲液的烧杯中透析除盐,每8 h换1次PBS缓冲液[21]。将透析得到的蛋白粗提液用无菌的PBS缓冲液分别配制成浓度为50 mg/mL、100 mg/mL、150 mg/mL的蛋白粗提物溶液,检测活性方法同“1.5”,对照组为涂抹PBS缓冲液的PDA平板,每组3个重复,30 ℃培养5 d,测量病原菌菌落直径,计算抑菌率。
1.4.4 菌株A144挥发性物质对苹果树腐烂病菌的抑菌活性测定 通过平板对扣法[14]检测菌株A144的挥发性物质对苹果树腐烂病菌的抑菌活性。通过划线法将菌株A144接种于ISP2培养基上,与中央接种苹果树腐烂病菌的PDA平板对扣(菌株A144平板在下层板,苹果树腐烂病菌的PDA平板在上层板),用双层封口膜密封,以未接种A144的平板为对照,每组3个重复, 30 ℃培养5 d,测量病原菌菌落直径,计算抑 菌率。
1.5 数据处理
采用SPSS 21.0软件对试验数据进行邓肯(Duncan’s)多重比较,结果用“平均值±标准差”表示。采用Graph prism 7.0软件作图。
2 结果与分析
2.1 菌株A144的鉴定
2.1.1 形态学观察 菌株A144革兰氏染色呈阳性,在ISP4固体平板上30 ℃培养7 d后,形成直径约4~7 mm的圆形菌落,向培养基表面隆起,菌落中央呈灰色,边缘白色,疏松、多孔,呈同心环;气生菌丝初为白色,产孢后转为鼠灰色,表面干燥、粗糙;基内菌丝颜色不恒定,呈灰白色或者浅黄色,无可溶性色素产生(图1-A)。菌丝生长旺盛,分支较多,大部分呈松散的螺旋状,部分为勾状(图1-B,1-D);孢子呈卵圆形或椭圆形,链状聚集,表面光滑(图1-C)。
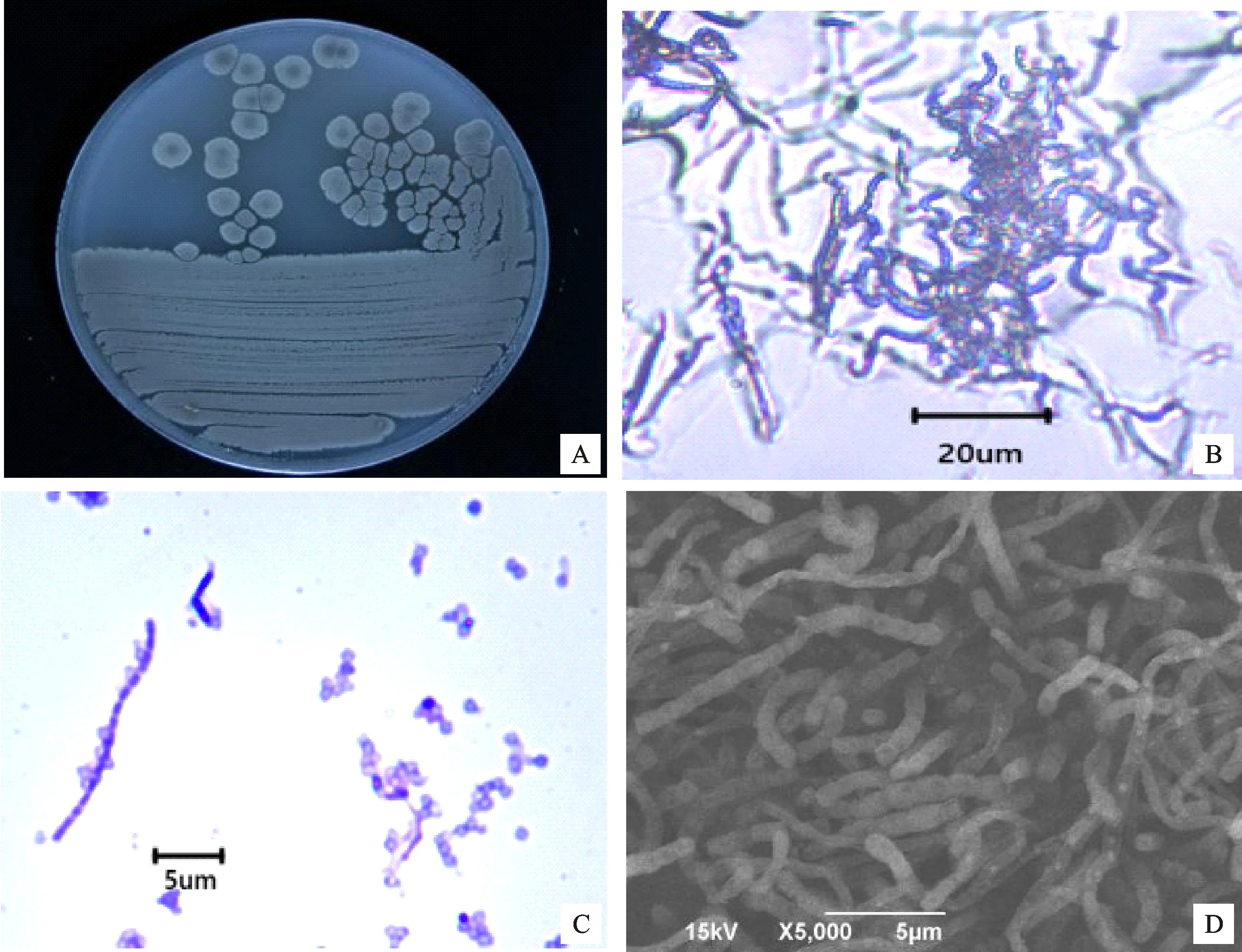
A.菌落图;B.菌体图;C.分生孢子;D.扫描电镜
2.1.2 生理生化特征 菌株A144生理生化特征结果见表1,耐盐范围0~9% NaCl;在pH 5~10内生长;生长温度为15~55 ℃。菌株A144可以产生淀粉酶、蛋白酶、脂肪酶、纤维素酶、脲酶、酪氨酸水解酶、苯丙氨酸脱氢酶和甘油脱氢酶活性,未产生接触酶和硫化氢,无运动性和明胶液化现象,MR试验、V-P试验呈阴性,硝酸还原、七叶甘水解、葡萄糖氧化均呈阳性。
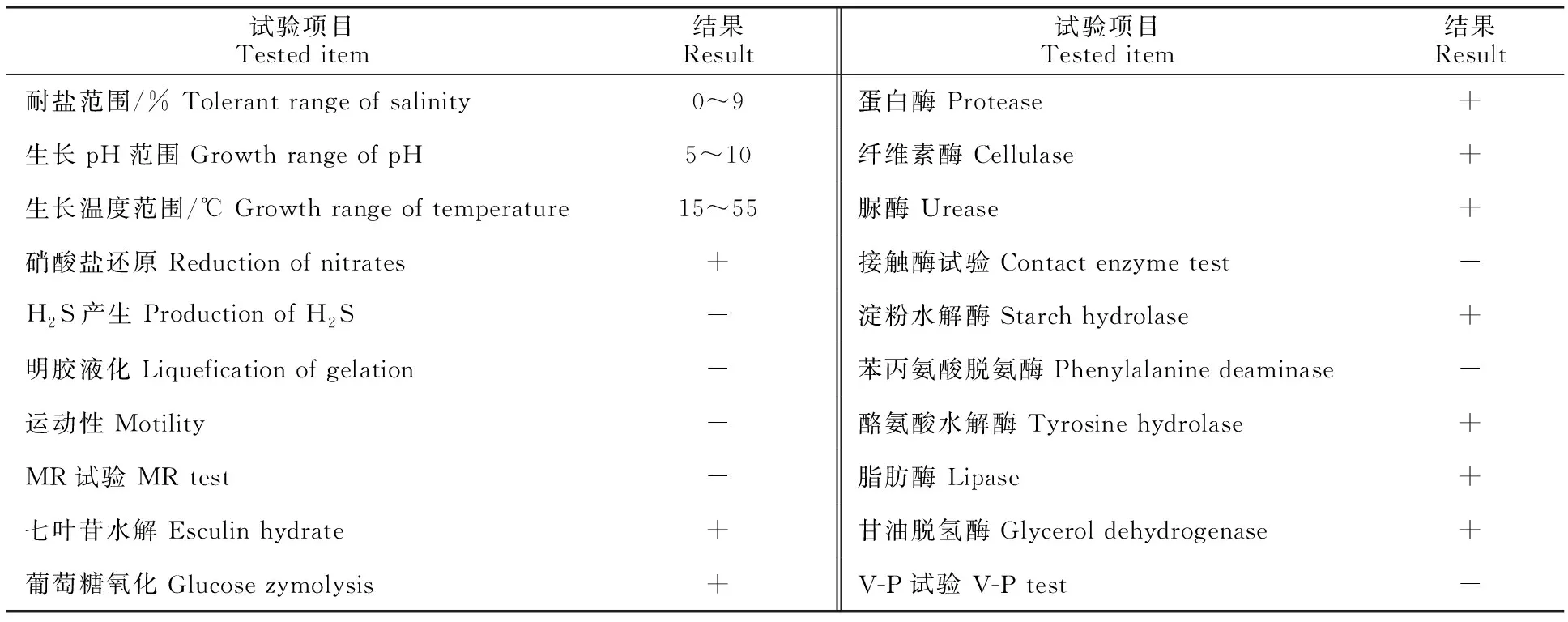
表1 菌株A144的生理生化特征Table 1 Physiological and biochemical characteristics of strain A144
2.1.3 16S rDNA序列分析 通过PCR扩增菌株A144的16S rDNA,经测序结果分析,其序列大小为1 420 bp,在NCBI数据库中进行BLAST比对(Genbank序列登录号:MZ959802),与StreptomycesrocheiNRRL B-2410达到 99.78%,并与多株链霉菌属菌株相似性在98%以上。选取同源性较高的标准菌株序列构建系统发育树(图2),结合形态学观察、生理生化特征和16S rDNA序列分析的结果,最终将菌株A144鉴定为娄彻氏链霉菌(Streptomycesrochei)。
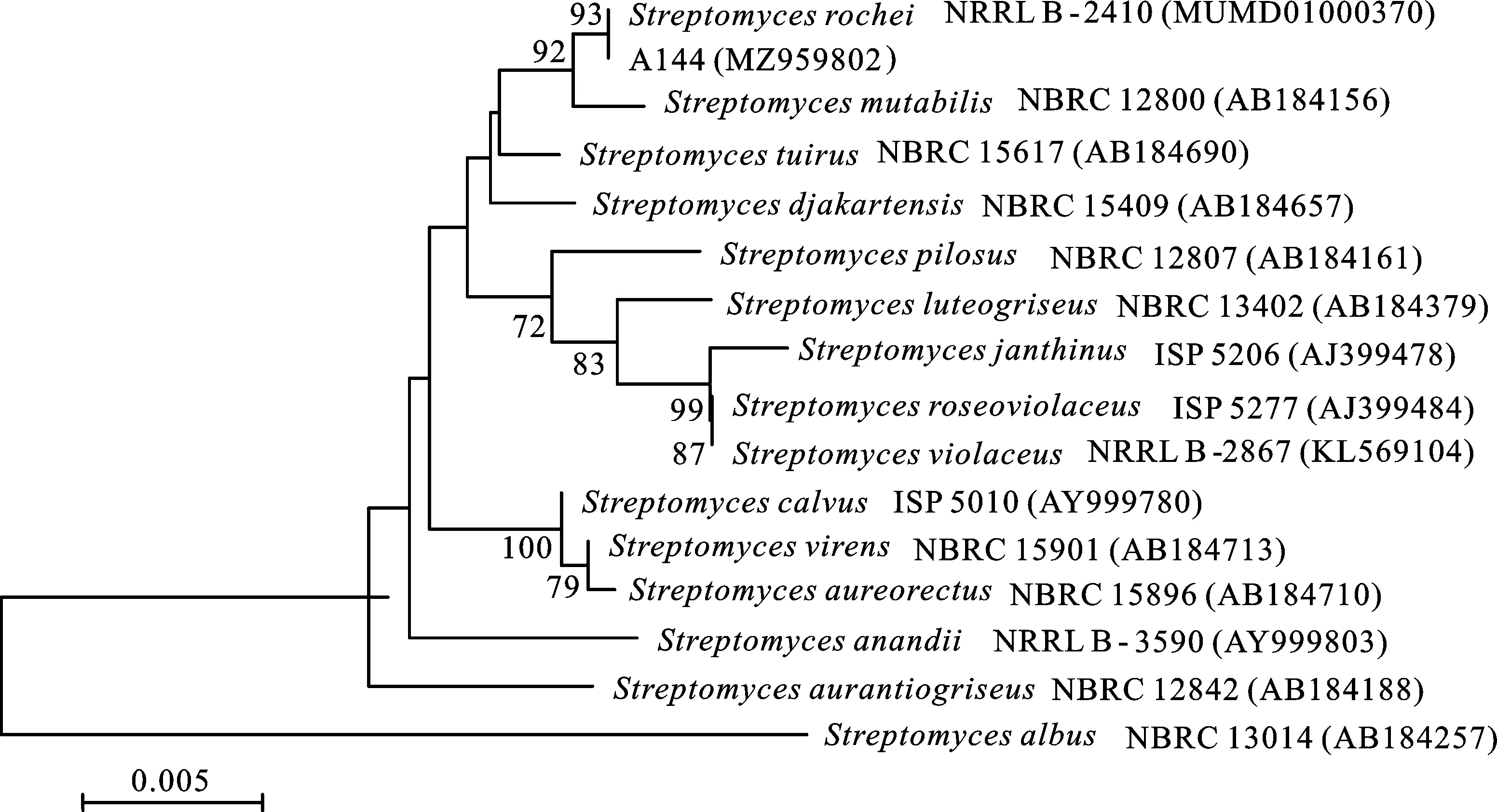
图2 基于16S rDNA序列构建菌株A144的系统发育树Fig.2 Phylogenetic tree of strain A144 based on 16s rDNA sequence cluster analysis
2.2 菌株A144的抑菌谱测定
由图3可知,通过将菌株A144的2216E培养基发酵滤液制成含药平板,对苹果树腐烂病菌的抑菌效果最好,抑菌率为68.15%±2.62%,对西瓜枯萎病菌和水稻恶苗病菌的抑菌效果无显著差异(P>0.05),抑菌率分别为28.90%±1.79%和33.77%±2.59%,对番茄早疫病菌的抑菌率为 11.43%±0.81%,对马铃薯黑痣病菌和西瓜枯萎病菌无抑菌效果。可见,菌株A144的发酵滤液对多种植物病原菌都具有抑菌活性。
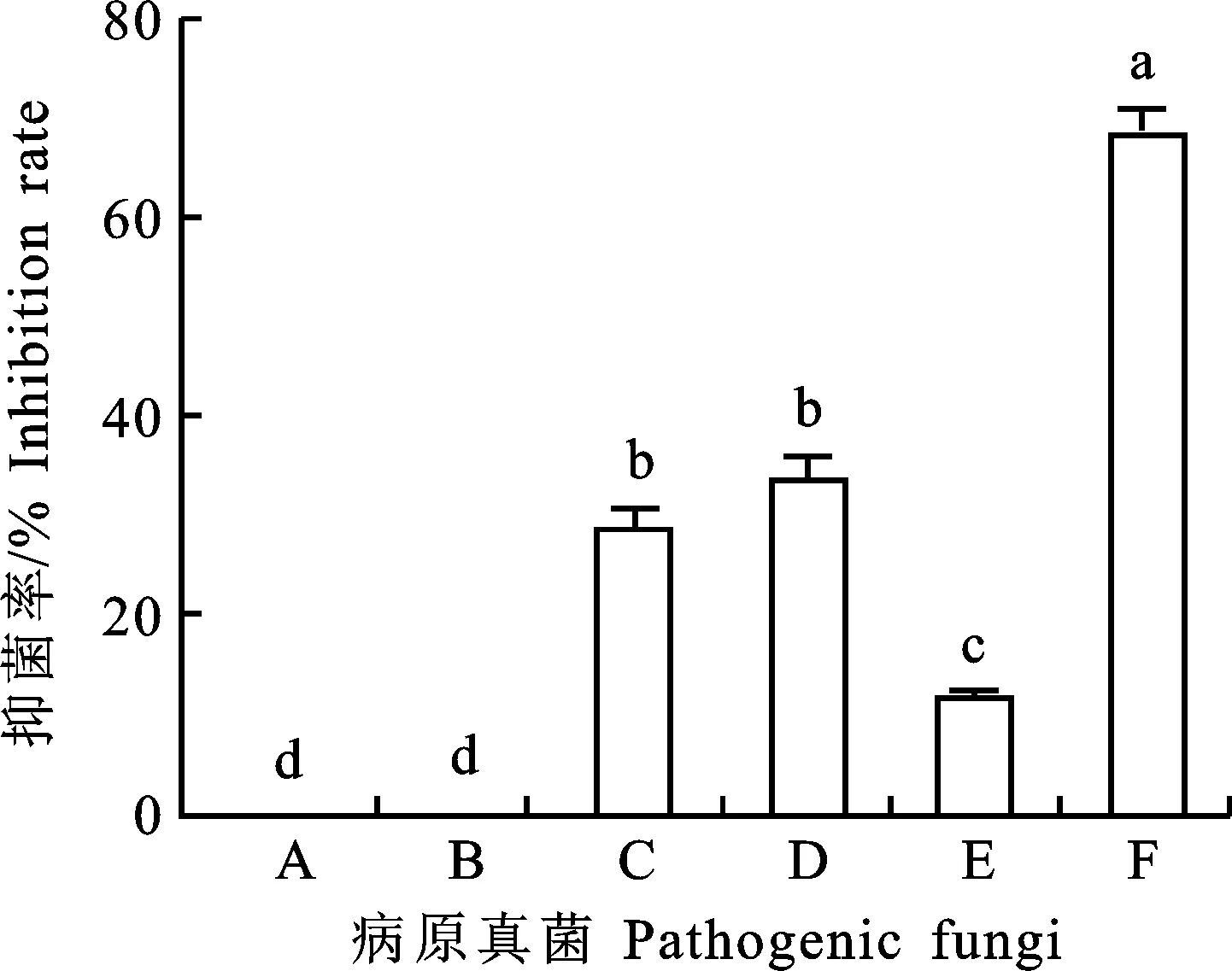
图中相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),下同。“-”表示无抑制效果。A.马铃薯黑痣病菌;B.西瓜枯萎病菌;C.水稻恶苗病菌;D.棉花枯萎病菌;E.番茄早疫病菌;F.苹果树腐烂病菌
2.3 菌株A144代谢产物的抑菌活性
2.3.1 菌株A144不同培养基发酵滤液对苹果树腐烂病菌的抑菌活性 由图4可知,菌株A144不同培养基的发酵滤液对苹果树腐烂病菌的抑菌率差异显著(P<0.05),表明培养基的成分对菌株A144抑菌物质的产生具有一定的影响。其中ISP4、PDB、MRS培养基发酵滤液对病原菌抑菌效果较弱,抑菌率分别为10.70%±0.15%、 18.73%±2.10%和12.01%±1.62%;而ISP2培养基发酵滤液对苹果树腐烂病菌的抑菌效果最好,抑菌率为85.06%±0.86%。根据抑菌率的大小,菌株A144不同培养基发酵滤液的抑菌效果强弱为:ISP2=小米Ⅱ>ISP3=小米Ⅰ>大米Ⅰ>2216E>TSB>高氏一号=LB>PDB>MRS=ISP4。由表2可知,含小米Ⅱ培养基发酵滤液的PDA平板与含ISP2培养基发酵滤液的PDA平板培养至第5天,病原菌菌落直径没有显著差异 (P>0.05)。但随着培养时间的延长,培养至第15天时,含小米Ⅱ培养基发酵滤液的PDA平板上的病原菌菌落直径达33.62 mm±6.26 mm,含ISP2培养基发酵滤液的PDA平板上的病原菌菌落直径达19.38 mm±0.18 mm,两种培养基的发酵滤液抑菌效果差异显著(P< 0.05)。综上所述,选择ISP2培养基作为菌株A144的最佳发酵培养基。
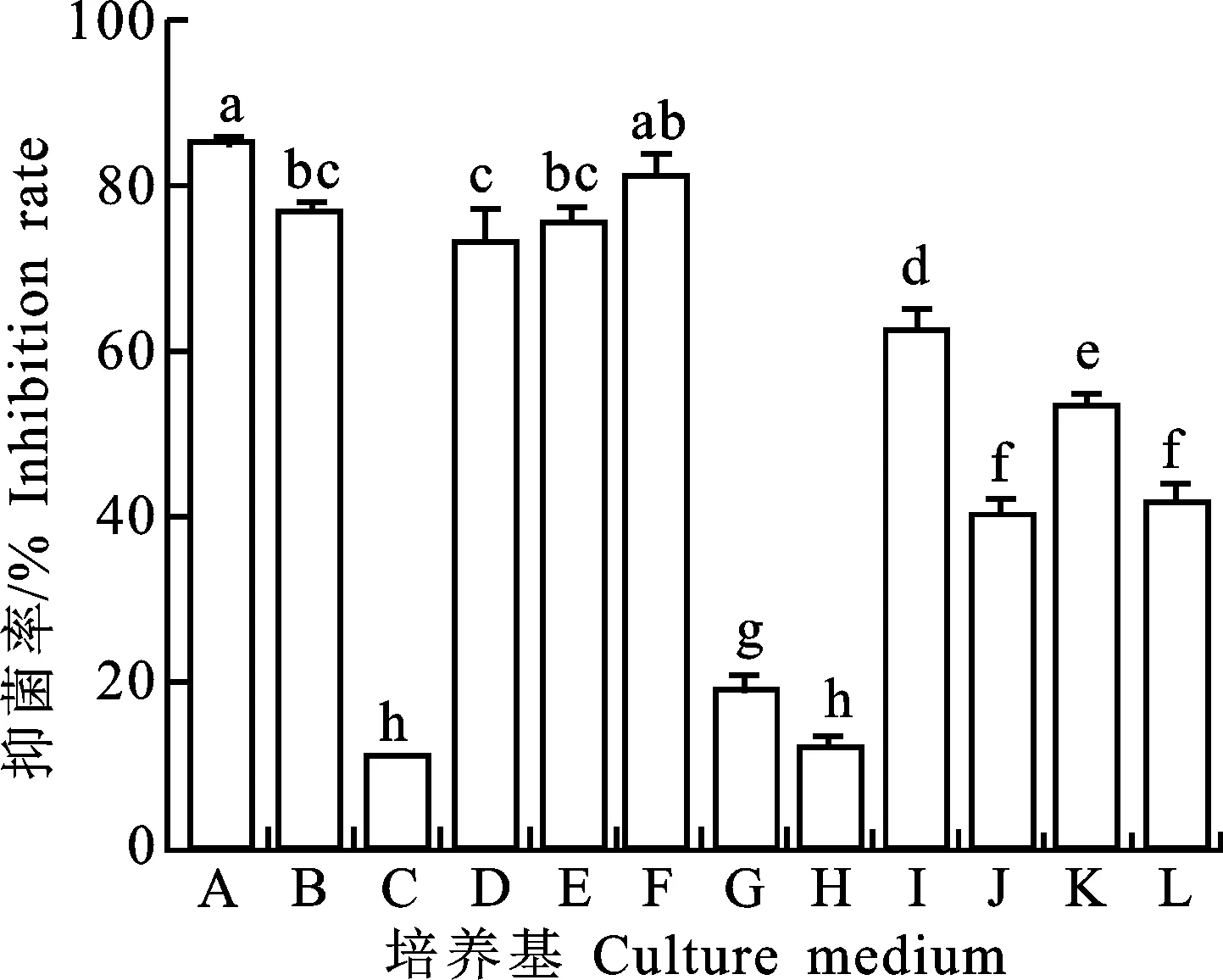
A.ISP2培养基;B.ISP3培养基;C.ISP4培养基;D.大米浸液Ⅰ培养基;E.小米浸液Ⅰ培养基;F.小米浸液Ⅱ培养基; G.PDB培养基;H.MRS培养基;I.2216E培养基;J.LB培养基; K.TSB培养基;L.高氏一号培养基
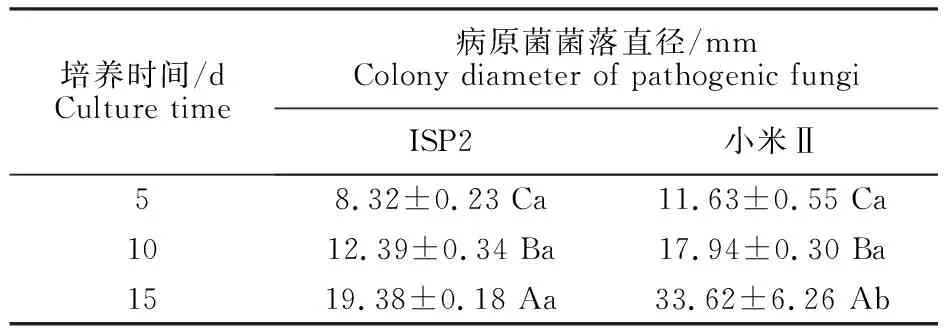
表2 菌株A144的ISP2培养基和小米Ⅱ培养基的发酵滤液对苹果树腐烂病菌的抑制效果Table 2 Inhibitory effect of ISP2 medium and millet Ⅱmedium fermentation broth of strain A144 on Valsa mali var. mali
2.3.2 菌株A144脂肽粗提物对苹果树腐烂病菌的抑菌活性 由图5可知,菌株A144的脂肽粗提物对苹果树腐烂病菌具有较好的抑菌活性。由表3可知,50 mg/mL脂肽粗提物的抑菌率比10 mg/mL和1 mg/mL脂肽粗提物的抑菌率分别高出43.61%和61.23%,具有显著差异(P<0.05)。
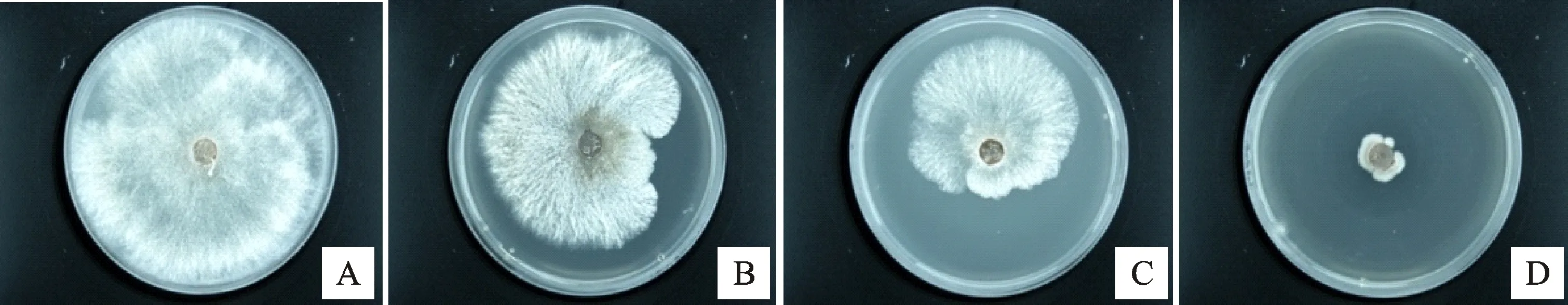
A.甲醇对照;B.1 mg/mL脂肽粗提物;C.10 mg/mL脂肽粗提物;D.50 mg/mL脂肽粗提物

表3 菌株A144脂肽粗提物对苹果树腐烂病菌的抑菌率Table 3 Inhibition rate of crude lipopeptides of strain A144 on Valsa mali var. mali
2.3.3 菌株A144蛋白粗提物对苹果树腐烂病菌的抑菌活性 由图6可知,菌株A144的蛋白粗提物对苹果树腐烂病菌具有较好的抑菌活性。由表4可知,150 mg/mL蛋白粗提物的抑菌率比100 mg/mL和50 mg/mL蛋白粗提物的抑菌率分别高17.29%和28.24%,具有显著差异(P<0.05)。
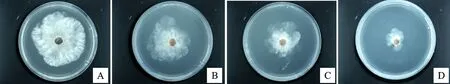
A.缓冲液对照;B.50 mg/mL蛋白粗提物;C.100 mg/mL蛋白粗提物;D.150 mg/mL蛋白粗提物

表4 菌株A144蛋白粗提物对苹果树腐烂病菌的抑菌率Table 4 Inhibition rate of crude proteins of strain A144 on Valsa mali var. mali
2.3.4 菌株A144挥发性物质对苹果树腐烂病菌的抑菌活性 由图7和图8可知,菌株A144与苹果树腐烂病菌进行平板对扣共培养5 d,对照组和试验组的病原菌菌落直径存在显著差异 (P<0.05),抑菌率为22.87%±4.40%,说明菌株A144产生的挥发性物质对苹果树腐烂病菌具有一定的抑菌活性。
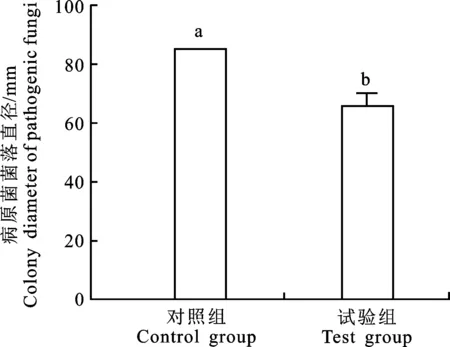
图7 菌株A144挥发性物质对苹果树腐烂病菌的抑制效果Fig.7 Inhibitory effect of volatile substances of strain A144 on Valsa mali var. mali
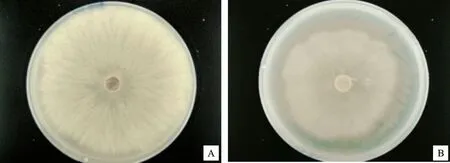
A.对照组;B.试验组
3 讨 论
目前,苹果树腐烂病的防治主要以化学防治为主,但化学防治存在农药残留、病原菌易产生抗药性及环境污染等问题[22],生物防治具有高效、低毒无污染以及不易产生抗药性等优点[8,23],成为当前的研究热点。本研究在前期工作中发现链霉菌A144对苹果树腐烂病菌具有很好的抑菌活性,通过形态学观察、生理生化特征以及16S rDNA序列分析将其鉴定为娄彻氏链霉菌(Streptomycesrochei)。娄彻氏链霉菌广泛存在于自然界中,其用来防治植物病害已有相关报道。薛应钰等[4]从苹果树根际土壤中分离出一株娄彻氏链霉菌,其发酵液对苹果树腐烂病具有较好的抑制效果。李永丽等[24]研究发现,新疆野苹果内生菌娄彻氏链霉菌Am-1发酵液对葡萄座腔菌、苹果拟茎点霉的抑菌率可达95%以上。发酵培养基的成分不仅会影响微生物的生长繁殖,还会影响微生物活性次级代谢产物的合成速率以及产物的产量和种类[25-26]。本研究中菌株A144的12种不同培养基发酵滤液对苹果树腐烂病菌的抑菌效果具有显著性差异(P<0.05),其中使用ISP2培养基培养的菌株A144发酵滤液对苹果树腐烂病菌的抑菌率最高,达到85.06%±0.86%,高于薛应钰等[4]和袁雪等[27]分离的链霉菌对苹果树腐烂病菌的抑制效果。小米Ⅱ培养基与ISP2培养基的发酵滤液制成的含药PDA平板培养至第5天时,抑菌效果差异不显著(P>0.05),但培养至第15天时含小米Ⅱ培养基发酵滤液的PDA平板上的病原菌菌落直径比含ISP2培养基发酵滤液的PDA平板上的病原菌菌落直径大14.24 mm,具有显著性差异(P<0.05),说明ISP2培养基发酵滤液中的抑菌物质比小米Ⅱ培养基发酵滤液中的抑菌物质的稳定性更好。推测可能的原因一方面是ISP2的培养基更有利于菌株A144抑菌物质的产生和其活性的提高,另一方面是培养时间会影响含药PDA平板中抑菌物质的稳定性。本研究中ISP2培养基发酵滤液的抑菌率比ISP4培养基发酵滤液的抑菌率高出74.36%,差异极显著(P<0.01)。ISP4培养基营养成分单一,只有可溶性淀粉作为唯一碳源,(NH4)2SO4作为无机氮源。ISP2培养基成分中葡萄糖作为碳源,酵母提取物和麦芽提取物作为有机氮源。葡萄糖作为速效碳源可直接被微生物利用,可溶性淀粉为迟效碳源,不能被微生物直接利用,需要被分解为单糖才能被利用[28]。有机氮源更利于微生物的生长繁殖和代谢产物的合成[29]。
链霉菌在生长代谢过程中会产生多种类型的抑菌活性物质,这些抑菌物质是链霉菌表现较高抑菌活性和较广抑菌谱的重要原因之一[30]。本试验中菌株A144的脂肽粗提物和蛋白粗提物以及挥发性物质对苹果树腐烂病菌均具有较好的抑制效果,抑菌率分别为81.44%±0.92%、 47.92%±2.55%和22.87%±4.40%。脂肽粗提物是由非核糖体途径合成的,其主要影响病原菌的细胞膜渗透作用,从而抑制病原菌的生长[26]。Wang等[31]分离出来的杨凌糖丝菌Hhs.01对苹果树腐烂病具有抑制作用,从其代谢产物中分离出两种戊烯大环类脂类物质WH01和WH02。蛋白粗提物是由核糖体途径合成的,包括一些细胞壁降解酶(几丁质酶、葡聚糖酶、纤维素酶以及淀粉酶),植物病原菌的细胞壁主要以纤维素和几丁质为骨架,以β-1,3-葡聚糖和蛋白质为主要填充物质,故蛋白粗提物的作用机理为降解植物细胞壁,抑制病原菌生长[32-33]。链霉菌产生的挥发性气体种类丰富,包括醇类、醛类、有机酸类、酮类和烯烃类等化合物,主要通过抑制病原菌菌丝的生长以及孢子的萌发[34]。
本研究中链霉菌A144的发酵滤液、脂肽粗提物、蛋白粗提物和挥发性物质对苹果树腐烂病菌都具有一定的抑菌活性,抑菌率分别为 85.06%±0.86%、81.44%±0.92%、47.92%±2.55%和22.87%±4.40%,表明菌株A144在苹果树腐烂病的生物防治中具有良好的开发和应用潜力。
