复合纳米抗菌肽防治羊皮下脓肿病的效果
2023-02-15韩晓芳郭子记李锦旗张宇豪
王 平,韩晓芳,郭子记,李锦旗,张 利,赵 鹏,张宇豪,华 松
(1.西北农林科技大学 动物医学院,陕西杨凌 712100;2.榆林市榆阳区畜牧技术推广站,陕西榆林 719000;3.榆林市榆阳区畜牧兽医局,陕西榆林 719000;4.榆林市府谷县动物疫病预防控制中心,陕西榆林 719400)
羊皮下脓肿病传染性强,发病率高,病程长,传播范围广,各个品系的绵羊、山羊都易感染,患羊的皮下脓肿形成后会持续增大,临床表现为面部、颈部、胸腹部和尻部等淋巴结部位肿大,因此,常规抗菌药物对该病治疗效果不佳,且容易产生耐药性。不仅造成饲料浪费,增加养殖成本,而且威胁到公共卫生健康,带来的经济损失不可小觑。羊皮下脓肿病例在全国各地均有报道,大多数养殖场的绵羊和山羊脓肿病发病率为2%~7%,部分养殖场可达20%以上。近年来,由于各地大力发展畜牧业,全国各地羊流动频繁,该病的发病率有逐渐提高的趋势。发病以1岁左右的羊居多,发病率随年龄的增大而升高,该病无明显的季节性规律,但以夏秋季为主[1]。环境致病菌的持续存在和羊群皮肤的机械性损伤是导致羊皮下脓肿病的主要诱因。经过农业农村部动物生物技术重点实验室对甘肃、陕西两省几十家养殖场进行羊皮下脓肿病的分离、纯化,发现致病菌主要为伪结核棒状杆菌和金黄色葡萄球菌两种。此外,金黄色葡萄球菌还是肉兔养殖中常见的病原菌,感染兔后引起局部脓肿及其他炎症,症状同羊相似。目前,金黄色葡萄球菌是极易产生耐药性的皮下脓肿病病原菌,几乎可以对所有的抗生素产生耐药性[2]。
随着抗生素残留以及病原菌耐药现象的加剧,抗菌药物无论在新药物研发还是避免耐药性的研究中均遇到了瓶颈[3]。抗菌肽被称为天然的抗生素,具有抗菌谱广、无残留,不易产生耐药性,并且能够调节胃肠道菌群,改善机体的免疫力,保护机体免遭病原菌侵害。目前抗菌肽用作饲料添加剂,预防疾病,改善肠道菌群以及增强免疫力等方面已经取得较好效果。本试验所用的复合纳米抗菌肽,其抗菌活性强于单一的成份[4],并且利用医药级的纳米材料进行包被,使其具有耐高温、耐强酸、易溶于水等优势[5],已被证明对金黄色葡萄球菌、致病性大肠杆菌、链球菌、巴氏杆菌、梭菌和李氏杆菌等常见致病菌有强烈的抑制和杀灭作用。鉴于目前尚未有抗菌肽对羊皮下脓肿病的动物试验和应用研究方面的报道,本研究通过对羊皮下脓肿病组织样本分离到的金黄色葡萄球菌进行抗菌肽体外抑菌活性测试,同时开展试验兔及羊皮下脓肿病的防治试验,以期为抗菌肽替代抗生素用于防治动物皮下脓肿病提供实践依据。
1 材料与方法
1.1 试验材料
试验菌株是从湖羊皮下脓肿病组织样本中分离、纯化所得,经过基因测序确定为金黄色葡萄球菌;营养琼脂(NB)、MH培养基购自北京奥博星生物技术有限公司;复合纳米抗菌肽(由农业农村部动物生物技术重点实验室赠送);试验动物成年健康雌性家兔及全价兔粮购自西安交大实验动物中心。
1.2 常用抗生素对金黄色葡萄球菌的药物敏感性试验
将高压灭菌好的MH琼脂培养基无菌操作分装到直径为90 mm的无菌培养皿中,每个培养皿平均分装15~20 mL,使用棉签蘸取0.5麦氏比浊的菌,在培养皿中分3 次密集划线,使菌落均匀分布于培养基表面;用镊子取药敏片,置于培养基上。将培养皿置于37 ℃恒温箱中培养24 h后测量抑菌圈直径。每种药品做3 个平行,试验重复3 次。培养24 h后,每个抑菌圈测量3 次,取平均值,结果判定依据药敏试验执行标准CLSI(2015版)。
1.3 抗菌肽对金黄色葡萄球菌的体外抑菌试验
1.3.1 微量稀释法最小抑菌浓度测定 称取 1.0 g抗菌肽溶于2 mL蒸馏水中并混匀,以转速 12 000 r/min离心5 min,取上清液,备用。配制0.5麦氏比浊度菌液,取出一块新的无菌的96孔板,从第1 至第10孔分别加入50 μL的MH液体培养基;之后在第一孔中加入50 μL抗菌肽,轻轻混匀后,从第一孔吸取50 μL加入第二孔中,依次类推,到第十孔混匀后吸取50 μL弃掉;最后在第1至第10孔分别加入50 μL菌液,稀释后的质量浓度依次呈现10个梯度(125 000 μg/mL、 62 500 μg/mL、31 250 μg/mL、15 625 μg/mL、 7 812 μg/mL、3 906 μg/mL、1 953 μg/mL、976 μg/mL、488 μg/mL、244 μg/mL),最后置于 37 ℃恒温箱中培养24 h,观察生长情况。
1.3.2 琼脂扩散抑菌圈法细菌活化 挑取单菌落于液体BHI培养基中,220 r/min震荡培养 4 h;稀释菌液:取培养的菌液用生理盐水稀释至 0.5麦氏比浊浓度;1/2营养琼脂培养基配制:按18.0 g/L的比例称取营养肉汤粉培养基,高压灭菌后取出,备用,待培养基冷却至40 ℃时加入 1 mL菌液(1.5×108CFU/mL),随后立即倒入培养皿中冷却凝固,备用。使用牛津杯(内径 6 mm,外经8 mm,高10 mm)在刚刚冷却的培养基中间打孔;加药:吸取抗菌肽原液50 μL滴于打好的孔中,设置3 个平行,置于恒温箱中培养,每隔4 h测量抑菌圈直径,并利用药物敏感性较好的红霉素药敏片进行对照。测量后对同一抑菌圈直径取平均值,结果以“平均数±标准差”表示,用SPSS 18.0软件进行两独立样本的t检验。
1.4 家兔致病模型的构建及防治试验
1.4.1 动物饲养 所有试验兔饲喂在同一条件下(温度18 ℃,湿度30%,环境干净、舒适、通风良好),抗菌肽饲喂量参照本品在牛羊猪上的推荐量(50 g抗菌肽兑1 000 kg饲料),每只试验兔每日饲喂饲料180 g,自由饮水。
1.4.2 试验设计 按照表1将所有试验兔分组,分别设置预防组、治疗组、阳性对照组及健康对照组。
(1)预防组:①抗菌肽饲喂,将抗菌肽溶于无菌水中,按照每日饲料比重0.005%的量,使用1 mL无针头注射管灌服。提前1 周开始每日灌服1 次;②攻毒:参照江炜等[6]对每只试验兔后颈部皮下注射2×109CFU/mL×1 mL的菌,且使用对数期菌株来保证细菌活性;③测量皮下脓肿:从攻毒第2 天起,每隔2 d对每只试验兔进行脓肿测量(纵向直径的长度),同时观察试验兔的精神状态。
(2)治疗组:①攻毒(同上);②抗菌肽饲喂:攻毒后第2天时开始灌服饲喂抗菌肽,比例为每日饲料比重的0.01%;③测量皮下脓肿;④病理切片制作与观察:采集化脓灶周围皮肤组织以及发生明显病变的实质性脏器组织制作组织切片,使用正置显微镜进行切片观察,照片拍摄使用Motic Images plus 2.0软件。
(3)阳性对照组:①攻毒(同上);②测量皮下脓肿。
(4)健康对照组:后颈部注射生理盐水,且正常饲喂兔粮。

表1 金黄色葡萄球菌试验兔分组Table 1 Rabbit grouping for S.aureus test
1.5 抗菌肽防治羊皮下脓肿病试验
试验地点位于甘肃省与陕西省部分湖羊养殖场,防治试验包括6 个羊场和6 个合作社,共计12 个养殖单元,1 614 只湖羊,预防试验和治疗试验各6 个养殖单元,每个试验平均分成试验组与对照组。(1)预防试验:经过两名兽医的全身肉眼观察,结合触摸检查,确定无皮下脓肿的羊,羊只月龄大小不限,50 g纳米抗菌肽兑1 000 kg精料补充料饲喂试验组羊,将单纯的精料补充料饲喂对照组羊,试验周期为5 个月,期间观察、统计羊皮下脓肿病的发病情况。(2)治疗试验:经兽医确定有明显皮下脓肿的羊,先采用外科手术除脓,分成试验组和对照组;试验组羊,用100 g纳米抗菌肽兑1 000 kg的精料补充料进行饲喂;对照组羊,仅饲喂精料补充料,试验周期为1个月,期间测量脓肿的大小,统计其恢复程度。
2 结果与分析
2.1 金黄色葡萄球菌的抗生素药敏结果
为了更好地了解这些地区金黄色葡萄球菌对常用抗菌药物的耐药性,使用临床上最常用的8 种抗生素进行金黄色葡萄球菌药敏试验,发现所有菌株均对青霉素G高度耐药,其次耐药率较高的为苯唑西林、头孢氨苄和氨苄西林,耐药率分别达到61.1%、61.1%和44.4%(表2)。

表2 金黄色葡萄球菌的抗生素耐药率Table 2 Antibiotic resistance rate of S.aureus %
2.2 复合纳米抗菌肽的体外抑菌试验
微量稀释法培养细菌18 h后,发现从第七个孔开始有细菌繁殖,说明第6 个孔为抑制细菌生长的最低药物浓度,因此,该复合抗菌肽对金黄色葡萄球菌的最小抑菌质量浓度为3 900 μg/mL;琼脂扩散法抑菌圈直径如表3所示,抑菌圈直径随时间延长逐渐增大,24 h后抑菌圈最为明显。按照抗菌肽的效价计算公式U= 2X×1 000×N,[其中:X=(D-6)/2.1;D表示抑菌圈直径,N为稀释倍数,单位为mm],得出抗菌肽的效价 U=1.3×107。此外,还发现抗菌肽产生的抑菌圈明显大于红霉素药敏片产生的抑菌圈。

表3 抑菌圈直径Table 3 Inhibition zone diametermm mm
2.3 试验兔皮下脓肿病的预防与治疗
2.3.1 预防结果 皮下脓肿直径变化:预防组兔注射致病菌后,除初期表现短暂的精神沉郁外无任何不良临床症状,试验兔连续16 d均未出现皮下脓肿(图1),说明抗菌肽对金黄色葡萄球菌感染具有较好的预防效果。
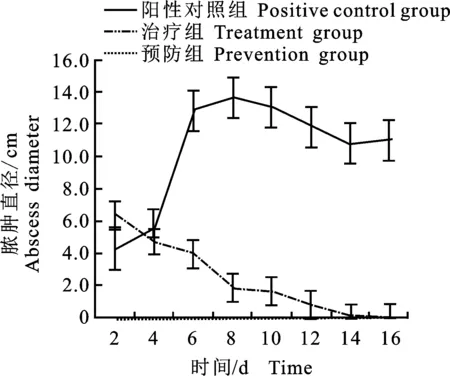
图1 金黄色葡萄球菌皮下脓肿直径变化Fig.1 Changes in diameter of pustule diameter caused by S.aureus
2.3.2 治疗结果 ①皮下脓肿直径变化:治疗组与阳性对照组试验兔致病24 h后,后颈部出现不同程度的皮下脓肿,随着时间延长脓肿逐渐增大,6~8 d时脓肿的直径最大为13 cm(图2),具有波动性;②治疗效果:治疗组试验兔饲喂抗菌肽后皮下脓肿愈合较快,并于14 d时脓肿被完全治愈。而在阳性对照组,脓肿逐渐变软,并且大部分脓肿破裂,对这些兔的皮下脓肿进行外科手术处理,两周后伤口愈合,但是随后陆续有明显的复发。③病理切片观察:对治疗组兔进行皮肤及肺脏病理切片观察,发现皮肤出现炎性细胞浸润(图2-a);肺部病变明显,肺组织出现大量炎性细胞,并发生大范围的出血性浸润(图2-c)。而经过抗菌肽治疗后的皮肤组织(图2-b)与肺脏(图2-d)恢复 良好。
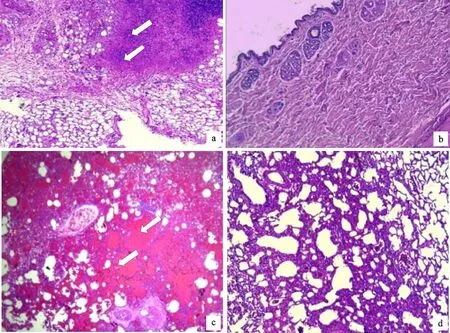
a.致病试验兔皮肤组织内见中性粒细胞浸润(白色箭头所示);b.抗菌肽治疗组试验兔治疗后的皮肤上皮组织恢复正常;c.致病试验兔肺出血,肺泡腔大小不一,毛细血管小动脉扩张充血,肺泡内和肺泡间分布有密集的红细胞(白色箭头所示);d.抗菌肽治疗组试验兔恢复后的肺组织
2.4 羊皮下脓肿病防治效果
2.4.1 预防试验 预防试验过程中发现,试验组发病羊数为5,发病率为0.6%(5/834),而对照组发病羊数为97,发病率为12.4%(97/780),采用抗菌肽预防后羊皮下脓肿发病率明显低于对照组(表4),预防效果显著。

表4 抗菌肽防治羊皮下脓肿病的试验结果Table 4 Experimental results of antimicrobial peptides in prevention and treatment of sheep abscess
2.4.2 治疗试验 将220只具有明显皮下脓肿的育肥羊进行分组饲喂,试验组饲喂纳米抗菌肽,同时结合简单外科手术排脓消毒处理,另一组对照进行常规饲喂,也结合外科手术排脓处理。结果发现,采用抗菌肽治疗的羊,14 d内治愈率为95.5%(105/110),而对照组羊14 d内治愈率为36.4%(40/110),21 d内治愈率为57.3% (63/110),28 d内治愈率为83.6%(92/110),但是在随后的3个月时间内,对照组羊皮下脓肿病的复发率为77.3%(85/110),而试验组无羊发生皮下脓肿病(表4)。图3为试验组羊皮下脓肿病治疗前后的代表性图片。

a与c.治疗前羊皮下脓肿发病图;b与d.抗菌肽治疗后脓肿明显减小
3 讨 论
羊皮下脓肿病是一种慢性消耗性疾病,严重影响着养羊业的发展。而金黄色葡萄球菌是皮下脓肿病的主要病原之一,2019年张斯旂等[7]发现金黄色葡萄球菌在羊皮下脓肿组织样本中的分离率为26.3%,为主要优势菌株,除了可引起羊皮肤化脓性炎症[8]外,还可引起羊乳房炎、肺炎、伪膜性肠炎等疾病[9],可导致病症反复发作,羊群终身带病;关于金黄色葡萄球菌在其他动物上的病例报道也比较多,例如家禽关节肿胀[10]、肉牛[11]、肉兔皮下脓肿[12]及猪关节脓肿病[13]等。此外,该菌还极易产生抗生素耐药性。笔者前期对从羊皮下脓肿病样本分离到的金黄色葡萄球菌进行抗生素药敏试验,发现该菌对青霉素全部耐药,其次对苯唑西林、头孢氨苄和氨苄西林,耐药率均达到44%以上,对庆大霉素的耐药率也达到22.2%,该结果同王登峰等[14]以及燕霞[15]关于金黄色葡萄球菌对青霉素的耐药情况报道相似。因此,采用抗生素治疗羊皮下脓肿病的效果很不理想。在国家号召养殖端减抗、限抗的同时,开发高效、无残留、不易产生耐药性的抗生素替代品十分必要。
2018年,农业农村部制定印发了《兽用抗菌药使用减量化行动试点工作方案(2018-2021年)》,明确规定减少抗菌类药物及相应药物饲料添加剂的使用,并于2020年全面禁止药物饲料添加剂的使用,这势必导致在养殖端起防病、促生长作用的抗生素退出市场,那么抗生素替代物的研究与应用成为新的热点。迄今关于抗生素替代物包括抗菌肽、中草药[16]和植物精油[17]等,其中抗菌肽具有广谱抑菌活性,不易产生耐药性、绿色无公害,提高机体免疫力和抗应激等优势,引起了社会的广泛关注。
抗菌肽被称为天然的抗生素,具备较高的抗菌活性,其杀菌机制主要是通过静电吸附与细菌细胞膜作用,通过物理学作用杀灭致病菌,不易产生耐药性;除了保护机体免遭病原菌侵害之外,还能促进幼龄畜禽的生长发育。更重要的是,抗菌肽是通过靶向作用于致病菌,而对胃肠道正常菌群具有促进和调控作用。试验过程中测得复合纳米抗菌肽对金黄色葡萄球菌的最小抑菌浓度为 3 900 μg/mL,抗菌效价U=1.3×107,同伍小松等[18]测试天蚕素抗菌肽的最小抑菌浓度相似,然而与许君茹等[19]报道的结果差异较大,可能与抗菌肽的纯度、成份以及包被的材料有关[18];本试验中测得抗菌肽抑菌圈为40 mm,该结果同张丽等[20]报道的结果一致。在同等条件下,试验过程中利用复合纳米抗菌肽的抑菌圈直径超过敏感性最高的红霉素药敏片的最大抑菌圈直径,因此,抑菌效果强于普通抗生素。
近年来,有关抗菌肽应用于畜牧业中的报道逐渐增多,在饲料添加剂,预防疾病,改善肠道菌群,增强免疫力等方面已经取得较好效果。例如经过优化后的抗菌肽替代猪精液稀释液中的抗菌药,解决了多药耐药传播的问题[21];张萌萌[22]通过对肠道菌群的丰富度以及差异性分析发现,抗菌肽CC34酵母培养物可促进瘤胃蠕动并增加免疫力;注射抗菌肽使肠绒毛吸收面积增大,提高了饲料的转化率[23];吕月琴等[24]证明,每只奶牛的混合日粮添加10 g的抗菌肽即可提高奶牛产奶量、控制乳汁体细胞数量且提升乳制品质量。
羊皮下脓肿病发生于绵羊和山羊,发病率为2%~7%,部分养殖场可达到20%以上,金黄色葡萄球菌是主要致病菌之一。金黄色葡萄球菌也是兔子皮下脓肿病的罪魁祸首。为了探究抗菌肽在防治动物皮下脓肿病的效果,本试验除了检测抗菌肽的体外抑菌活性外,还进行了动物试验研究,以及实践应用。从试验兔皮下脓肿的致病特点及病理切片观察发现,羊皮下脓肿病病原金黄色葡萄球菌在试验兔与羊皮下脓肿的表现形式一致,均表现为发病前期脓肿逐渐扩大、肿胀、硬度增大,局部温度升高,发病中期具有波动性,发病后期脓肿出现破溃,因此利用试验兔进行前期试验具有可行性。本试验兔皮下脓肿致病菌量是参照试验鼠的皮下脓肿模型致病菌量按照体质量换算所得,通过预试验确定使用2×109CFU/mL×1 mL的金黄色葡萄球菌菌量致病,采用后颈部皮下注射的方式注射,从结果来看,该菌量形成的皮下脓肿发病率高,且试验兔没有出现急性死亡现象。
抗菌肽可以中和内毒素,减轻由内毒素、磷壁酸引起的炎症反应。金黄色葡萄球菌致病后16 d的病理切片显示,皮肤组织炎症反应和肺组织出血明显,这可能与金黄色葡萄球菌致试验兔感染后,皮肤组织结构被破坏以及金黄色葡萄球菌分泌的黏附素、细胞毒素及溶血性外毒素有关[25]。而通过饲喂抗菌肽进行治疗,发现在皮下脓肿恢复后,病理学切片观察到的皮肤组织结构也恢复正常。Herath等[26]证明,抗菌肽能够使内毒素炎症信号分子从单层转为多层聚合体,散失其破坏离子通道的能力,或者干扰内毒素与炎症信号分子的细胞膜受体CD14结合等机制,抑制炎症的发生。总体来说,抗菌肽是通过诱导炎症信号分子失衡减轻病原刺激给机体带来的损伤。结合抗菌肽对试验兔及羊皮下脓肿的防治效果来看,抗菌肽不仅可以预防羊金黄色葡萄球菌发生皮下脓肿病,同时还具有治疗的功能,因此,抗菌肽可以作为饲料添加剂,应用于羊皮下脓肿病的预防和治疗。
