梨火疫病病原菌的分离鉴定及室内抑菌药剂筛选
2023-02-15陈晓晓艾尼赛赛米粟神强贾玉凤
陈晓晓,艾尼赛·赛米,粟神强,贾玉凤,刘 琦,陈 晶
(新疆农业大学 农学院,农林有害生物监测与安全防控重点实验室,乌鲁木齐 830052)
中国是全球栽培梨的三大起源中心之一[1]。梨在中国是仅次于苹果、柑橘的第三大水果[2],且随着近年来农业结构调整的深入和加快,各地梨果产业经济快速发展[3]。新疆作为中国梨果产业的重要产区,2020年库尔勒香梨种植面积约3.09万hm2,总产量为40.27万t[4],香梨种植规模逐年扩大[5]。库尔勒香梨作为新疆地区特色林果树种,是当地农民增收的主要渠道[6]。但近年来,受检疫性、细菌性病害梨火疫病的影响[7],库尔勒香梨产业的发展被严重制约。该病由Erwiniaamylovora侵染所致,因侵染情况复杂[8],传播速度快,传播途径多,寄主范围广,故其致病菌被称为全球十大植物病原细菌之一[9]。
在化学药剂防治方面,国外因长时间使用农用链霉素导致菌株产生抗药性[10]。在中国由于农用链霉素产品已全部退出市场[11],加之中国梨树多为梨火疫病感病品种[12],导致该病害潜在为害流行风险极高。因此,寻找更加高效、快速的替代药剂迫在眉睫[13]。本试验通过从新疆库尔勒地区不同梨园采集的疑似梨火疫病病枝、病叶进行病原物分离、纯化、形态学特征鉴定、致病性检验、分子鉴定和室内毒力测定,以期鉴定出新疆库尔勒地区疑似梨火疫病病原菌及筛选出防治该病的室内有效药剂,为田间防控梨火疫病提供科学依据。
1 材料与方法
1.1 梨火疫病菌的分离纯化、致病性测定和菌种保存
1.1.1 供试材料 采自新疆库尔勒地区不同梨园梨树上的疑似病枝、病叶。
1.1.2 分离纯化 采用平板划线法[14]与NSA选择性培养基[12]进行分离纯化。剪取样品病健交界处0.5 cm2组织块,置于75%酒精中表面消毒30 s,1%次氯酸钠中表面消毒60 s,无菌水冲洗3次后将组织块剪碎放置培养皿中,倒入无菌水浸泡30 min。用接种环蘸取悬浮液在NSA培养基上进行三区划线分离,后置入28 ℃恒温培养箱内培养48 h,待菌落长出后,挑取颜色、形态一致的单菌落在NA培养基上进行纯化培养。
1.1.3 形态学特征 将供试菌株接种于NSA选择性培养基进行分离培养36~48 h[15],NSA选择性培养基由蔗糖作为碳源,利用梨火疫病病原菌在高浓度蔗糖条件下的果聚糖反应,及蔗糖产酸使培养基中的染料变色,产生了高度隆起且光滑的橘红色菌落,据此可初步判断为梨火疫病原菌。而后在NA培养基和NB培养液中纯化培养36~48 h,观察菌落的形态、大小、颜色、生长状况及边缘特征等。
1.1.4 致病性测定 将分离纯化后的菌株接种到健康的梨树离体叶片与海棠树离体叶片上进行致病性测定验证。采摘杜梨苗枝条上4周龄以上、3~5 cm处的嫩叶,海棠枝条上4~8 cm处的叶片,用无菌水洗净晾干,置于90 mm培养皿中,在正面距离叶片1~2 cm的叶柄处,采用针刺接种,并用无菌水沾湿脱脂棉,放置培养皿底部,每天滴加无菌水进行保湿处理。置入28 ℃培养箱恒温培养7 d,观察发病情况,对发病叶片进行病原菌的再分离与鉴定。
1.1.5 分子生物学验证 根据尚琳琳等[16]已报道的检测梨火疫病菌方法,利用北京博迈德基因技术有限公司合成的特异性引物P29F(5′-ggg CAA ATA CTC ggA TT-3′)、P29R(5′-Cgg TTT TTA Acg CTg gg-3′),将回接纯化后的单菌落作为DNA模板,制作25 μL反应体系:2×TAQ MIX:13 μL;ddH2O:10 μL;上游引物P29F:1 μL (10 μmol/L)、下游引物P29R:1 μL(10 μmol/L),而后进行PCR扩增反应,反应程序为:预变性94 ℃ 3 min;变性94 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 90 s,40个循环;最后72 ℃延伸5 min。以ddH2O为阴性对照,以已知梨火疫病菌为阳性对照,经2.0%琼脂糖凝胶电泳检测后,胶回收送至上海生工公司测序。
1.1.6 菌种保存 将经过验证鉴定为梨火疫病病原菌的菌株在NA培养基上进行平板划线分离培养,28 ℃恒温培养36 h后得到单菌落,挑取单菌落置于25 mL的NB培养液中,28 ℃、180 r/min的恒温震荡培养12 h,用分光光度计测定OD600值为1.0~1.2的菌悬液作为试验菌液。用配置好的80%丙三醇和试验菌液按1∶1比例加入冷冻管内,混匀。-20 ℃冷冻短期保存, -80 ℃冷冻长期保存。
1.2 室内毒力测定
1.2.1 供试药剂 本研究共测试16种药剂。药剂名称、剂型、生产厂家详情见表1。

表1 供试杀菌剂试验设计Table 1 Experimental design of bactericides
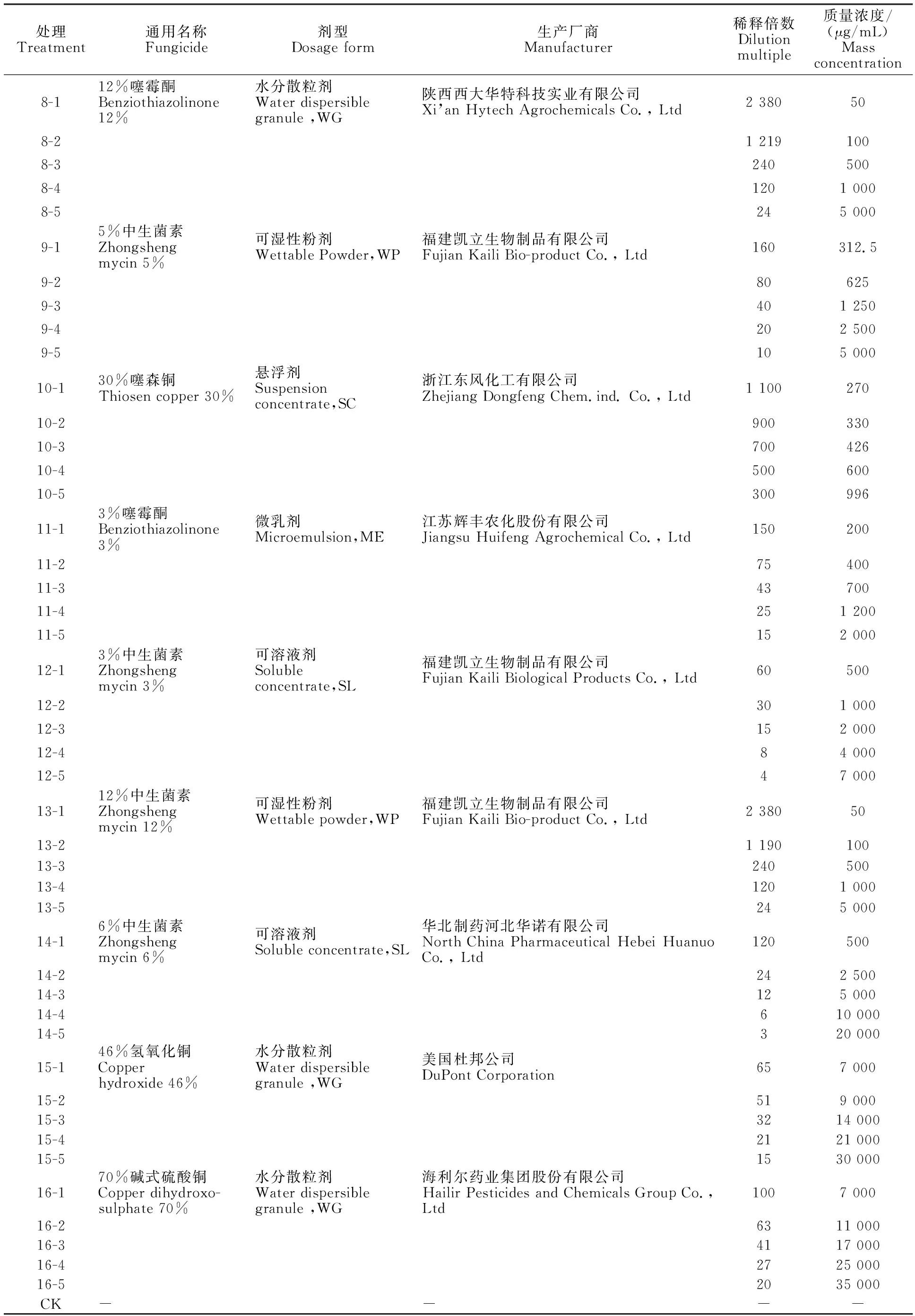
(续表1 Continued table 1)
1.2.2 供试菌株 梨火疫病菌株E.a 01由新疆农业大学植物病害流行研究室从新疆库尔勒地区不同梨园采摘的疑似病样(枝、叶)中分离、鉴定并保存。
1.2.3 试验方法 采用“药液-菌液共培养法”与“抑菌圈法”两种方法进行室内毒力测定。
药液-菌液共培养法:在NA培养基上将保存菌种进行划线分离,28 ℃恒温培养48 h,并二次活化获得单菌落。将单菌落转入NB培养液中28 ℃、180 r/min继续恒温震荡培养12 h,测定OD600值为1.0~1.2时得到试验菌悬液,并置于4 ℃冷藏,备用。按照表1中的有效成分质量浓度梯度,将各杀菌剂依照不同稀释倍数分别加入到50 mL无菌水中制成药液,备用。并按20 mL药液+2 mL菌悬液+20 mL NB培养液的体系混合,在28 ℃、180 r/min恒温震荡器中培养4 h制成混药菌悬液。将不同浓度的混药菌悬液依次按照 1×10-6CFU/mL稀释,吸取106试管中100 μL的液体涂布于NA培养基中至干燥。各药剂5个浓度,每个浓度重复3次,无菌水组为对照。 28 ℃下倒置培养36 h,记录各培养皿中的单菌落个数,并按计算抑菌率。
抑菌圈法:试验菌悬液的制作与“药液-菌液共培养法”中的一致,并将该菌悬液进行1×10-4CFU/mL稀释,吸取104试管中100 μL的菌悬液涂布于NA培养基中至干燥。取直径为6 mm的灭菌滤纸片以等边三角形形式置于平板培养基上,每皿3片。将不同杀菌剂按照表1中的有效成分质量浓度分别加入到50 mL无菌水中制成药液备用。吸取6 μL不同质量浓度的药液滴于纸碟上。各药剂5个浓度,每个浓度重复3次,无菌水组作为对照。28 ℃下正置培养36 h,使用十字交叉法测量抑菌圈直径大小,按下式计算抑菌率。

以EC50值最大药剂为标准药剂,按下式计算各杀菌剂的相对毒力指数[17]。
1.3 数据处理
数据采用Microsoft Excel 2019统计整理,计算各药剂相对毒力指数、毒力回归方程(y=ax+b)及相关系数(R2)。使用SPSS 26.0计算供试药剂的EC50值。
2 结果与分析
2.1 致病菌鉴定
2.1.1 病原菌的形态学鉴定及培养性状 通过划线分离,从病害标本上获得纯化菌株,编号为E.a01。如图1所示,菌落在NSA选择性培养基生长24~48 h后,形成橙红色、中心颜色较深的半球状菌落,且高度隆起,边缘整齐,整体光滑。菌落在NA培养基生长24~48 h后,形成乳白色半球状菌落,且整体隆起,边缘整齐,表面光滑,相较于生长在NSA选择性培养中的单菌落要小。菌落在NB培养液中生长旺盛,菌液浑浊呈云雾状。
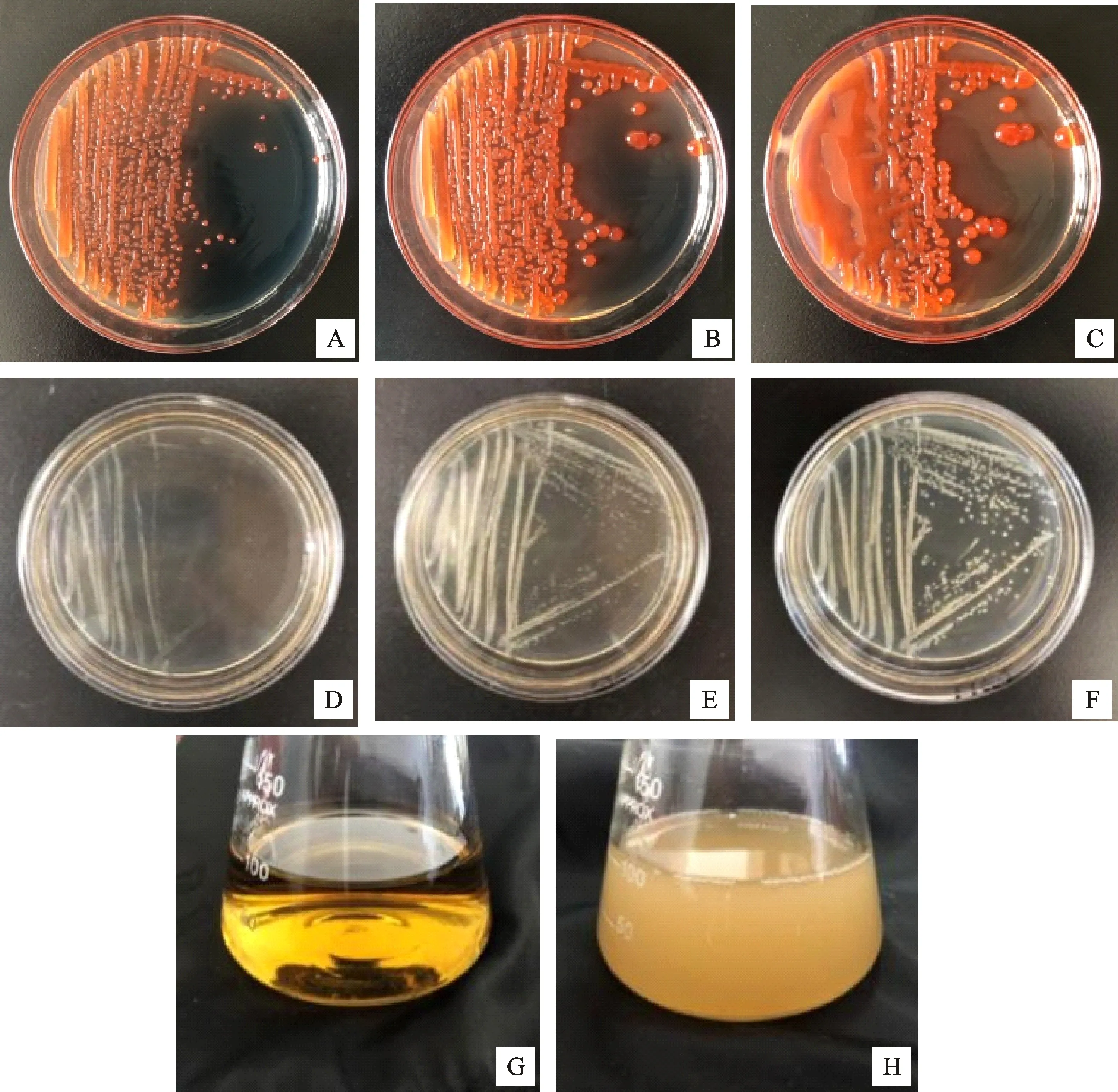
A~C.菌株在NSA培养基上生长24 h、36 h、48 h;D~F.菌株在NA培养基上生长24 h、36 h、48 h;G.NB培养液;H.菌株在NB培养液中28 ℃、180 r/min培养12 h
2.1.2 致病性测定结果 将纯化后的梨火疫病菌E.a 01接种到健康的离体杜梨叶片和离体海棠叶片上,回接24 h后,两种叶片肉眼可见针刺处发黑。48 h后,病菌从叶柄向叶脉处运动,两种不同植物的叶柄已全部被侵染。回接3 d后,两种叶片上的病斑逐渐从叶脉向叶片延伸,海棠叶片侵染速度较杜梨叶片快。4 d后,病菌已侵染至杜梨叶脉三分之一处,海棠叶脉被侵染至二分之一处。回接5 d与6 d后,海棠叶片已逐渐枯黄萎蔫,两者叶片均出现大面积的黑褐色火烧状坏死,与田间发病症状相同,清水对照组的叶片未观察到发病症状,详情见图2。

L-A1~L-A6.1~6 d梨叶清水对照组;L-B1~L-B6. 1~6 d梨叶回接病菌组;H-A1~H-A6.1~6 d海棠叶清水对照组;H-B1~H-B6. 1~6 d海棠叶回接病菌组
2.1.3 病原菌的分子生物学验证 利用梨火疫病特异性引物P29F和P29R对E.a01菌株进行PCR扩增,得到片段大小约900 bp的目标产物,如图3所示,与目的片段大小相似。利用BLAST软件将测序所得P29序列与NCBI(National Center for Biotechnology Information)数据库中已登录的PEA29序列进行同源序列比对,确定分离得到的单菌落为梨火疫病菌(Erwiniaamylovora)。

M.Marker D 2000;+.阳性对照;-.阴性对照;1.梨火疫病单菌落E.a01
2.2 室内毒力测定
由表2可知,16种杀菌剂对梨火疫病病原菌的室内抑菌效果表现差异显著,药剂EC50≤15 μg/mL时,病原菌表现高度敏感的药剂有4种,分别为0.3%四霉素AS、2%春雷霉素AS(江门市植保有限公司、华北制药河北华诺有限公司)、40%春雷·噻唑锌SC,由此表明这4种药剂对梨火疫病病原菌的抑菌效果最好,该病原菌对这4种药剂的敏感性最高。药剂50 μg/mL≤EC50≤500 μg/mL时,病原菌表现中度敏感的药剂有9种:4%春雷霉素SL、20%噻菌铜SC、20%噻唑锌SC、12%噻霉酮WG、5%中生菌素WP、30%噻森铜SC、3%噻霉酮ME、3%中生菌素SL、12%中生菌素WP。药剂500 μg/mL≤EC50≤5 050 μg/mL时,病原菌表现低度敏感的药剂有2种:6%中生菌素SL、46%氢氧化铜WG。70%碱式硫酸铜WG的EC50高于10 000 μg/mL,梨火疫病病原菌对该药剂几乎不敏感。

表2 16种杀菌剂对梨火疫病菌的室内毒力测定结果Table 2 Results of toxicity test of 16 bacteriocides against Erwinia amylovora in laboratory

(续表2 Continued table 2)
从毒力指数上看:以EC50最大的药剂70%碱式硫酸铜WG为标准药剂,其中毒力指数均高于105的杀菌剂有0.3%四霉素AS、2%春雷霉素AS(江门市植保有限公司、华北制药河北华诺有限公司)、40%春雷·噻唑锌SC,表明该4种药剂对梨火疫病病原菌的毒力最强。
综上分析,16种杀菌剂对梨火疫病病原菌均有抑制作用,均可作为有效药剂开展梨火疫病的田间药效实验。推荐3%四霉素AS(辽宁微科生物工程股份有限公司)、2%春雷霉素AS(江门市植保有限公司、华北制药河北华诺有限公司)、40%春雷·噻唑锌SC(浙江新农化工股份有限公司),这4种杀菌剂作为田间药剂防治的首选 药剂。
3 讨论与结论
梨火疫病是危害梨树的最主要细菌性病害,该病害对梨果的生长、产量和品质影响极大,传染风险高,因而,对梨火疫病的防治措施研究一直是科研工作者关注的热点[18]。新疆库尔勒地区梨园发生的疑似梨火疫病症状,经病原菌的分离纯化、致病性测定,分子生物学验证后,结合胡白石[12]报道的NSA培养基菌株培养性状与生理生化反应,确定为梨火疫病。目前化学防治是控制梨火疫传播最常用的方法,本试验采用“药液-菌液共培养法”与“抑菌圈法”测定不同药剂对梨火疫病菌的抑菌活性,以期为下一步的田间药效试验打好基础。
试验结果表明随着杀菌剂浓度梯度的增加,抑制率均相应的提高[19]。0.3%四霉素AS(辽宁微科生物工程股份有限公司)抑制效果最好,EC50为2.968 μg/mL,与白鹏华等[20]已报道的0.3%四霉素AS 对苹果树轮纹病菌的EC50为4.52 μg/mL大致相同,说明四霉素无论对真菌性病害还是细菌性病害菌具有良好的室内抑菌活性。其次,2%春雷霉素AS(江门市植保有限公司)、2%春雷霉素AS(华北制药河北华诺有限公司)和40%春雷·噻唑锌SC(浙江新农化工股份有限公司)对梨火疫病菌室内毒力较好,且不同公司2%春雷霉素AS的EC50值相差不大。梨火疫病病原菌对4%春雷霉素SL、20%噻菌铜SC、20%噻唑锌SC、12%噻霉酮WG、5%中生菌素WP、30%噻森铜SC、3%噻霉酮ME、3%中生菌素SL、12%中生菌素WP的9种杀菌剂处于中度敏感状态。6%中生菌素SL、46%氢氧化铜WG和70%碱式硫酸铜WG的抑制效果较差,病原菌对这3种杀菌剂的敏感性较低。
综上分析,0.3%四霉素AS(辽宁微科生物工程股份有限公司)、2%春雷霉素AS(江门市植保有限公司、华北制药河北华诺有限公司)和40%春雷·噻唑锌SC(浙江新农化工股份有限公司)对梨火疫病菌有较好的抑制作用。需要注意的是,室内毒力测定仅仅是药剂对病原菌直接作用的结果,在环境相对稳定的条件下进行并得出结论,而实际大田种植生产中会受到多种因素影响,因此需进一步进行田间药效验证。本结果只限于室内毒力测定,抑菌效果不等同于田间防治效果,但可作为田间药剂筛选农药的参考依据。还需注意的是长期使用单一药剂进行防治有可能导致病菌抗性增强,药效降低,所以生产上建议交替使用不同的杀菌剂防控梨火疫病,合理用药,避免病原菌抗药性的增强。
