IBRV 重组gD 蛋白的真核表达与间接ELISA检测方法的建立
2023-02-15郭宇杨波兰德松郁茵杨冬梅王旭红云涛牧仁李雷斌孙雨
郭宇,杨波,兰德松,郁茵,杨冬梅,王旭红,云涛,牧仁,李雷斌,孙雨
(1.内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特 010051;2.鄂尔多斯市动物疫病预防控制中心,内蒙古鄂尔多斯 017000;3.辽宁省动物疫病预防控制中心,辽宁沈阳 110164;4.北京市密云区动物疫病预防控制中心,北京 101500;5.广西大学动物科学技术学院,广西南宁 530004;6.中国动物疫病预防控制中心,北京 102600)
牛传染性鼻气管炎(IBR)又称牛病毒性鼻气管炎(BVR)、坏死性鼻炎(NR)或红鼻病(RND),是由牛传染性鼻气管炎病毒(IBRV)引起牛的一种急性、热性传染病。病毒学上,将IBRV 命名为牛疱疹病毒1 型,归属于疱疹病毒科疱疹病毒甲亚科水痘病毒属。IBR 临床上以呼吸困难、鼻漏,以及上呼吸道及气管黏膜水肿发炎、淋巴结肿大、消瘦、产乳量大幅度降低等为主要特征。IBR 的危害在于病毒侵入牛体后可潜伏在一定部位,导致持续性感染,延缓育肥牛群的生长和增重,降低产奶量甚至停乳,使怀孕动物流产[1-2],因而给养殖业带来较大危害,给本病的控制与消灭带来不小困难。本研究旨在建立一种灵敏的IBRV 检测方法,以推动该病的净化、控制进程。
IBRV 基因组为线性双股DNA 分子。基因组分成特异长区(UL,106 kb)和短区(US,10 kb),其中短区被两个反向重复序列(IRS、TRS 各11 kb)包围,因此能够反转方向,使病毒DNA 具有两种异构体[3]。IBRV 基因组可编码约70 个蛋白质,其中有15 个非结构蛋白和33 个结构蛋白,蛋白结构和功能目前大部分已知。研究[4]表明,IBRV 的12个囊膜蛋白中有10 个是糖蛋白(gB、gC、gD、gE、gG、gH、gI、gK、gL 和gM),还有2 个未进行糖基化修饰。其中gB、gC、gD 和gE 4 个主要糖蛋白已完成测序并已在哺乳动物中表达。病毒糖蛋白可以刺激机体产生具有中和活性的抗体,并在病毒感染细胞过程中发挥十分重要的作用[5-7]。gD 蛋白位于基因组的短特异区,是病毒的一个重要结构蛋白。gD 蛋白被认为是病毒粒子表面和病毒感染细胞的主要分子,参与病毒吸附、侵入细胞的过程,是病毒复制的必需蛋白。gD 蛋白能够诱导机体产生体液免疫和细胞免疫,并使机体产生中和抗体来中和病毒。
为获得在Sf9 细胞中高效表达的IBRV gD 蛋白,本研究通过优化IBRV gD 密码子序列,瞬时转染Sf9 昆虫细胞,改进抗原制备纯化条件,使用昆虫杆状病毒表达系统制备出病毒的gD 抗原。以纯化的抗原为基础,成功建立了相关抗体检测方法。
1 材料和方法
1.1 主要材料
大肠杆菌感受态细胞(DH10Bac)、Sf9 昆虫细胞、IBRV gD pFastBacHTA 质粒,由中国动物疫病预防控制中心保存。
1.2 主要试剂
质粒小提试剂盒,购自Promega 公司;SF900昆虫细胞培养基,购自GIBCO 公司;CellfectinTMII Reagen 转染试剂、BCA 蛋白定量试剂盒,购自Thermo Fisher公司;Casein Tryptone、Yeast extract、酶标兔抗牛二抗、Ni-Berpharose FF 纯化试剂盒等,购自北京康为世纪公司。
1.3 转染质粒的设计与构建
利用TMHMM 跨膜区在线预测系统、SignalIP在线预测系统等生物信息学分析软件,分析并预测经典IBRV(GenBank 登录号AFH08294.1)gD 蛋白的跨膜区序列、疏水区序列和稀有密码子。优化目的序列密码子并使用化学合成方法合成IBRVgD核苷酸序列,构建重组IBRV gD-pFastBacHTA 质粒。使用DNAman 软件设计IBRVgD基因扩增引物gD-F 和gD-R。上述引物序列由生工生物工程股份有限公司合成。

表1 IBRV gD 基因引物与M13 通用引物序列信息
1.4 重组质粒PCR 扩增与鉴定
合成上游引物gD-F 及下游引物gD-R,对重组质粒进行PCR 扩增,PCR 扩增后对目的序列产物进行测序并鉴定。
1.5 重组穿梭质粒构建与蓝白斑筛选
将重组质粒以三线法的方式划线接种于LB平板,挑单克隆、摇菌,提取重组质粒IBRV gDpFastBacHTA,利用1.3 中构建的IBRVgD基因上、下游引物进行验证,将PCR 鉴定为阳性的质粒进行测序并鉴定。
1.6 包装重组杆粒病毒并传代
将生长状态良好的Sf9 昆虫细胞平铺于细胞六孔板中,待贴壁1~2 h 后,按照CellfectinTMII Reagen 转染试剂说明书进行转染;细胞培养96 h后,反复冻融收集上清,将其命名为第1 代病毒;从第2 代病毒开始,加入第1 代病毒液和Sf9 细胞培养基,覆盖细胞,1~2 h 后弃去上清,加入2 mL的SF900 II 型细胞培养基;病毒转染细胞培养72 h,传至第5 代后,反复冻融离心收集上清,分装于无菌管做好标记,置于-80 ℃保存备用。
1.7 目的抗原表达与鉴定
将构建的重组质粒转染入Sf9 细胞进行表达。使用PBS 对收集的细胞沉淀进行洗涤,并加入细胞裂解液,冰浴离心后收集上清,使用镍原料纯化试剂盒对抗原进行初步纯化;纯化后,利用SDSPAGE 进行电泳鉴定,同时使用BCA 蛋白定量试剂盒测定纯化的蛋白浓度。
1.8 重组蛋白Western-blot 鉴定
利用Western-blot 进一步鉴定目的蛋白表达情况。以Anti-6x HisTagAntibody 为一抗,室温孵育1.5 h,用TBST 洗涤3 次;以抗鼠二抗作为二抗,室温摇床孵育1 h,用TBST 洗涤3 次;加入DAB显色液,观察条带的相对分子质量大小、清晰度及有无非特异条带。
1.9 gD 抗体间接ELISA 检测方法研究
1.9.1 ELISA 检测方法建立 将制备纯化后的gD抗原,按照8.000、4.000、2.000、1.000、0.500、0.250、0.125 μg/mL 的梯度稀释后,包被于96 孔酶标板中;将IBRV 标准抗体阳性血清及阴性血清分别按1:10、1:20、1:50、1:100、1:200 的稀释度稀释后加入包被好的酶标板中,按照棋盘滴定法验证抗原的最优包被浓度与血清稀释度。使用不同浓度稀释后的牛血清白蛋白(BSA)封闭ELISA 酶标板,并通过不同稀释浓度确定最优封闭浓度。酶标二抗的最佳稀释浓度与作用时间,使用棋盘滴定交叉方法验证。按照IBRV 标准抗体阳性样本与阴性样本的OD450计算P/N值,将P/N最大值对应的ELISA 检测条件作为gD 抗体间接ELISA 检测方法的最佳反应条件。
1.9.2 Cut-off临界值确定 为确定IBRV gD ELISA 抗体检测方法的临界值,使用经血清抗体中和试验鉴定的223 份临床阴性牛血清,通过本研究建立的IBRV gD ELISA 抗体检测方法进行检测,根据检测出相应血清抗体OD450值分析检测出的结果,计算血清抗体的平均OD450值(X)及对应的标准偏差值(SD)。Cut-off临界值按公式计算:Cut-off临界值=阴性牛血清平均OD450(X)+4SD。当OD450>X+4SD 判定为阳性,否则判定为阴性。
1.9.3 特异性检测 使用本研究建立的间接ELISA 方法,对牛病毒性腹泻病毒抗体阳性血清、牛A 型口蹄疫病毒抗体阳性血清、牛O 型口蹄疫病毒抗体阳性血清、牛结节性皮肤病病毒抗体阳性血清进行检测,根据检测的OD450,计算Cut-off临界值,以此判定建立的间接ELISA 检测方法与其他牛类病毒是否存在非特异性交叉反应。
1.9.4 敏感性检测 使用采购的IBRV 标准抗体阳性血清,对本研究建立的间接ELISA 检测方法进行敏感性验证。将IBRV 标准抗体阳性血清按1:8、1:16、1:32、1:64、1:128、1:256、1:512的比例进行倍比稀释后检测,根据检测的OD450计算结果,得出阳性临界值时的最大血清稀释度,并将结果同血清中和试验的中和效价结果进行比对。
1.9.5 重复性检测 使用上述完善的ELISA 方法,对10 份不同中和效价的临床阳性血清进行批内与批间重复性测试,每个阳性血清样本做5个重复,根据检测的OD450计算批内、批间变异系数(CV)。
1.9.6 临床血清样品测试 使用本研究建立的ELISA 抗体检测方法与血清中和试验,对农业农村部兽医诊断中心保存的480 份临床样本进行比对检测,并计算两种检测方法的总符合率(包括特异性符合率、敏感性符合率)。
2 结果与分析
2.1 gD-pFastBacHTA 重组质粒构建与鉴定
使用特异性引物进行PCR 扩增,结果得到了与预期大小一致的PCR 产物片段(305 bp,图1)。将PCR 扩增产物送测序公司进行测序发现,PCR 产物序列与目的基因序列相同(图2),表明IBRV gD-pFastBacHTA 重组质粒初步构建成功。

图1 gD 片段PCR 扩增鉴定结果

图2 Bacmid-IBRV-G 测序比对结果
2.2 重组转座子Bacmid-IBRV gD 的PCR 扩增
使用通用引物与目的序列特异性引物进行交叉PCR 鉴定,结果发现4 对交叉引物均扩增出清晰、明确的目的条带,由此证明除正确目的基因外,连接上的穿梭载体也是正确的,表明IBRV gDpFastBacHTA 重组质粒完全构建成功(图3)。

图3 Bacmid-IBRV gD 的PCR 扩增鉴定结果
2.3 Bacmid-IBRV gD 致细胞病变观察
对细胞进行转染接毒后,在显微镜下观察第3代次细胞。结果(图4)显示:阴性对照组的Sf9细胞生长正常,且在高营养培养基环境下出现部分叠加生长而导致的轻微聚堆现象;感染病毒组的Sf9 细胞发生了特异性细胞病变,出现了明显的增殖抑制、细胞外观变圆、细胞核变大、细胞分散间隙大、细胞质内出现黑色颗粒及杂质等特征。
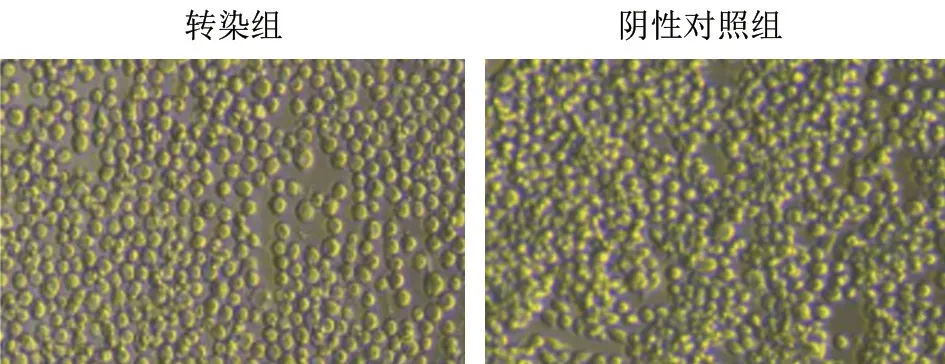
图4 转染Bacmid-IBRV gD 细胞病变(40×)
2.4 不同代次杆状病毒目的基因检测
将第3~5 代重组杆状病毒感染的Sf9 细胞提取基因组后,使用杆状病毒的gD-F/gD-R 为上下游引物进行PCR 扩增,检测各代次病毒基因组有无突变等特殊情况。检测发现,每个代次的扩增片段均一致,且条带明确(305 bp),说明gD序列已成功进入杆状病毒表达系统,并持续稳定存在于各代次的细胞中(图5)。

图5 不同代次杆状病毒目的基因PCR 扩增鉴定结果
2.5 重组蛋白表达与Western Blot(WB)鉴定
纯化后的重组IBRV gD 蛋白经SDS-PAGE 电泳鉴定后,结果在大小约为40 kDa 位置处存在一清晰条带,且前后没有明显杂质,表明纯度非常高(图6);进行WB 试验,结果在与染色胶图目的条带的相同位置出现了明显棕色印记(图7),说明重组IBRV gD 可溶性蛋白成功表达,并且具有较好的反应原性。
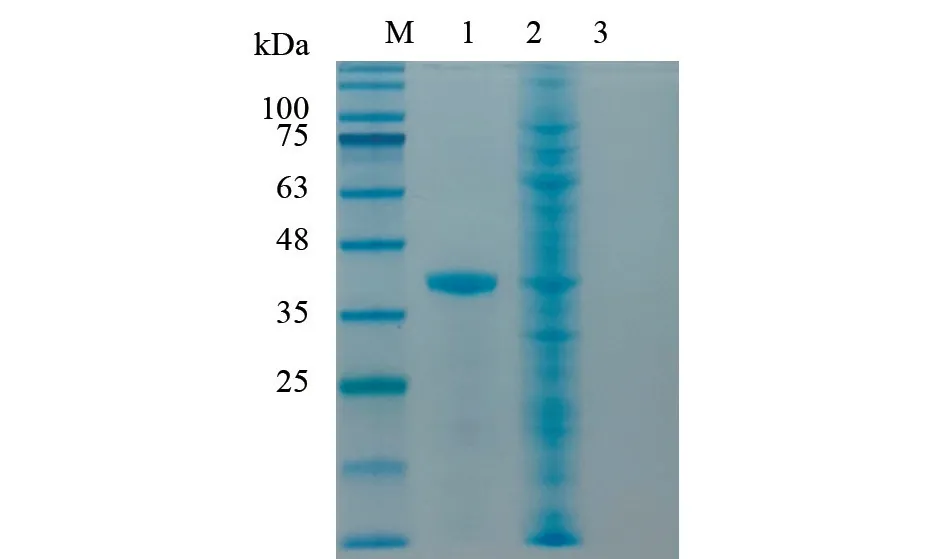
图6 重组IBRV gD 蛋白SDS-PAGE 鉴定结果

图7 重组IBRV gD 蛋白Western-blot 检测结果
2.6 IBRV gD 间接ELISA 检测方法的建立与优化
2.6.1 抗原包被浓度与样品稀释度优化 对抗原包被浓度与样品稀释度进行优化后发现,当抗原浓度为0.5 μg/mL、4℃条件下作用18 h,2.5%BSA、4 ℃条件下封闭24 h,一抗血清稀释度为1:20 倍时,反应45 min,计算得出的P/N值最大。当酶标二抗的稀释度为1:30 000、二抗37 ℃条件下反应45 min,底物反应10 min 条件下的P/N值最高(表2)。
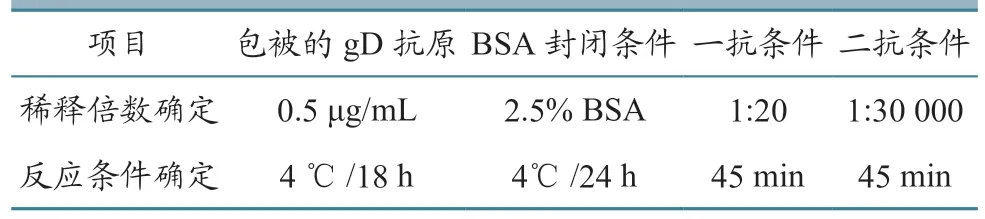
表2 IBRV gD 间接ELISA 检测方法的建立与优化结果
2.6.2 阴阳性临界值(Cut-off值)确定 使用本研究建立的IBRV gD ELISA 抗体检测方法,对经血清抗体中和试验鉴定的223 份临床阴性牛血清进行检测,结果223 份阴性血清平均OD450值()为0.118,SD 为0.061,Cut-off值为+4SD=0.362。
2.7 ELISA 检测方法各指标验证
2.7.1 特异性验证 使用建立的IBRV gD ELISA抗体检测方法,分别检测了牛结节性皮肤病病毒抗体阳性血清、牛O 型口蹄疫病毒抗体阳性血清、牛A 型口蹄疫病毒抗体阳性血清、牛病毒性腹泻病毒抗体阳性血清,检测到的OD450值分别为0.093、0.086、0.107、0.094,均小于Cut-off值0.362,表明重组IBRV gD 抗原对上述牛病毒的抗体阳性血清无任何非特异性交叉反应,证明本研究所建立的方法特异性较好。
2.7.2 敏感性验证 使用购自英国WOAH 参考实验室的IBRV 标准抗体阳性血清(血清中和效价为1:256),对建立的IBRV gD ELISA 抗体检测方法对进行验证。结果显示,建立的IBRV gD ELISA 检测方法在稀释度1:512 时仍为阳性,表明检测敏感性高于传统的血清中和试验方法。
2.7.3 重复性验证 使用建立的间接ELISA 检测方法,将10 份不同中和抗体效价的IBRV 抗体阳性血清分别在同批次板(批内)和不同批次(批间)的酶标板上进行重复性验证,结果批内、批间检测的重复性变异系数均小于10%,表明所建立的ELISA 检测重复性好、变异较小,抗原稳定性较高,可用于不同抗体效价样本不同批次的IBRV 抗体检测(表3)。

表3 间接ELISA 检测方法的重复性验证结果
2.7.4 临床血清样品测试 使用建立的间接ELISA 检测方法结合血清中和试验,对中国动物疫病预防控制中心(农业农村部兽医诊断中心)保存的480 份临床血清样品进行检测,结果发现两种方法的敏感性符合率为98.18%,特异性符合率为93.33%,总符合率为96.67%(表4)。

表4 临床血清样品的测试结果 单位:份
3 讨论
IBR 作为农业农村部规定的二类动物疫病,长久以来给养殖户以及养殖业发展都带来了不小的影响,其一旦发病,尚无有效的药物治疗方法。对于本病的防控,主要采取疫苗免疫、抗体与病原监测,配合种畜群净化等综合措施。检测IBR 疫苗免疫后的中和抗体是评价疫苗免疫效果的重要途径。WOAH《陆生动物诊断检测与疫苗手册》(Manual of Diagnostic Tests and Vaccines for Terrestrial Animals)11.11章有关于IBR的诊断方法,涉及病毒中和试验、病毒分离、电镜观察、常规PCR、间接免疫荧光抗体等,国内只有行标《牛传染性鼻气管炎诊断技术》(NY/T 575—2019)[8]。这些方法为我国现有疫情防控提供了技术支撑。
分子生物学检测方法相较于病毒分离、中和试验等检测方法,具有检测速度快,检测结果量化、准确的优点,但存在病毒血症期短、动物机体样本取样困难、临床检测中不利于大面积监测推广等问题。血清中和试验作为传统的经典检测技术,是检测IBRV 的金标准方法,但其检测周期长、检测成本高、操作繁琐、判据复杂,不适于检测大量样本。本研究选用昆虫表达系统表达gD 蛋白,保留了蛋白原有的糖基化、乙酰化、磷酸化位点。蛋白折叠、二硫键形成更接近于天然蛋白,且表达量高。在此基础上,建立的IBRV 抗体间接ELISA 方法具有诸多优势,其中试验材料获取途径简单,检测速度快、结果准确,对试验环境、设备及人员的要求较低,并且相较于血清抗体中和试验敏感性更高,特异性更强、准确性极佳,可以客观评价IBR 疫苗免疫动物后的抗体免疫保护水平,对临床样本可实现大批量检测,对基层样本可进行大批量筛查,从而可以加快IBR 防控净化进程[8-10]。
目前检测IBRV 抗体的ELISA 试剂盒大多依赖于国外品牌,成本较高,且进口周期长,给基层动物防疫检测工作带来了较大困难。本研究建立的IBRV gD 抗体间接ELISA 检测方法与传统的血清中和试验方法相比,符合率可达96.67%,在保证检测方法特异性的同时,检测敏感性比血清中和检测方法更有优势,临床阳性血清样品检出率也更高,所以检测性能更具优势,具有较好的市场应用前景。同时本研究所建立的方法适合临床样本的大批量检测,可以用于基层IBRV 疫苗免疫效果评价、疫情监测等工作,应用前景广阔。
