鸭坦布苏病毒E 蛋白Domain III 单克隆抗体胶体金试纸条的创制及应用
2023-02-15阚莹张淼卢奇吕炫于胜祖王习强姜雅倩王蓓朱英奇王晴王桂军
阚莹,张淼,卢奇,吕炫,于胜祖,王习强,姜雅倩,王蓓,朱英奇,王晴,王桂军
(安徽农业大学动物科技学院,安徽合肥 230036)
鸭坦布苏病毒病是由黄病毒属鸭坦布苏病毒(duck tembusu virus,DTMUV)引起的一种禽类传染病,主要导致病鸭出现精神沉郁、产蛋下降、四肢麻痹、共济失调等临床症状[1-2]。随着DTMUV 疫苗的上市,鸭坦布苏病毒病目前主要在我国养禽地区呈散在点状暴发态势[3]。尽管鸭坦布苏病毒病未有大规模暴发趋势,但越来越多的研究报道发现新的DTMUV 突变毒株。相较于以往的流行毒株,新发现的DTMUV 突变株在禽类中的致病性更强[4],同时其感染宿主范围也在进一步扩大,在鸡、鹅等禽类中也发现了DTMUV[5]。因此,针对鸭坦布苏病毒病的预防和控制仍需要持续关注。
目前针对鸭坦布苏病毒病主要以预防和监测为主。常用的DTMUV 检测方法比较耗时耗力,诊断效率不高[6]。因此需要建立一种特异性强、灵敏度高,能快速检测DTMUV 的方法,以满足临床样本检测的需要[7]。胶体金免疫层析是以胶体金为标记物,利用抗原抗体反应的专一性而衍生的一种快速检测方法[8-9]。该方法具有检测效率高、安全性好、敏感性与特异性强、经济实用等优点,可用于DTMUV 的快速诊断[10]。囊膜蛋白(E 蛋白)是黄病毒的重要结构蛋白之一,其第三个结构域(Domain III)包含很多中和表位,是抗体结合区域,可以阻止黄病毒与其宿主细胞受体结合,同时也是检测该病毒特异性抗体的靶抗原,对于黄病毒病的控制及其诊断试剂开发具有重要作用[11-12]。
本研究以 DTMUV 重组 E 蛋白Domain III 为免疫原制备的两株单克隆抗体为基础,以纯化的B9D7B8G10 株抗DTMUV 单克隆抗体作为标记抗体,纯化的B9D10C7 株单克隆抗体作为检测抗体,山羊抗小鼠IgG 作为对照,构建一种双抗夹心DTMUV 胶体金免疫层析试纸条。随后对试纸条敏感性、特异性,重复性和稳定性进行检验,并利用RT-PCR 方法与建立的试纸条方法对200 份疑似DTMUV 感染的鸭外周血和组织样品进行检测比较,探究试纸条的准确性。
1 材料和方法
1.1 主要材料与试剂
DTMUV AH-F10 株、番鸭细小病毒(muscovy duck parvoriru,MDPV)、禽白血病病毒(avian leucosis virus,ALV)、鸭瘟病毒(duck plague virus,DPV)、鹅星状病毒(goose astrovirus,GAstV),均由兽医病理生物学与疫病防控安徽省重点实验室保存;分泌抗DTMUV 单克隆抗体的杂交瘤细胞B9D10C7 及B9D7B8G10,由兽医病理生物学与疫病防控安徽省重点实验室保存。
rProtein G 亲和层析凝胶、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠IgG,均购自北京索莱宝科技有限公司;四氯金酸,购自北京伊诺凯科技有限公司;试纸条组装材料,购自杭州布陆斯贸易有限公司。
1.2 方法
1.2.1 胶体金溶液制备 在锥形瓶中加入100 mL超纯水和磁性搅拌粒子,然后加入1.0 mL 1%的HAuCl4溶液,搅拌均匀后,开启加热模式煮至沸腾;一次性加入2 mL 1%的柠檬酸三钠溶液;加热至溶液变为酒红色后,继续煮10 min;冷却后加超纯水定容至100 mL,4 ℃冰箱避光保存备用。通过分光光度计检测吸收峰的变化。
1.2.2 单克隆抗体纯化与鉴定
1.2.2.1 单克隆抗体纯化 选取8 周龄BALB/c雌性小鼠,随机分为2 组,腹腔注射已灭菌的液体石蜡;间隔7 d 后,每组分别腹腔注射适量分泌抗DTMUV 单克隆抗体的B9D10C7 株和B9D7B8G10株杂交瘤细胞悬液;每日观察小鼠状态,7 d 左右小鼠腹部明显膨大时,立即收取小鼠腹水;利用rProtein G 亲和层析凝胶,对制备的两株单克隆抗体腹水进行纯化,并进行SDS-PAGE 检测;最后将纯化后的单克隆抗体在PBS 中透析,用BCA 蛋白浓度测定试剂盒测定浓度。
1.2.2.2 单克隆抗体Western Blot(WB)鉴定 对纯化的两株单克隆抗体进行WB 检测,取10 μL 纯化的单克隆抗体进行SDS-PAGE,随后转0.22 μm PVDF 膜,转膜结束后将PVDF 膜置于含5%脱脂奶粉的TBST 中封闭;封闭结束后洗涤,将PVDF膜置于1:2 000 稀释的HRP 标记山羊抗小鼠IgG中,室温孵育1 h;孵育结束后,再洗涤3 次,按照DAB 显色试剂盒说明书对其进行显色观察。
1.2.2.3 单克隆抗体IFA 鉴定 将BHK-21 细胞铺到6 孔细胞板中,待细胞密度约为80%时,以MOI=0.1 DTMUV 病毒液孵育2 h,弃去病毒孵育液更换维持培养基,置于37 ℃ 5% CO2中培养48 h后弃去维持液,用预冷的甲醛固定细胞;将纯化后的两株单克隆抗体作为一抗,孵育后加入FITC 标记的山羊抗小鼠IgG,DAPI 核染,荧光显微镜观察结果。
1.2.3 胶体金探针制备
1.2.3.1 最佳结合pH 确定 在9 管EP 管中分别加入1 mL 胶体金溶液,第1 管为空白对照,其余8 管分别加入1、3、5、7、9、11、13、15 μL 的0.2 mol/L K2CO3溶液调节pH;加入20 μL 纯化后的B9D7B8G10 株单克隆抗体,混匀后4 ℃静置15 min;加入100 μL 10%的NaCl 溶液,混匀后4 ℃静置3 h,观察溶液颜色变化,通过分光光度计检测吸收峰变化。
1.2.3.2 最佳抗体用量确定 在9 管EP 管中分别加入1 mL 胶体金溶液,第1 管作为空白对照,用0.2 mol/L K2CO3溶液调节至最佳pH。按表1 所示,加入纯化后的B9D7B8G10 株单克隆抗体,4 ℃条件下反应15 min;每管再分别加入100 μL 10%的NaCl 溶液,混匀后4 ℃静置3 h;观察溶液颜色变化,通过分光光度计检测吸收峰变化。
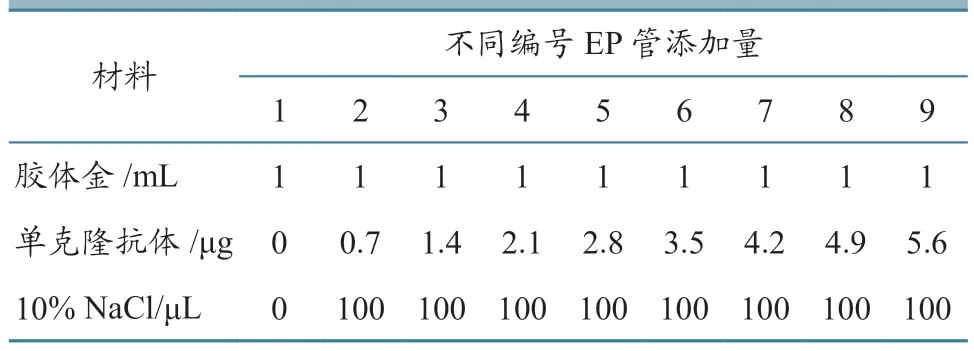
表1 胶体金标记单抗最佳抗体用量
1.2.3.3 胶体金探针制备及纯化 在锥形瓶中加入10 mL 胶体金溶液,再加入0.2 mol/L K2CO3溶液调至最佳pH,混匀后加入适量纯化后的单克隆抗体B9D7B8G10 搅拌30 min,再加入适量的10%BSA 溶液搅拌20 min,最后加入适量的10% PEG-20000 溶液搅拌10 min;将溶液等量分装于洁净的EP 管中,4 ℃条件下离心,2 000 r/min,10 min;离心后吸取上清,在4 ℃条件下离心,9 000 r/min,30 min,弃去上清;每管加入1 mL 0.01mol/L pH 8.0 的Tris-HCl 溶液,4 ℃条件下离心,9 000 r/min,30 min;保留沉淀,重复上一步,最后将留存沉淀用100 μL 0.01 mol/L pH 8.0 的Tris-HCl 混匀,4 ℃避光保存备用。
1.2.4 胶体金试纸条制备 将胶体金探针均匀铺在玻璃纤维素膜上,在NC 膜T 线位置包被纯化后的B9D10C7 株单克隆抗体,C 线位置包被山羊抗小鼠IgG;按顺序组装试纸条,在样品孔分别滴加150 μL PBS 以及感染DTMUV 的BHK-21 细胞培养上清液,静置15 min,观察结果。
1.2.5 胶体金试纸条特性试验
1.2.5.1 敏感性试验 将感染DTMUV 的BHK-21 细胞培养上清液分别按照1:10、1:50、1:100、1:200、1:300、1:400、1:500 比例稀释,每个试纸条滴加150 μL 稀释后样品检测。
1.2.5.2 特异性试验 将实验室保存的DTMUV、MDPV、DPV、ALV、GAstV 稀释后离心取上清,在样品孔滴加150 μL 样品检测。
1.2.5.3 重复性试验 取不同批次制备的胶体金试纸条,在每个试纸条样品孔滴加150 μL 阳性样品检测。
1.2.5.4 稳定性试验 将包装好的胶体金试纸条分别存放于4 ℃和37 ℃,分别于不同时间取出,每个胶体金试纸条样品孔滴加150 μL 阳性样品检测。
1.2.6 胶体金试纸条临床应用 利用本研究制备的试纸条,对200 份疑似DTMUV 感染的鸭外周血和组织样品反复冻融,离心后,每孔滴加150 μL 样品进行检测,并与RT-PCR 方法作比较,探究试纸条的准确性。
2 结果
2.1 胶体金溶液鉴定
通过柠檬酸三钠还原法得到胶体金溶液如图1-A 所示,颜色为酒红色,质地均一,液面上无油状物质;经分光光度计检测,胶体金溶液在520 nm 处出现单一的吸收峰(图1-B)。

图1 胶体金溶液及400~700 nm 波段间的吸光曲线
2.2 单克隆抗体鉴定
2.2.1 单克隆抗体纯化 纯化结果(图2)显示,纯化后两株单克隆抗体均在目标区域处有特异性条带出现,表明其纯化效果较好。经仪器检测后,B9D10C7 株单克隆抗体纯化后质量浓度为1.32 mg/mL,B9D7B8G10 株单克隆抗体为0.17 mg/mL。
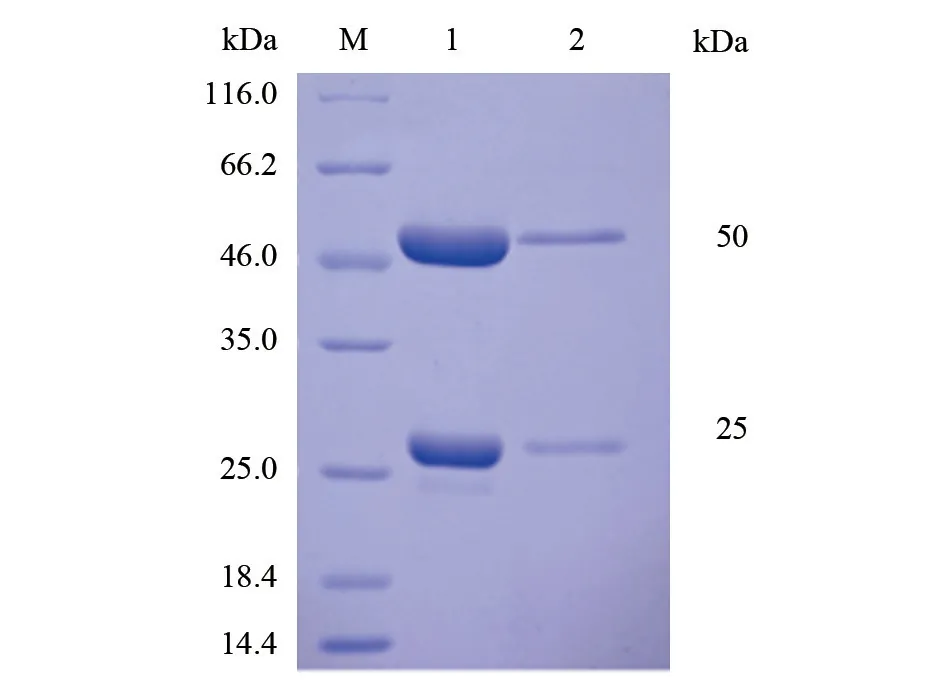
图2 纯化后的两株DTMUV 单克隆抗体SDS-PAGE 分析结果
2.2.2 单克隆抗体WB 鉴定 鉴定结果(图3)显示,两株纯化后单克隆抗体均可产生特异性条带,可用于后续胶体金试验。
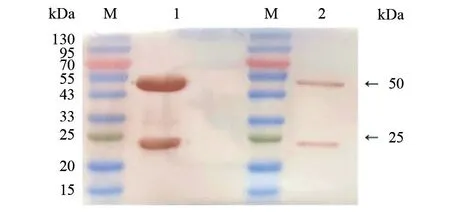
图3 纯化后的两株DTMUV 单克隆抗体WB 分析结果
2.2.3 单克隆抗体IFA 鉴定 鉴定结果(图4)显示,试验组能观察到特异性的绿色荧光,而对照组无荧光,表明两株单克隆抗体反应原性较好,能够识别DTMUV 的天然E 蛋白,可用于后续制备胶体金试验。
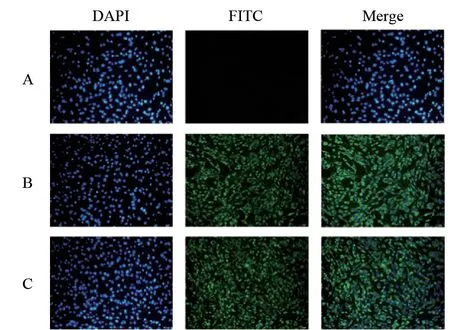
图4 纯化后的两株DTMUV 单克隆抗体IFA 检测结果
2.3 胶体金探针制备
2.3.1 最佳结合pH 试验结果显示,与原液相比,在K2CO3最低加入量为5 μL 时,溶液颜色保持红色(图5-A);经分光光度计测量,当加入K2CO3量为5 μL 时,溶液的吸光值在波长524 nm 时最大,为0.591 5(图5-B)。综合考虑胶体金溶液最佳标记pH 的条件为0.2mol/L K2CO3溶液加入量5 μL。
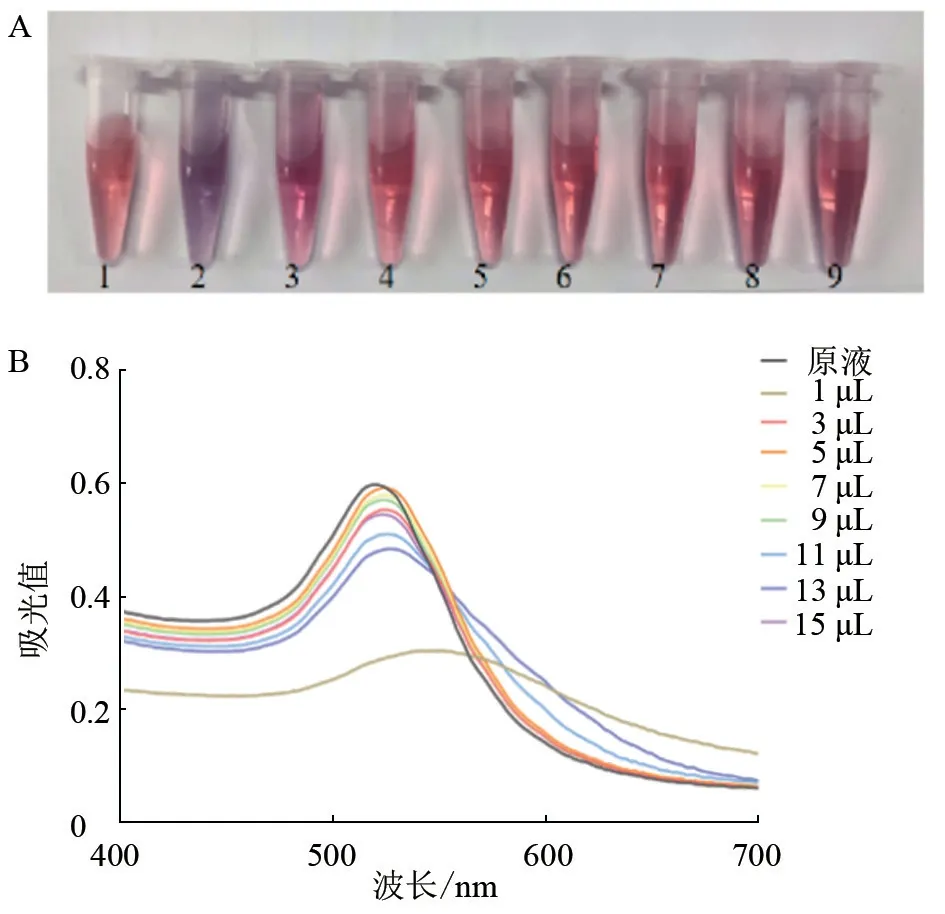
图5 单克隆抗体与胶体金最佳结合pH 试验结果
2.3.2 最佳抗体用量 试验结果显示,与原液相比,在单克隆抗体最低加入量为3.5 μg 时,溶液颜色保持红色(图6-A);经分光光度计测量,当抗体加入量为4.2 μg 时,溶液的吸光值在波长为524 nm 时最大,为0.599 2(图6-B)。综合考虑胶体金溶液最佳标记抗体用量为4.2 μg/mL。
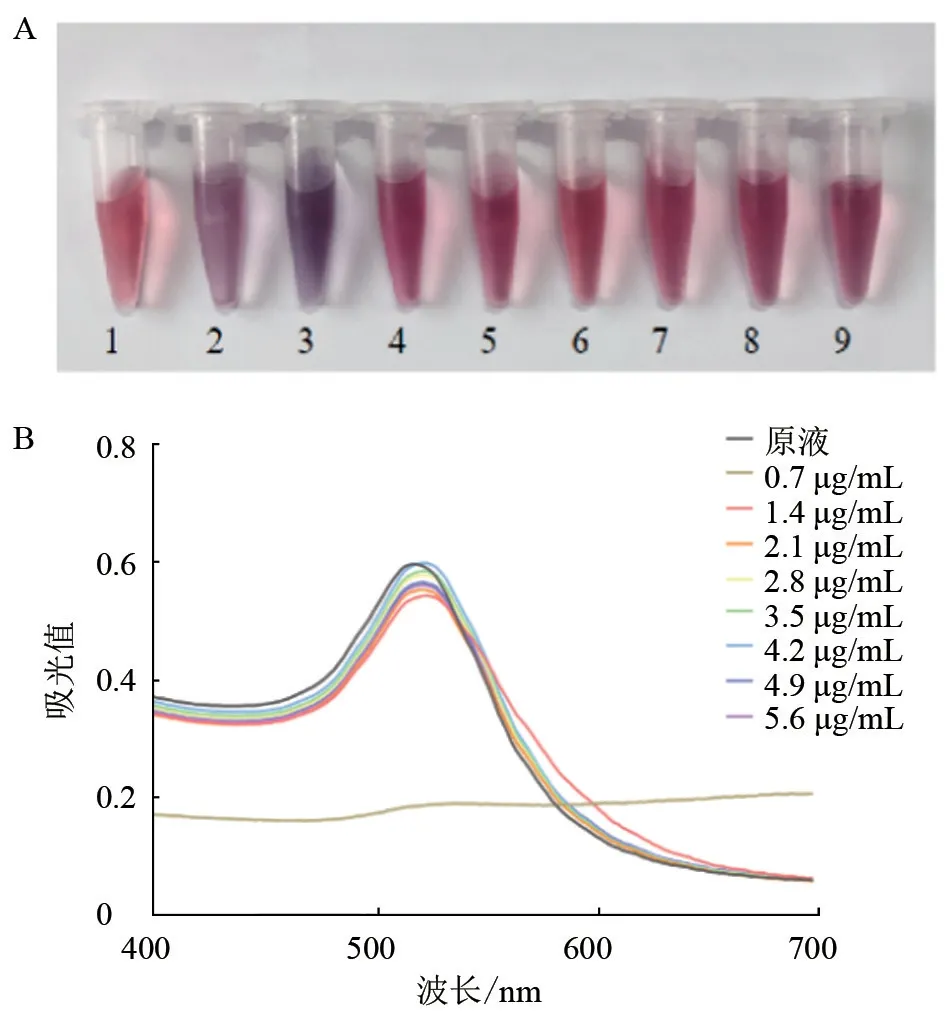
图6 单克隆抗体与胶体金结合最佳抗体用量试验结果
2.3.3 胶体金探针制备及纯化 将保存的胶体金探针过夜取出,结果发现,胶体金溶液颜色保持不变,性状稳定(图7-A);通过分光光度计检测发现,胶体金溶液OD 值增大,吸收峰明显右移(图7-B)。结果说明纯化后的B9D7B8G10 株单克隆抗体成功标记在胶体金颗粒表面。
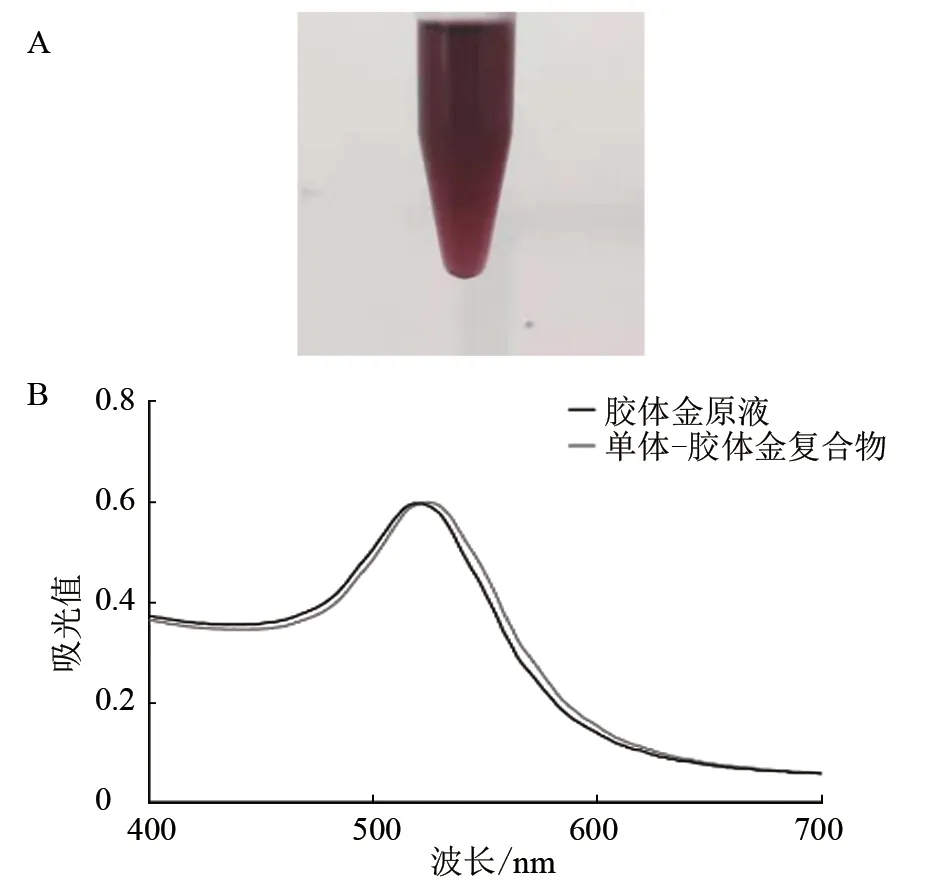
图7 纯化的胶体金探针及在400~700 nm 波段的吸光曲线
2.4 胶体金试纸条初步组装及鉴定
初步组装的试纸条鉴定结果如图8 所示,感染DTMUV 的BHK-21 细胞培养上清液在试纸条检测线(T 线)、质控线(C 线)均呈现红色条带,而PBS 仅C 线有红色条带,说明试纸条制备成功。
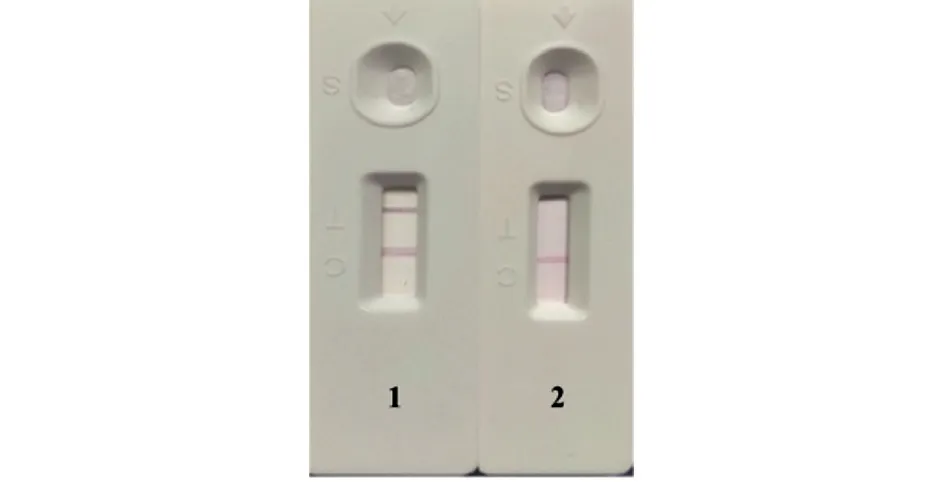
图8 胶体金免疫层析试纸条鉴定结果
2.5 试纸条特性试验
2.5.1 敏感性试验 该试纸条在DTMUV 细胞病毒1:50 稀释时,在C 线和T 线均出现红色条带(图9),说明该试纸条具有良好的敏感性。
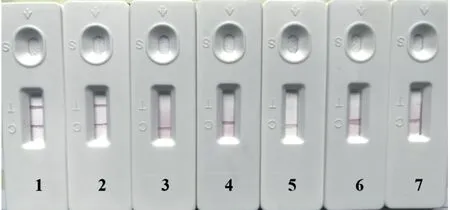
图9 试纸条敏感性试验结果
2.5.2 特异性试验 结果(图10)显示,仅滴加DTMUV 的试纸条呈阳性结果,其他病毒检测均为阴性结果,说明该试纸条具有较强的特异性。
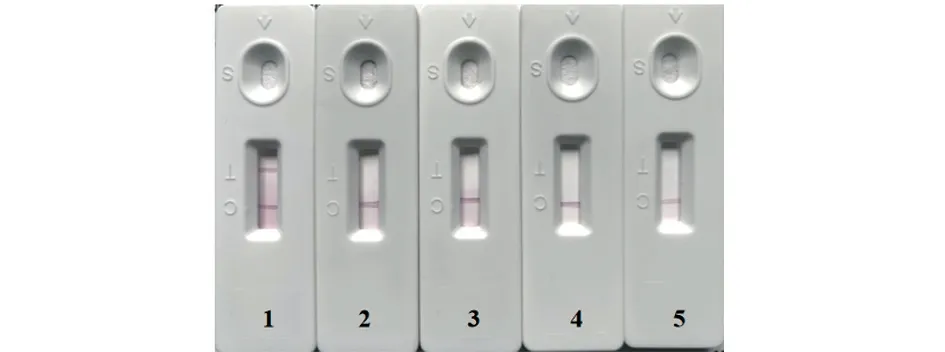
图10 试纸条特异性试验结果
2.5.3 重复性试验 选出不同批次试纸条检测感染DTMUV 的BHK-21 细胞上清,结果发现不同批次试纸条检测均呈阳性(图11),说明该试纸条具有较好的重复性。

图11 试纸条重复性试验结果
2.5.4 稳定性试验 将包装好的胶体金试纸条分别存放于4 ℃和37 ℃,于不同时间取出用来检测感染DTMUV 的BHK-21 细胞上清,结果均呈阳性(图12),说明该试纸条具有较好的稳定性。
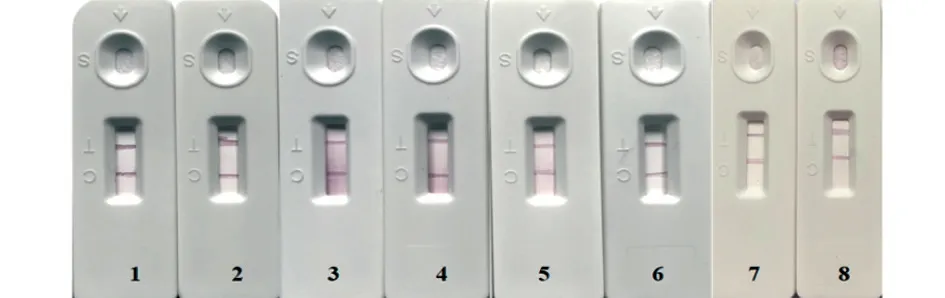
图12 试纸条稳定性试验结果
2.5.5 胶体金试纸条与RT-PCR 方法比较 利用制备的试纸条与RT-PCR 方法对200 份疑似DTMUV 感染的鸭外周血和组织样品进行检测。结果(表2)显示,试纸条检出阳性30 份、阴性170份,PCR 检出阳性34 份、阴性166 份,两者符合率为98%(196/200)。

表2 PCR 与试纸条检测临床样品结果比较 单位:份
3 讨论
DTMUV 是危害我国养禽业的主要传染病病原之一,对其进行快速检测仍然是防控鸭坦布苏病毒病的有效方法[13]。近年来,DTMUV 宿主范围不断扩大,不仅在动物身上分离到病原,在养鸭场管理人员体内也曾发现该病毒的RNA,因而DTMUV 可能对我国公共卫生安全造成一定威胁[14]。同时DTMUV 在感染宿主的过程中,毒力也在不断增强,尤其是变异株的出现,更加大了我国对于该病防控的难度[15-16]。
DTMUV 主要抗原蛋白(E 蛋白)编码区的基因序列与其他禽源DTMUV 同源性较高[16],提示我国流行的黄病毒病均由同一基因型的DTMUV引起。同时E 蛋白是诱导保护性免疫的主要抗原,而本实验室制备的两株单克隆抗体能特异性识别DTMUV 的E 蛋白,是建立DTMUV 检测方法的靶蛋白。建立快速诊断方法有利于及早发现疫病,控制疫病带来的损失[17]。当前对于DTMUV 的常规检测方法都比较费时费力,诊断效率低,不利于疫病的快速诊断[18]。胶体金免疫层析技术具有检测效率高、特异性与敏感性好、实用性高等优点,非常适用于疫病的快速诊断[19]。
胶体金免疫层析技术是20 世纪20年代兴起的一种免疫学检测方式[20]。胶体金溶液是利用四氯金酸溶液在还原剂的作用下生成大小不等的金颗粒,而金颗粒可以与多种凝集素、酶、核酸、毒素、磷酸盐化合物等生物大分子物质结合,形成探针[21-22]。因胶体金探针的形成是通过静电吸附作用,因而不会丧失标记物活性,在免疫标记中被用作示踪剂[23]。1961年Palade 首先将胶体金用作检测毛细血管通透性的超微结构示踪剂,此后胶体金在受体和示踪剂方面运用越来越广泛[24]。与其他方法相比,运用胶体金探针制备的胶体金试纸条特异性高,稳定性好,结果易判断[25]。在实际应用中,胶体金免疫层析试纸条已被广泛应用于各种细菌、病毒、寄生虫检测以及毒品、食品检测等[26-27]。
本研究利用纯化的两株DTMUV 单克隆抗体分别作为标记抗体与捕获抗体,山羊抗小鼠IgG作为对照,构建了检测DTMUV 的胶体金免疫层析试纸条。试验结果表明制备的胶体金试纸条只能特异性检测DTMUV,不与MDPV、DPV、ALV、GAstV 等病原发生交叉反应,在4 ℃与37 ℃各保存3 个月,检测DTMUV 仍有效,制作的不同批次试纸条都可以检测到病毒,说明制备的试纸条敏感性高,特异性强,稳定性与重复性好。
虽然RT-PCR 方法比较费时费力,但其灵敏度高,特异性好,是检测DTMUV 的最常用方法。为了探究制备试纸条检测临床样本的准确性,利用RT-PCR 方法与试纸条同时对200 份临床DTMUV疑似感染样品进行检测,发现两者符合率较高,证明制备的试纸条可以用于DTMUV 检测,从而为DTMUV 快速检测提供了有效工具。
