过表达Cx32对肝细胞癌细胞Huh7增殖、迁移、侵袭能力的影响及其机制
2023-02-14季文斌吕振宇程倩倩周雪丽
季文斌,吕振宇,程倩倩,周雪丽,王 威,杨 燕
(蚌埠医学院第一附属医院肿瘤内科, 安徽 蚌埠 233004)
肝癌是最常见的恶性肿瘤之一,其中肝细胞癌(heptocellular carcinoma, HCC)约占75%~85%。这类患者早期症状隐匿,被诊断时通常为疾病中晚期,死亡率极高[1,2]。发现HCC 新靶标并针对这些靶标研发新的药物将为改善HCC 的预后提供帮助。缝隙连接蛋白32(connexin 32,Cx32)又称β1 连接蛋白。作为缝隙连接(gap junction,GJ)家族的主要成员之一,Cx32 在正常肝细胞中表达较高,并在人肝脏中形成GJ 通道,其中由Cx32 组成的GJ 约占肝脏 总GJ 的90%[3]。关 于Cx32 在HCC 发 生 发 展 中的作用目前仍存在争议。如Nakashima 等[4]认为Cx32 是一种肿瘤抑制基因,其数量和分布异常可能与人类HCC 的发生有关。本研究团队前期研究也发现,肝细胞的癌变过程与Cx32 的减少或缺失密切相关,恢复Cx32 表达可能是HCC 治疗的一种有前景的策略[5]。然而,也有一些研究结果表明Cx32可能在促进肿瘤细胞侵袭及肿瘤转移中发挥重要作用。例如,Cx32 蛋白在Huh7 细胞质中的积累可促进HCC 细胞的侵袭和转移[6],并通过增强自我更新能力来扩大Huh7 细胞中癌症干细胞群[7]。鉴于一些有争议的研究结果多在Huh7 细胞中被发现,且本研究团队前期已经成功构建由慢病毒介导稳定高表达Cx32 的Huh7 细胞 系[8],本研究 继续围绕这一工具细胞开展后续Cx32 在Huh7 细胞系中的体外细胞功能学研究。
上皮-间质转化(epithelial-mesenchymal transformation, EMT)被认为与HCC 的侵袭转移密切相关[9]。EMT 是一种上皮细胞转化为具有间质表型的生物学过程,在这一特殊的转化过程中,相关标志物的表达会发生改变[10]。然而,调控EMT 启动的具体机制仍在探索中。本研究聚焦于过表达Cx32 对Huh7 细胞增殖、迁移和侵袭的影响以及在EMT 这一过程的作用研究,为进一步揭示Cx32 在HCC 发病及进程中的作用、特点及潜在机制提供更多的实验数据和理论依据。
1 材料与方法
1.1 主要材料与试剂
人类正常肝上皮细胞株LO2 和人类HCC 细胞株(Hep3B、Huh7、HepG2、SMMC-7721)分别由南京凯基生物科技发展有限公司和中国科学院上海细胞库提供;胎牛血清、DMEM 基础培养基和RPMI 1640 基础培养基均购自Gibco 公司;小鼠单克隆抗体Cx32 购自Sigma 公司,小鼠单克隆抗体E-cadherin、Vimentin 及 多 克 隆 抗 体Snail 购 自Abcam 公司,小鼠单克隆抗体β-actin 抗体购自Santa Cruz 公司,异硫氰酸荧光素(FITC)、Cy3 标记的二抗购自Santa Cruz 公司;BCA 蛋白定量试剂盒购自Bio-Rad公司,Matrigel 胶购自BD 公司,ECL-plus 化学发光试剂盒、PVDF 膜购自Millipore 公司;慢病毒载体由上海吉玛公司合成。
1.2 细胞培养
LO2、Hep3B、Huh7、HepG2 细 胞 和SMMC-7721 细胞分别培养在DMEM 培养基和RPMI 1640培养基中,两种培养基均由相应基础培养基、10%胎牛血清和1%青-链霉素构成;日常培养于恒温培养箱中,待细胞生长至合适融合度时,消化传代培养用于后续实验。
1.3 慢病毒介导稳定高表达Cx32 的Huh7 细胞系的构建
本课题组前期已经成功构建Cx32 过表达慢病毒载体LV5-GFP-hCx32,该载体能够稳定感染Huh7 细胞,使细胞过表达外源基因Cx32。获得的稳定高表达Cx32 的Huh7 细胞系的具体方法及鉴定见本研究团队既往研究[8]。本研究继续在该工具细胞上开展后续体外细胞功能学研究。
1.4 Western blot
待细胞长满后,裂解细胞并提取蛋白;检测蛋白浓度,上样电泳,电转至PVDF 膜上,封闭液封闭15 min 后,孵育一抗(稀释比为:Cx32 1∶500,Vimentin 1∶1 000,E-cadherin 1∶1 000,Snail 1∶1 000,β-actin 1:500)于4 ℃过夜。次日洗膜后,与二抗(稀释比为:Cx32 1∶1 000,余指标1∶5 000)室温孵育2 h,洗膜后ECL-plus 试剂盒化学发光,Bio-Rad 成像仪器检测信号。
1.5 免疫荧光
取对数生长期的细胞爬片,用4%多聚甲醛固定30 min 后,加入一抗室温孵育3 h;避光室温孵育荧光二抗2 h 后,DAPI 处理5 min。最后漂洗并封片,在倒置荧光显微镜观察。
1.6 MTT 实验
调整细胞密度为3 000 个/孔后,铺板于96 孔板,培养箱静置24 h。每孔加入10 μL 浓度为5 mg/mL 的MTT 溶液,继续培养4 h 并离心后弃去上清液;每孔加入DMSO,摇床摇晃10 min,用酶标仪测定细胞OD490值。
1.7 细胞划痕实验
调整细胞密度为1.5×106个/孔后,铺板于6 孔板中,待显微镜下观察细胞融合成单层状态时,用无菌的微量枪头在孔内均匀的划线,继续置于培养箱中培养。于0 h 和24 h 通过倒置显微镜观察划痕宽度,并计算划痕愈合率。细胞划痕愈合率(%)=[(0 h 划痕面积-24 h 划痕面积)/0 h 划痕面积]×100%。
1.8 Transwell 侵袭实验
将Matrigel 液加入培养基充分混匀后,加入小室的上室;将各组细胞以1.0×105个/孔密度进行铺板,在下室加入800 μL 完全培养基培养24 h;将小室上层未侵袭细胞除去,用4% 多聚甲醛溶液和0.1%结晶紫各处理20 min,经PBS 洗涤并干燥后,显微镜下拍照并计数。
1.9 统计学处理
用Prism 9.0(Graphpad Software)软件进行统计分析和作图。实验数据使用均数±标准差(±s)表示。t检验用于两组间计量资料比较,单因素方差分析(ANOVA)用于多组间计量资料比较。P<0.05 为差异具有统计学意义。
2 结果
2.1 生信分析HCC 组织与正常肝组织中Cx32 mRNA 与蛋白质的表达情况
TCGA 数据库下载数据并分析示,Cx32 mRNA 在HCC 组织的表达量低于癌旁肝组织(图1A),且其表达水平随着HCC 患者T 分期、组织学分级及临床分期的进展而降低(P<0.05)(图1B、D、E),与N 分期呈负相关趋势(P>0.05)(图1C);CPTAC 数据库显示,Cx32 在正常肝组织中蛋白表达量高于HCC 组织(P<0.01)(图1F)。

图1 不同生信数据库中Cx32 mRNA 与蛋白的表达情况Fig 1 Expression of Cx32 mRNA and protein in different public databases
2.2 Cx32 在HCC 细胞中的表达及Cx32 OE 细胞系的构建
为明确Cx32 在HCC 细胞中的表达情况,通过western blot 检测发现,与正常肝上皮细胞LO2 相比,Hep3B、Huh7、HepG2、SMMC-7721 细胞中的Cx32 蛋 白 表 达 量 均 显 著 降 低(P<0.05)(表1、图2A)。
表1 Cx32 在人正常肝细胞和不同HCC 细胞系中的蛋白表达水平(n=3,±s)Tab 1 Cx32 protein expression in human normal hepatic epithelial cell line and different HCC cell lines(n=3,±s)

表1 Cx32 在人正常肝细胞和不同HCC 细胞系中的蛋白表达水平(n=3,±s)Tab 1 Cx32 protein expression in human normal hepatic epithelial cell line and different HCC cell lines(n=3,±s)
注:与LO2 细胞相比,*P<0.05。
Cx32 0.99±0.11 0.19±0.09*0.20±0.16*0.27±0.76*0.63±0.08*40.31 0.00类别LO2 Hep3B Huh7 HepG2 SMMC-7721 FP
在明确Huh7 细胞系低表达Cx32 的基础上,我们利用既往构建成功的稳定过表达Cx32 的Huh 细胞模型[8]进行后续实验,并经western blot 和IF 一致证实该模型细胞存在Cx32 蛋白过表达(P<0.05)(表2、3,图2B、C)。
表2 不同组Huh7 细胞中Cx32 的蛋白表达水平(n=3,±s)Tab 2 Cx32 protein expression in different groups of Huh7 cells(n=3,±s)

表2 不同组Huh7 细胞中Cx32 的蛋白表达水平(n=3,±s)Tab 2 Cx32 protein expression in different groups of Huh7 cells(n=3,±s)
注:与Control 比较,*P<0.05;与NC 组比较,♯P<0.05。
Cx32 1.02±0.10 1.02±0.13 1.56±0.20*♯13.39 0.00组别Control NC Cx32 OE FP
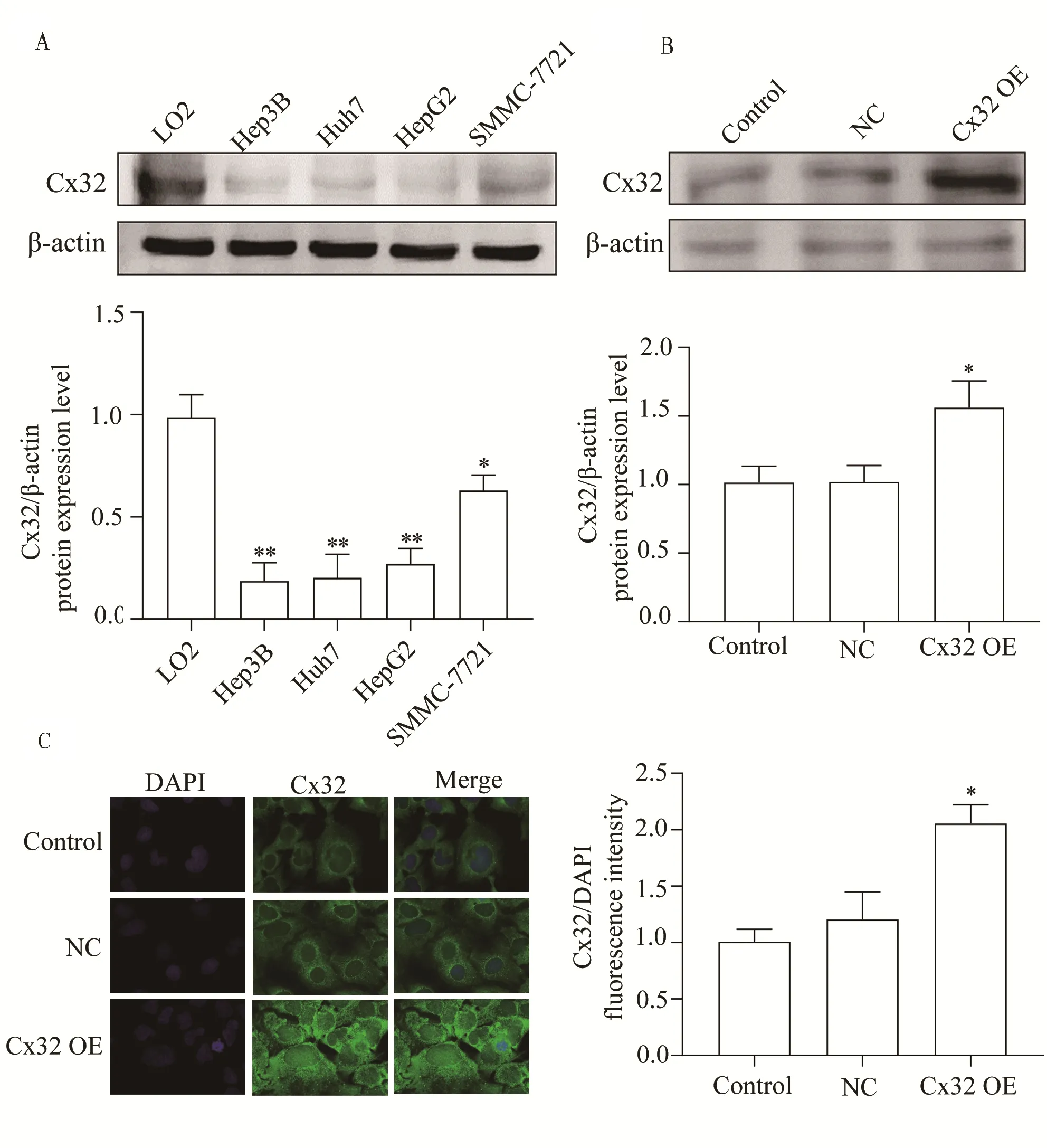
图2 Cx32 在不同HCC 细胞系中的表达和稳定过表达Cx32 的Huh7 细胞系的鉴定Fig 2 Expression of Cx32 in different HCC cell lines and identification of Huh7 cell line of stably over-expressed Cx32
2.3 Cx32 OE 抑制Huh7 细胞增殖、侵袭和迁移
表3 不同组Huh7 细胞中Cx32 的荧光表达强度(n=3,±s)Tab 3 Fluorescence intensity of Cx32 in different groups of Huh7 cells(n=3,±s)

表3 不同组Huh7 细胞中Cx32 的荧光表达强度(n=3,±s)Tab 3 Fluorescence intensity of Cx32 in different groups of Huh7 cells(n=3,±s)
注:与Control 比较,*P<0.05;与NC 组比较,♯P<0.05。
Cx32 1.01±0.11 1.12±0.15 1.71±0.09*♯29.32 0.00组别Control NC Cx32 OE FP
MTT 比 色 实 验 结 果 发 现,与Control 或NC 组相比,Cx32 OE 组的OD490值均显著降低,差异有统计学意义(P<0.01,表4、图3A)。
表4 过表达Cx32 对Huh7 细胞增殖能力的影响(n=3,±s)Tab 4 Effect of Cx32 over-expression on the proliferative ability of Huh7 cells(n=3,±s)

表4 过表达Cx32 对Huh7 细胞增殖能力的影响(n=3,±s)Tab 4 Effect of Cx32 over-expression on the proliferative ability of Huh7 cells(n=3,±s)
注:与Control 比较,*P<0.05;与NC 组比较,♯P<0.05。
Cell viability 1.49±0.06 1.59±0.05 0.43±0.04*♯509.30 0.00组别Control NC Cx32 OE FP
细胞划痕实验结果显示,相对于NC 组而言,Cx32 OE 组24 h 的细胞划痕愈合率显著降低(P<0.01,表5、图3B)。Transwell 实验结果进一步发现,Cx32 OE 组细胞侵袭数无论较Control 组细胞侵袭数还是NC 组细胞侵袭数均少(P<0.05,表6、图3C)。以上结果表明,Cx32 过表达抑制Huh7 细胞的增殖、迁移和侵袭。
表5 过表达Cx32 对Huh7 细胞迁移能力的影响(n=3,±s)Tab 5 Effect of Cx32 over-expression on the migration ability of Huh7 cells(n=3,±s)

表5 过表达Cx32 对Huh7 细胞迁移能力的影响(n=3,±s)Tab 5 Effect of Cx32 over-expression on the migration ability of Huh7 cells(n=3,±s)
注:与NC 组比较,*P<0.05。
Wound closure 58.02±7.01 29.03±4.05*6.17 0.00组别NC Cx32 OE tP
表6 过表达Cx32 对Huh7 细胞侵袭能力的影响(n=3,±s)Tab 6 Effect of Cx32 over-expression on the invasive ability of Huh7 cells(n=3,±s)

表6 过表达Cx32 对Huh7 细胞侵袭能力的影响(n=3,±s)Tab 6 Effect of Cx32 over-expression on the invasive ability of Huh7 cells(n=3,±s)
注:与Control 比较,*P<0.05;与NC 组比较,♯P<0.05。
Number of invasive cells 63.67±3.51 62.00±5.00 43.00±4.00*♯22.24 0.00组别Control NC Cx32 OE FP
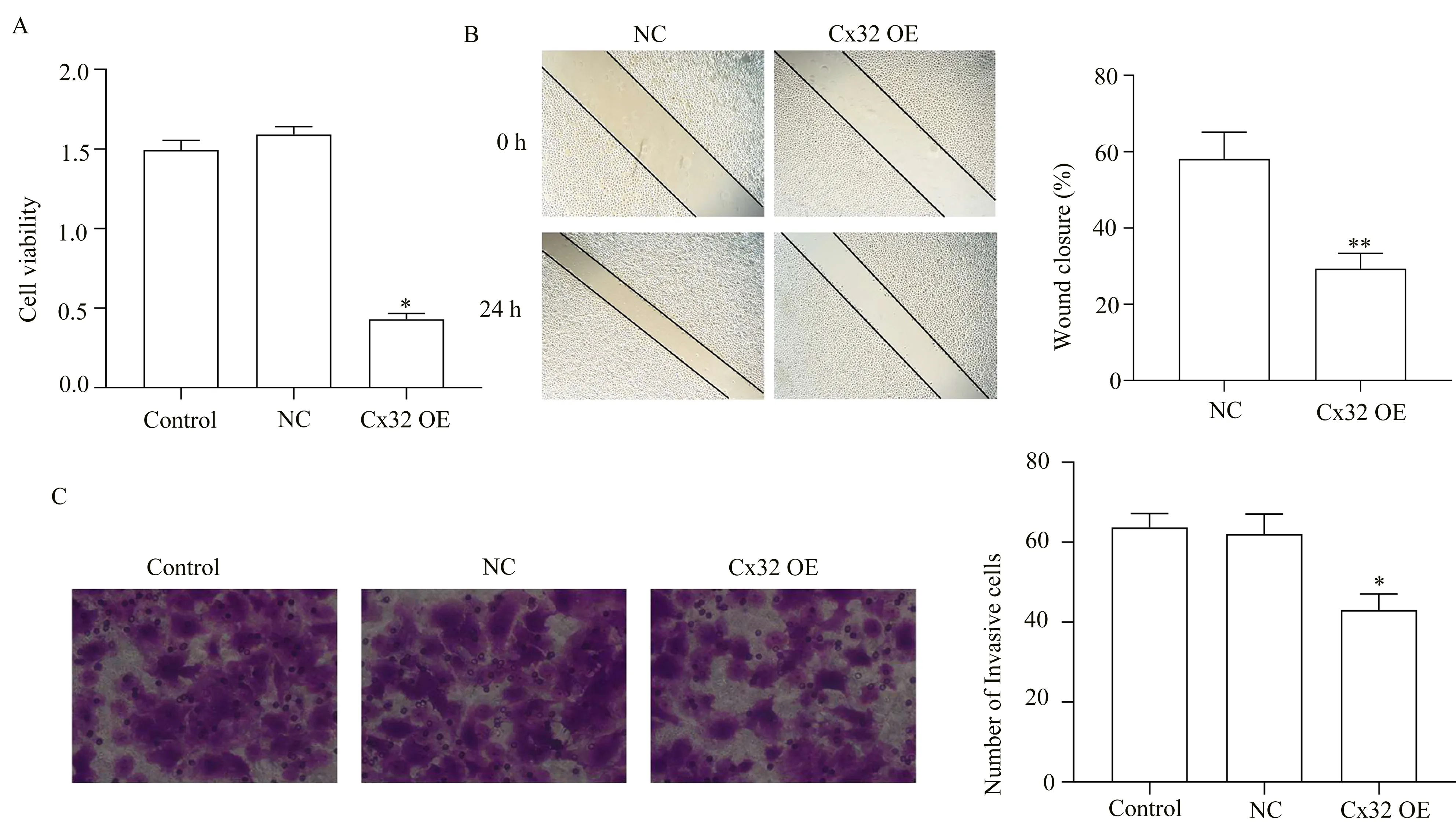
图3 过表达Cx32 对Huh7 细胞增殖、迁移和侵袭能力的影响Fig 3 Effect of Cx32 over-expression on the proliferation, migration and invasion of Huh7 cells
2.4 Cx32 OE 抑制Huh7 细 胞EMT 进 程
由于EMT 是肿瘤细胞迁移、侵袭的重要生物学机制[10,11],进一步研究了过表达Cx32 对Huh7 细胞EMT 进程的影响。Western blot 和IF 实验一致发 现,相 较 于Control 或NC 组,Cx32 OE 组 的 上 皮标志物E-cadherin 蛋白表达上调,而间质标志物Snail 和Vimentin 蛋白表达下调(表7、8、图4A)。这一结果提示,过表达Cx32 可以抑制Huh7 细胞的EMT 进程。
表7 过表达Cx32 对Huh7 细胞中E-cadherin、Vimentin 及Snail 的蛋白表达的影响(n=3,±s)Tab 7 Effect of Cx32 over-expression on protein levels of E-cadherin, Vimentin and Snail in Huh7 cells(n=3,±s)
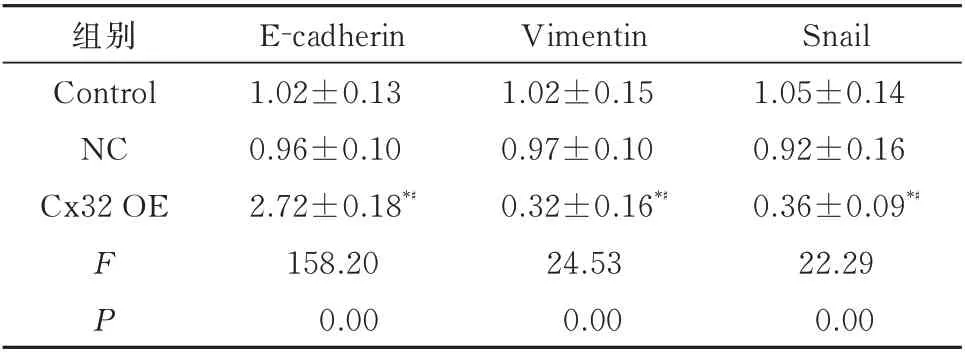
表7 过表达Cx32 对Huh7 细胞中E-cadherin、Vimentin 及Snail 的蛋白表达的影响(n=3,±s)Tab 7 Effect of Cx32 over-expression on protein levels of E-cadherin, Vimentin and Snail in Huh7 cells(n=3,±s)
注:与Control 比较,*P<0.05;与NC 组比较,♯P<0.05。
组别Control NC Cx32 OE Snail 1.05±0.14 0.92±0.16 0.36±0.09*♯22.29 0.00 FP E-cadherin 1.02±0.13 0.96±0.10 2.72±0.18*♯158.20 0.00 Vimentin 1.02±0.15 0.97±0.10 0.32±0.16*♯24.53 0.00

图4 过表达Cx32 对Huh7 细胞EMT 标志物表达的影响Fig 4 Effect of Cx32 over-expression on protein levels of EMT markers in Huh7 cells
表8 过表达Cx32 对Huh7 细胞中E-cadherin、Vimentin 及Snail 荧光表达强度的影响(n=3,±s)Tab 8 Effect of Cx32 over-expression on fluorescence intensity of E-cadherin, Vimentin and Snail in Huh7 cells(n=3,±s)

表8 过表达Cx32 对Huh7 细胞中E-cadherin、Vimentin 及Snail 荧光表达强度的影响(n=3,±s)Tab 8 Effect of Cx32 over-expression on fluorescence intensity of E-cadherin, Vimentin and Snail in Huh7 cells(n=3,±s)
注:与Control 比较,*P<0.05;与NC 组比较,♯P<0.05。
组别Control NC Cx32 OE Snail 1.05±0.12 0.88±0.06 0.39±0.10*♯39.27 0.00 FP E-cadherin 1.01±0.11 1.12±0.15 1.70±0.09*♯29.32 0.00 Vimentin 1.03±0.11 0.93±0.16 0.40±0.08*♯23.22 0.00
3 讨论
Cx32 是肝脏组织GJ 的重要组成部分,维持着由GJ 介导的正常肝细胞间的通讯功能[12]。GJ 是一种广泛存在于邻接细胞间、调控细胞间物质传递和信号转导的一种蛋白质通道,在机体的生长发育和细胞的增殖、分化、凋亡中发挥了关键调节作用。既往报道多显示,肿瘤的发生与GJ 的下调或缺失相关[13,14],且Cx 蛋白被认为是一种肿瘤抑制因子[15],例如Cx37 可以通过降低血管生成来抑制肿瘤生长[16],Cx31 可以抑制甲状腺癌细胞的增殖、迁移和侵袭[17]。包括本课题组在内的研究证实,随着HCC的不断进展,Cx32 的表达量不断下降,并且过表达Cx32 有 助 于 抑 制 或 逆 转HCC 的 恶 性 表 型[5,6]。这些结果支持传统观点,即认为Cx 蛋白通过GJ 维持细胞稳态来发挥肿瘤抑制因子的作用。Cx32 本身作为一种独特的蛋白,其非GJ 依赖性的作用也不能除 外[18]。但 同 时 也 有 研 究 发 现,HCC 中Cx32 的mRNA 和蛋白水平均未发生明显变化,而是出现了胞质的异常定位[19]。当Cx32 蛋白无法精准地定位在Huh7 细胞膜上时,其在HCC 细胞质中的异常蓄积 将 会 促 进Huh7 细 胞 的 侵 袭 和 转 移[6,7,20]。Cx32在不同HCC 细胞系所表现出来的作用及特点的差异提示需要对其进行进一步研究。
本研究首先从生物信息学数据挖掘着手,发现Cx32 mRNA 与蛋白质在HCC 组织中低表达,且其表达水平会随着HCC 患者T 分期、组织学分级及临床分期的进展而降低,此外N 分期与Cx32 mRNA表达水平呈负相关趋势。体外实验结果示,HCC 细胞中该蛋白的表达普遍较正常肝上皮细胞LO2 低,这与生信所得的结果相一致,共同支持在HCC 癌变或进程过程中存在Cx32 下调。接着通过既往构建的工具细胞,设计一系列实验来揭示过表达Cx32在Huh7 这一细胞系中的作用。对于稳定过表达Cx32 的Huh 细胞模型的构建与鉴定已在本课题组既往的文献[8]中进行详细报道。根据这一报道,这些过表达的Cx32 小部分定位于细胞膜,大部分定位于细胞质[8]。本研究中IF 实验也证实了Cx32 的定位,笔者推测部分存在于细胞膜的Cx32 蛋白可能与GJ 形成相关联,但是大部分定位于细胞质更有利于观察Cx32 在细胞质中的蓄积所带来的效应。
根据MTT 实验结果显示,当Cx32 呈过表达时能够有效地降低Huh7 细胞的增殖、迁移和侵袭能力。特异性过表达Cx32 对于Huh7 细胞生物学功能的抑制作用在既往的研究中已有报道[21],但综合Huh7 细胞中关于Cx32 的研究发现,Cx32 的确切角色在不同文献中有所差异。本研究依然支持其传统抑癌因子的作用,至于这种差异我们推测与细胞系的培养条件、传代过程中的细胞特性变化以及时空异质性可能有关。肿瘤细胞在获得侵袭性和发生 转 移 的 过 程 中,EMT 是 其 重 要 机 制 之 一[10,11],EMT 的激活也是HCC 恶性表型获得的重要表现[22]。有文献报道,HCC 细胞的侵袭能力会随着上皮细胞源性标志物E-cadherin 的表达而降低,以及间质细胞源性标志物Snail、Vimentin 表达的增加而增强[23]。本研究中,过表达Cx32 在发挥上述作用的同时,上调E-cadherin 蛋白表达,下调Vimentin 蛋白和Snail 蛋白表达。基于此,笔者推测Huh7 细胞的迁移和侵袭能力降低的可能原因是过表达Cx32抑制了Huh7 细胞的EMT 进程。这与本课题组既往在HepG2 和SMMC-7721 细胞系上的研究结果[5]相吻合。鉴于过表达Cx32 在Huh7 细胞中的定位,GJ 依赖性和非GJ 依赖性的综合作用可能存在于该效应机制中。
综上所述,本研究发现EMT 过程被抑制可能是导致过表达的Cx32 抑制细胞的增殖、迁移和侵袭的机制之一。结合研究团队开展的关于Cx 与HCC 的系列研究,本课题组对Cx32 在不同HCC 细胞系中的作用及特点有了更为全面的研究,为揭示Cx32 在HCC 中的生物学效应提供更多的实验数据。本研究结果进一步支持Cx32 可能成为HCC 的重要靶标,认为上调或增加Cx32 的方法或途径可能在抗HCC 领域有一定的潜力和前景。
作者贡献度说明:
季文斌:主要实验执行、数据分析和论文撰写;吕振宇、程倩倩、周雪丽和王威:协助实验执行、数据整理及分析;杨燕:实验设计指导与论文修改。
所有作者声明不存在利益冲突关系。
