电针心包经穴对MCAO 大鼠急性期D-ser 及NMDAR 的影响
2023-02-14袁柳媚卢小叶娄必丹
袁柳媚,夏 云,卢小叶,刘 蕾,周 颖,娄必丹
(1. 湖南中医药大学,湖南 长沙 410007;2. 湖南中医药大学第一附属医院,湖南 长沙 410007;3. 广东南华工商职业学院,广东广州 510507;4. 长沙卫生职业学院,湖南 长沙 410100)
急性缺血性脑卒中(acute ischemic stroke,AIS)作为我国最常见的卒中类型[1],其发病机制和治疗方法一直是研究的热点。N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)介导的兴奋性毒性是脑卒中研究的热点,而D-丝氨酸(D-Serine,D-Ser)作为NMDAR 的NR1 亚基上“甘氨酸位点”的主要内源性配体,能调控NMDAR的功能[2]。基于心脑共主神明的理论[3],本课题团队前期研究[4-7]证实电针心包经能改善MCAO 大鼠神经功能缺损症状,其治疗机制与调控D-Ser 的合成与释放,调节NR1、NR2A、NR2B 的表达,影响胞内Ca2+含量密切相关。本实验在前期研究的基础上,以加入外源性D-Ser 试剂为切入点,进一步探讨电针心包经在急性期对MCAO 大鼠脑组织D-ser 含量及NMDAR 表达的影响。
1 材料与方法
1.1 实验动物与分组
实验动物为36 只SPF 级健康成年雄性SD 大鼠,购买自湖南斯莱克景达实验动物有限公司,体重250~300 g,3~4 月龄。随机分为以下6 组:分别是正常组、假手术组、模型组、电针心包经组、模型+D-Ser 组、电针心包经+D-Ser 组。严格按照动物伦理学要求善待动物。
1.2 主要试剂与仪器
常规化学试剂(中国上海国药),脱脂奶粉(中国北京普利莱,货号P1622), RIPA 裂解液(中国上海 碧 云 天,货 号P0013B),NR1 (Abyntek,货 号A7677),NR2A(美 国 proteintech,货 号19953-1-AP),NR2B(美国proteintech,货号21920-1-AP),β-actin(美国proteintech,货号66009-1-Ig),HRP goat anti-mouse IgG(美国proteintech,货号SA00001-1),HRP goat anti-rabbit IgG(美 国proteintech,货 号SA00001-2),标 准 品 丝 氨 酸(美 国sigma,货 号S0450000),外 源 性D-Ser 试 剂(MCE 公 司,货 号HY-100808),甲酸(美国sigma,货号F0507),乙腈(美国sigma,货号34851),摇床(中国江苏其林贝尔,货号TS-1),台式冷冻离心机(中国湖南湘仪,货号H1650R),电泳仪(中国北京六一,货号DYY-6C),电泳槽(中国北京六一,货号 DYCZ-24DN),转膜仪(中国北京六一,货号DYCZ-40D),旋涡混合器(中国江苏其林贝尔,货号GL-88B),磁力搅拌器(中国雷磁,货号JB-13),精密PH 计(中国雷磁,货号PHS-3C),电子天平(美国双杰,货号JJ224BC),生物样品均质仪(中国杭州奥盛,货号BioPrep-24),SDZ-Ⅱ华佗电针治疗仪(苏州医疗用品厂有限公司),液质仪器(岛津,货号LC-MS-MS-8050)。
1.3 模型制备
选用大鼠大脑中动脉闭塞模型,制备方法参照Zea Longa 法[8],使用颈总动脉插入线栓法。术后大鼠麻醉清醒予以评分,评分标准参照Zea Longa 的5分制神经行为评分标准:评分1-3 分者纳入实验,其余剔除。假手术组分离出血管后不插线。
1.4 腹腔注射
电 针+D-Ser 组、模 型+D-Ser 组:分 别 在 插 入线栓成功后30 min 按160 mg/kg 腹腔注射外源性D-Ser 试剂1 次。再按被试因素施加方法予以相应的处理。
1.5 电针干预处理
采取捆绑法固定大鼠,参照《实验针灸学》动物穴位图谱,电针心包经组、电针心包经+D-Ser 组在造模成功后24 h 后行电针治疗1 次,选取瘫痪侧心包经的天泉穴、曲泽穴为一组,内关穴、大陵穴为一组,进行电针治疗;选用华佗牌电针治疗仪,疏密波,输出电流为0.5-1 mA,频率为15 Hz,强度以局部组织轻颤为度,治疗30 min。其余各组仅捆绑固定30 min,不干预。
1.6 大鼠的行为学评分
大鼠的行为学评分参照孙敬芳《动物实验方法学》中的标准,在造模成功后6 h 和取材前分别进行2 次评定,最高分为11 分,分数越高,表示大鼠的运动功能障碍越严重,用于评价大鼠脑缺血后运动功能的损伤及恢复情况。
1.7 检测方法及指标
1.7.1 液相色谱串联质谱法检测缺血脑组织中D-Ser 含量 提取样品,配制标准物质溶液,取标准物质母液,加水分别配制浓度为1、2、5、10、20、50、100 ng/mL 的 标 准 物 质 溶 液,过0.22 μm 滤 膜,HPLC-MS/MS 分 析;UPLC 条 件:液 相 色 谱 型 号:LC30;色谱柱:Waters ACQUITY UPLC BEH C18(100 mm*2.1 mm,1.7 μm);流动相:A:0.1%甲酸水溶液,柱温:35℃;B:乙腈,流速:0.3 mL/min,进样体积:1 μL;质谱条件:模式:ESI,正离子模式分析,扫描模式:多反应监测(MRM),干燥气:氮气10.0 L/min,加热气:空气10.0 L/min,碰撞气:氩气270 kPa,雾化气:3.0 L/min,接口温度:200℃,DL 管温度:280℃,驻留时间:150 ms,加热模块温度:300℃,延迟时间:3 ms,接口电压:1.0 KV;进行实际样品检测,采取不同处理组织进行检测组织中丝氨酸的含量,组织中均检出含有不同含量。
1.7.2 Western Blot 蛋白质印迹法检测NR1、NR2A和NR2B 蛋白表达水平 首先提取蛋白,剪取约0.025 g 组织样,经过冰上裂解、离心等处理,取上清加loading buffer 变 性;制SDS-PAGE 胶,待 胶 凝 固后,取marker 2 μL 置于第1 孔,20 μL 已变性蛋白置于剩余孔;开始电泳,电压恒定75 V,时间为130 min;按照分子量分别切胶,准备滤纸、NC 膜放入转膜缓冲液中,按“滤纸-NC 膜-胶-滤纸”的顺序以300 mA 恒 定 电 流 进 行 转 膜;用1*PBST 洗 膜1 次;用1*PBST 配制5% 脱脂奶粉,浸入膜后,室温封闭1.5 h;用1*PBST 将一抗按照一定比例稀释,将膜与一抗一起孵育过夜,次日室温放置30 min,1*PBST洗10 min,重复3 次;用1*PBST 稀释HRP 标记的二抗,将膜与二抗共同孵育1.5 h,1*PBST 洗15 min,重复3 次;最后用ECL 显色曝光,在凝胶成像系统成像。
1.8 统计学处理
所有数据均输入计算机,用SPSS 26.0 统计软件进行处理。计量资料以均数±标准差(±s)表示,当资料同时满足正态分布和方差齐性时,多组组间比较采用方差分析LSD 或SNK 法;满足正态分布,不满足方差齐性时,采用Games-Howell 法;当资料不符合正态分布时,采用非参数检验;当差值正态检验符合时,组内比较采用配对样本t检验;反之则采用配对样本秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠的行为学评分
(1)处理前:与正常组、假手术组比,造模后各组的行为学评分均升高(P<0.05),表明造模成功;与模型组相比,模型+D-Ser 组和电针心包经+DSer 组的行为学评分均升高(P<0.05),表明外源性注入D-Ser 加重了大鼠的行为障碍。(2)处理后:与模型组相比,电针心包经组差异无统计学意义(P>0.05),模型+D-Ser 组和电针 心包经+D-Ser 组的行为学评分仍升高(P<0.05);与模型+D-Ser 组相比,电针心包经+D-Ser 组行为学评分无统计学意义(P>0.05)。(3)组内处理前后比较:除正常组和假手术组外,各组行为学评分均略升高,差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠的行为学评分比较 (分,n=6,±s)Tab 1 Comparison of behavioral scores of rats in each group(scores,n=6,±s)

表1 各组大鼠的行为学评分比较 (分,n=6,±s)Tab 1 Comparison of behavioral scores of rats in each group(scores,n=6,±s)
注:与正常组、假手术组相比,*P<0.05;与模型组相比,#P<0.05。
处理后0.000±0.000 0.000±0.000 7.000±0.632*7.500±1.225*8.333±0.817*#8.667±1.033*#组别正常组假手术组模型组电针心包经组模型+D-Ser 组电针心包经+D-Ser 组处理前0.000±0.000 0.000±0.000 6.667±0.817*6.500±1.049*8.000±1.265*#8.500±0.837*#
2.2 各组大鼠脑组织中D-Ser 含量比较
正常组与假手术组差异无统计学意义(P>0.05);与正常组相比,造模后各组的D-Ser 含量均不同程度增加(P<0.05),模型+D-Ser 组增加最为显著;与模型组相比,模型+D-Ser 组的D-Ser 含量进一步升高(P<0.05),而电针心包经组、电针心包经+D-Ser 组均无统计学意义(P>0.05);与模型+D-Ser 组 相 比,电 针 心 包 经+D-Ser 组 的D-Ser 含量下降(P<0.05)。见表2 及图1。

图1 各组D-Ser 含量Fig 1 D-Ser Content of Each Group
表2 各组大鼠脑组织中D-Ser 含量比较(±s)Tab 2 Comparison of D-Ser content in brain tissue of rats in each group (±s)

表2 各组大鼠脑组织中D-Ser 含量比较(±s)Tab 2 Comparison of D-Ser content in brain tissue of rats in each group (±s)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与模型+D-ser 组相比,^P<0.05。
D-Ser 246.365±72.304 252.030±22.940 496.540±11.553*428.733±55.838*645.430±61.863*#539.454±30.896*^组别正常组假手术组模型组电针心包经组模型+D-Ser 组电针心包经+D-Ser 组n 6 6 6 6 6 6
2.3 各组大鼠NR1 的蛋白表达比较
正常组与假手术组的NR1 蛋白表达差异无统计学意义(P>0.05);与正常组相,造模后各组大鼠的NR1 的蛋白表达均增强(P<0.05),模型+D-Ser组最为显著;与模型组相比,电针心包经NR1 的蛋白表达明显降低(P<0.05),模型+D-Ser 组的NR1蛋白表达相对升高(P<0.05),电针心包经+D-Ser组则无统计学意义(P>0.05);与模型+D-Ser 组相比,电针心包经+D-Ser 组的NR1 蛋白表达下降(P<0.05)。见表3 及图2。
表3 各组大鼠NR1 蛋白表达比较(±s)Tab 3 Comparison of NR1 protein expression of rats in each group (±s)

表3 各组大鼠NR1 蛋白表达比较(±s)Tab 3 Comparison of NR1 protein expression of rats in each group (±s)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与模型+D-ser 组相比,^P<0.05。
NR1 0.173±0.008 0.185±0.030 0.520±0.017*0.272±0.012*#0.612±0.018*#0.502±0.035*^组别正常组假手术组模型组电针心包经组模型+D-Ser 组电针心包经+D-Ser 组n 6 6 6 6 6 6

图2 各组大鼠的NR1 蛋白表达Fig 2 NR1 protein expression of rats in each group
2.4 各组大鼠NR2A、NR2B 的蛋白表达比较
正常组与假手术组的NR2A、NR2B 蛋白表达差异无统计学意义(P>0.05);与正常组相比,造模后各组的NR2A、NR2B 蛋白表达均增强(P<0.05);与模型组相比,电针心包经组和电针心包经+D-Ser 组的NR2A、NR2B 蛋白表达均下降(P<0.05),且电针心包经组的降低幅度大于电针心包经+D-Ser 组;模型+D-Ser 组的NR2A、NR2B 蛋白表达较模型组进一步增强(P<0.05);电针心包经+D-Ser 组的NR2A、NR2B 蛋白表达较模型+DSer 组减弱(P<0.05)。见表4 及图3。

图3 各组大鼠的NR2A、NR2B 蛋白表达Fig 3 NR2A and NR2B protein expression of rats in each group
表4 各组大鼠NR2A、NR2B 蛋白表达比较 (±s)Tab 4 Comparison of NR2A and NR2B protein expression of rats in each group(±s)
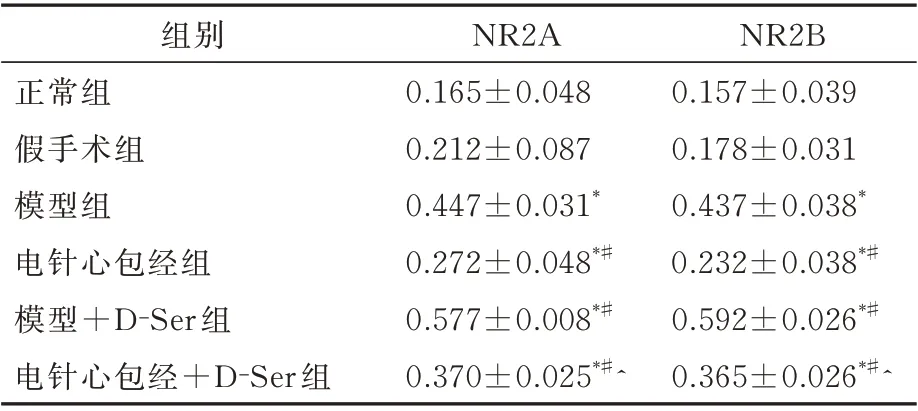
表4 各组大鼠NR2A、NR2B 蛋白表达比较 (±s)Tab 4 Comparison of NR2A and NR2B protein expression of rats in each group(±s)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与模型+D-ser 组相比,^P<0.05。
NR2B 0.157±0.039 0.178±0.031 0.437±0.038*0.232±0.038*#0.592±0.026*#0.365±0.026*#^组别正常组假手术组模型组电针心包经组模型+D-Ser 组电针心包经+D-Ser 组NR2A 0.165±0.048 0.212±0.087 0.447±0.031*0.272±0.048*#0.577±0.008*#0.370±0.025*#^
3 讨论
缺血性中风发病初期主要是由于风、火、痰、瘀上阻脑络,闭阻神窍[9]。中医认为心主血脉,且为藏神之脏,在五脏六腑中的地位十分重要,被视作“君主之官”;脑由脑髓汇聚而成,故被称为髓之海,又是神明之所出,故称为“神明之府”,心脑共同主宰和统帅着人的生命活动和精神活动。两者在生理上和病理上均密切相关,互相影响。心主血脉、藏神的生理机能正常,心气充沛才能推动血液运行至脑腑,使脑髓得以充养。可见“神明藏于脑,发于心”,心脑相通共主神明,现代一些疾病也可反映两者的病理联系,例如“脑心综合征”。心包经为心主,能协助完成心主血脉、主神明之功,同时能“代心受邪”。心包经主脉所生病者,脉通血气,虽其未直接与脑相关,但是针刺心包经却能通过调理心气,促进气血的运行,使得气血上供于脑,濡养脑窍,从而治疗中风等脑部相关疾病。故心包经、心、脑部三者关系密切,已有临床研究[10]证实电针心包经穴对于脑梗死患者具有确切疗效。
NMDAR 是中枢神经系统重要的兴奋性神经递质,其兴奋与激活是脑缺血损伤机制中的重要靶点,当NMDAR 过度激活时,胞内Ca2+水平升高,致使兴奋性毒性和神经损伤,因此NMDAR 的活化状态对脑缺血后神经元损伤的进程具有重要影响[11]。NMDAR 是谷氨酸重要的离子型受体,但部分离子型谷氨酸受体(iGluRs)的激活并不完全依赖于谷氨酸,在GluN1/GluN2 NMDAR 上,甘氨酸或D-Ser与谷氨酸协同作用,作为强制性的共激动剂,调节NMDAR 的活性水平[12]。D-Ser 作为重要的神经胶质细胞递质,通过兴奋NMDA 受体实现调节突触传递、神经元兴奋性等。国外研究发现,D-丝氨酸给药3 h 后,D-Ser 的细胞内外浓度出现明显升高,提示外源性D-Ser 能对脑组织内D-Ser 产生影响,进而影 响NMDAR 的 活 性[13],但 目 前 国 内 相 关 研 究较少。
NMDA 受体主要由NR1、NR2(NR2A-2D) 、NR3 (NR3A、NR3B)3 个主要亚基组成,其中NR1亚基是基本功能亚单位,NR2A 和NR2B 与谷氨酸的亲和力普遍强于NR2C 和NR2D,是重要的调节亚 单 位[14]。既 往 研 究[11][14]表 明NR1 表 达 增 加NMDA 诱导的兴奋性毒性;分布于突触外的NR2B,通过引起持续缓慢的Ca2+内流,致使Ca2+超载,发挥神经损害作用;而分布于突触内的NR2A则与之相反,发挥神经保护作用。NMDAR 不同亚基的表达与脑缺血病程所处时期密切相关,本研究中NR2A、NR2B 在1 d 的 表 达 与 既 往 研 究[15]中MCAO 大鼠NR2A 和NR2B 蛋白和基因表达于急性缺血期显著增强相一致,致使胞内Ca2+超载,神经细胞死亡。
本次实验结果显示,造模后大鼠出现神经功能缺损症状,缺血脑组织中D-Ser 含量以及NR1、NR2A、NR2B 的蛋白表达均增加,二者呈正相关。在电针治疗1 d 后,各组大鼠的行为学评分并未见改善,一方面是由于急性缺血性卒中为一个动态的病理过程,急性期脑组织正处于缺血性脑水肿期,因此大鼠的行为学障碍仍在加重。另一方面,由于电针时间过短刺激量不够,而评分反而略高可能与急性期大鼠比较虚弱,捆绑、抓握等刺激因素亦可加重大鼠的整体行为障碍有关。本团队在前期多个时相点的研究中发现[6]电针心包经组的行为学评分自第3 天后才开始逐渐下降,表明电针具有累积效应。同时本实验发现急性期加入外源性D-Ser后,大鼠脑组织内的D-Ser 水平可因外源性D-Ser 的补充而增多,进一步增强NMDAR 活性,加重神经损害。而电针心包经组和电针心包经+D-Ser 组的D-Ser 含量呈下降趋势,并且NR1、NR2A、NR2B 的蛋白表达明显降低,再次证实电针心包经可减少DSer 含量,降低NR1、NR2A、NR2B 的蛋白表达水平。另外,对比同时段D-Ser、NMDAR 的表达水平发现,与模型组相比,1 d 时电针心包经组的NR1、NR2A、NR2B 蛋白表达即可明显降低(P<0.05),先于D-Ser 的下调反应(P>0.05)。考虑D-Ser 的合成释放涉及多个环节,与SR 密切相关,D-Ser 是体内的L-Ser 经过SR 消旋转化而来的,国外有研究发现[16]在SR 靶向缺失的小鼠的大脑皮层培养中,DSer 水平降低约85%,神经毒性明显减弱。同时导师团队的前期研究表明[5]电针心包经在可下调SR蛋白的表达,抑制D-Ser 的合成和释放。Wang 等[17]实验研究发现在局灶性脑缺血后的前4 d 内,SR 的表达无明显变化,缺血后第6~10 天缺血皮质中SR的基因和蛋白水平均出现延迟性降低,同一时期,同侧皮层的D-Ser 浓度也有所下降,表明颞顶叶皮层SR 表达和D-Ser 水平在局灶性脑缺血晚期出现延迟下降。结合前期研究[7]显示电针心包经组的D-Ser 含量于3 d 后始呈现稳定的下降趋势,而NR1、NR2A、NR2B 蛋白表达在1-3 d 明显下降,表明电针心包经的作用对D-Ser 的下调可能存在一定延迟性,由此推测NR1、NR2A、NR2B 对于电针的调节应答可能更为敏感。
综上,体外注射外源性D-Ser 在急性期可加重兴奋性毒性,电针心包经穴可减少急性期MCAO 大鼠脑组织中D-Ser 含量,降低NR1、NR2A、NR2B 的蛋白表达水平,抑制NMDAR 活性,发挥促MCAO大鼠神经修复的作用,并且NR1、NR2A、NR2B 的表达下降趋势较D-Ser 更明显。
作者贡献度说明:
袁柳媚、娄必丹:全程参与、指导实验操作并撰写论文;夏云、卢小叶:饲养动物,取材,参与论文撰写;刘蕾、周颖:参与动物造模和实验操作。
所有作者声明不存在利益冲突关系。
