METTL14 上调miR-141 的m6A 修饰抑制ZEB1 促进肺成纤维细胞增殖与炎症
2023-02-14杨益秀李全妮丁毅鹏
杨益秀,陈 洁,李全妮,林 梅,丁毅鹏
(1. 海南医学院附属海南医院,海南 海口 570311;2. 海南省人民医院全科医学科,海南 海口 570311)
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)是世界范围内一个主要且仍在增长的死亡原因,特点是气道疾病和肺气肿的组合[1,2]。COPD 发 展 的 潜 在 特 征 之 一 是 异 常 的 组 织修复和重塑,导致细胞外基质稳态紊乱[3]。肺成纤维细胞的功能障碍是可能是这种异常组织修复和重塑的关键[4]。
miRNAs 是一种长度为19~25 个核苷酸的内源性非编码RNA,负调控基因蛋白表达[5]。本课题组前期发现,miR-141 在COPD 中高表达,通过靶向抑制ZEB1 促进肺成纤维细胞增殖,抑制凋亡[6]。但其高表达的上游调控机制,尚未完全清晰。目前,已经 报 道 了100 多 种RNA 修 饰[7],其 中N6 甲 基 腺 苷(m6A)修饰是真核信使RNA(mRNAs)中最常见的内部修饰[8]。在哺乳动物中,甲基转移酶样3/4(METTL3/4)和Wilm 肿瘤相关蛋白(WTAP)负责催化m6A 修饰的形成[9]。研究证实,METTL14 能够通过调控miRNAs 上m6A 修饰位点参与肿瘤进展[10,11],但METTL14 在 成 纤 维 细 胞 调 控 的 功 能 与机制,未见相关报道。经数据库预测,我们发现pri-miR-141 具有m6A 修饰位点。因此,本研究拟探讨METTL14 通过调控pri-miR-141 的m6A 修饰稳定miR-141 的表达,从而参与调控COPD 的进展,为探究COPD 的发病机制提供新思路。
1 材料与方法
1.1 实验试剂与仪器
DMEM 培 养 基(11965092)、胎 牛 血 清FBS(30044333)、胰 酶(25200-072)、青 霉 素/链 霉 素(15070063)购于Gibco;逆转录试剂盒(P312)和实时荧光定量PCR(Q331)购于南京诺唯赞生物;RNA Immunoprecipitation 试剂盒(RIP-12RXN)购于Sigma-Aldrich;流式细胞术凋亡检测试剂盒(A23202)购于ThermoFisher;人白介素2(IL-2),白介素6(IL-6)和人肿瘤坏死因子α(TNF-α)的ELISA 试剂盒购于上海仁捷生物;CCK8 试剂购于MedChemExpriss 公司;Trizol 试剂(15596026)购于广 州 济 恒 医 药;METTL14(ab300104)、ZEB1(ab203829) , m6A (ab151230) 和 GAPDH(ab181602)一 抗 购 于Abcam;HRP-羊 抗 兔IgG(BA1054)购于博士德生物;pcDNA3.1-METTL14过表达质粒和阴性对照(NC)购于上海汉恒生物。肺成纤维细胞MRC-5 购自上海生命科学院研究院细胞库。
1.2 实验方法
1.2.1 成纤维细胞培养和转染 成纤维细胞MRC-5 使用含10%胎牛血清,100 mg/L 青霉素和链霉素的DMEM 完全培养基培养,置于37.5 ℃、含5% CO2的细胞培养箱。待MRC-5 处于对数生长期时,使用胰酶消化MRC-5 细胞,制成细胞悬液,并接种于6 孔板中进行后续实验。使用METTL14 过表达质粒和空载质粒转染MRC-5 细胞,培养24 h 后进行后续实验。
1.2.2 qPCR 检测 转染后的MRC-5 细胞使用Trizol 试剂提取综RNA,用NanoDrop 2000(美国赛默飞)评估提取RNA 的浓度和纯度。使用逆转录试剂盒将RNA 逆转录成cDNA,在ABI 7500QPCR仪上进行qPCR 反应,反应条件为:95 ℃预变性5 min,95 ℃变性5 s,62 ℃复性20 s,72 ℃延伸30 s,40个循环。以GAPDH 基因为内参,采用2-ΔΔct 法计算METTL14 和ZEB1 的表达量。METTL14上游引 物:AGAAACTTGCAGGGCTTCCT,METTL14 下 游 引 物 : TCTTCTTCATATGGCAAATTTTCT;ZEB1 上 游 引 物:ACCCTTGAAAGTGATCCAGC;ZEB1 下 游 引 物 :CATTCCATTTTCTGTCTTCCGC;GAPDH 上游 引 物 :ATGGTTTACATGTTCCAATATGATT;下游引物:AATCATATTGGAACATGTAAACCAT;pri-miR-141 上 游 引 物:CGGCCGGCCCUGGGUCCAUCUUCCA;miR-141 上 游 引物:GCGAAGCATTTGCCAAGAA;miRNA 通用下游引物:CAATCACAGACCTGTTATTGC;U6上游引物:CTCGCTTCGGCAGCACA,下游引物:AACGCTTCACGAATTTGCGT。引物由广州安尔诺生物科技有限公司合成。
1.2.3 Western blot 检 测MRC-5 中METTL14 和ZEB1 表达水平 使用添加蛋白酶和磷酸酶抑制剂的RIPA 裂解液提取MRC-5 细胞中总蛋白,使用BCA 法测定蛋白样品浓度和纯度,接着进行上样、电泳及转PVDF 膜操作,分别加入稀释后的METTL14,ZEB1、GAPDH 一抗置于4 ℃孵育过夜,第二天TBST 洗涤PVDF 膜后加羊抗兔IgG 二抗,在37 ℃条件下孵育1 h,ECL 显色,暗室曝光、拍照并将图片进行灰度分析。
1.2.4 CCK8 检测MRC-5 细胞增殖情况 取对数生长期的METTL14 过表达和阴性对照组的MRC-5 细胞,以1 000 个/孔密度接种于96 孔板中培养。在共培养的第1、2、3、4、5 天,分别每孔加入10 μL 体积的CCK8 溶液置于培养箱孵育2 h,置于多功能酶标仪中检测OD450 处的波长。
1.2.5 流式细胞术检测MRC-5 细胞的凋亡情况使用不含有EDTA 的胰酶消化待测细胞,2 000 rpm室温离心5 min,弃上清。PBS 重悬细胞,转移至1.5 mL EP 管,再次离心弃上清。细胞计数每组取2×106细胞使用200 μL 缓冲液重悬。所有实验组与 阴 性 对 照 双 染,加 入5 μL Annexin V 和5 μL 7-AAD 染料。阳性对照设置两个染料单染管,加入5 μL Annexin V 或5 μL7-AAD 染 料,避 光 孵 育15 min。染色结束加入1 mL PBS,离心弃上清,加入100 μL PBS 重悬,过200 目滤网后上机检测。
1.2.6 ELISA 试剂盒检测 提前30 min 取出试剂盒平衡至室温。收集待测细胞上清,标准品加入100 μL 的 标 准 品;空 白 对 照 孔 加 入100 μL 的 蒸 馏水;其余微孔中加入100 μL 的细胞上清液,按照ELISA 试剂盒说明书进行操作,在450 nm 波长读取各孔的OD 值。
1.2.7 meRIP-qPCR 检 测 提 取METTL14 过 表 达和对照组MRC-5 细胞的总RNA,使用NEB Next Poly(A) mRNA 磁性分离试剂盒(New England Biolabs, UK)进行多聚(A) + RNA 的纯化和片段化。用NanoDrop 2000 评估提取RNA 的浓度和纯度。Dynabeads Protein A 与兔抗m6A 抗体混合在4 ℃孵育2 h,然后取mRNA 片段与混合物再孵育2 h,沉淀m6A 富集到的RNA,使用qPCR 检测沉淀中pri-miR-141 的表达量。
1.2.8 RNA 免 疫 沉 淀(RIP)检 测METTL14 与pri-miR-141 结合 在METTL14 过表达和对照组的MRC-5 细胞中进行RIP 实验,按照RNA Immunoprecipitation 试剂盒说明书进行操作。4 μg lgG,METTL14 抗体和细胞裂解液在4 ℃下旋转孵育过夜,然后旋在每个反应中加入20 μL 洗涤过的磁珠,并在4 ℃孵育2 h。洗涤6 次后,使用qPCR 检测免疫沉淀中pri-miR-141 的表达量。
1.3 统计学处理
2 结果
2.1 成功构建METTL14 过表达细胞
使用METTL14 过表达慢病毒转染成纤维细胞MRC-5 后,采用qPCR 检测METTL14 的表达情况。结果显示:转染组(4.12±0.19)的METTL14在mRNA 水 平 都 高 于 对 照 组(1.10±0.07)(t=25.62,P<0.001),见图1A。使用Western blot 检测METTL14 的蛋白表达,结果显示:转染组(0.80±0.03)的METTL14 在蛋白水平显著高于对照组(0.34±0.02)(t=20.66,P<0.001),见图1B、C。
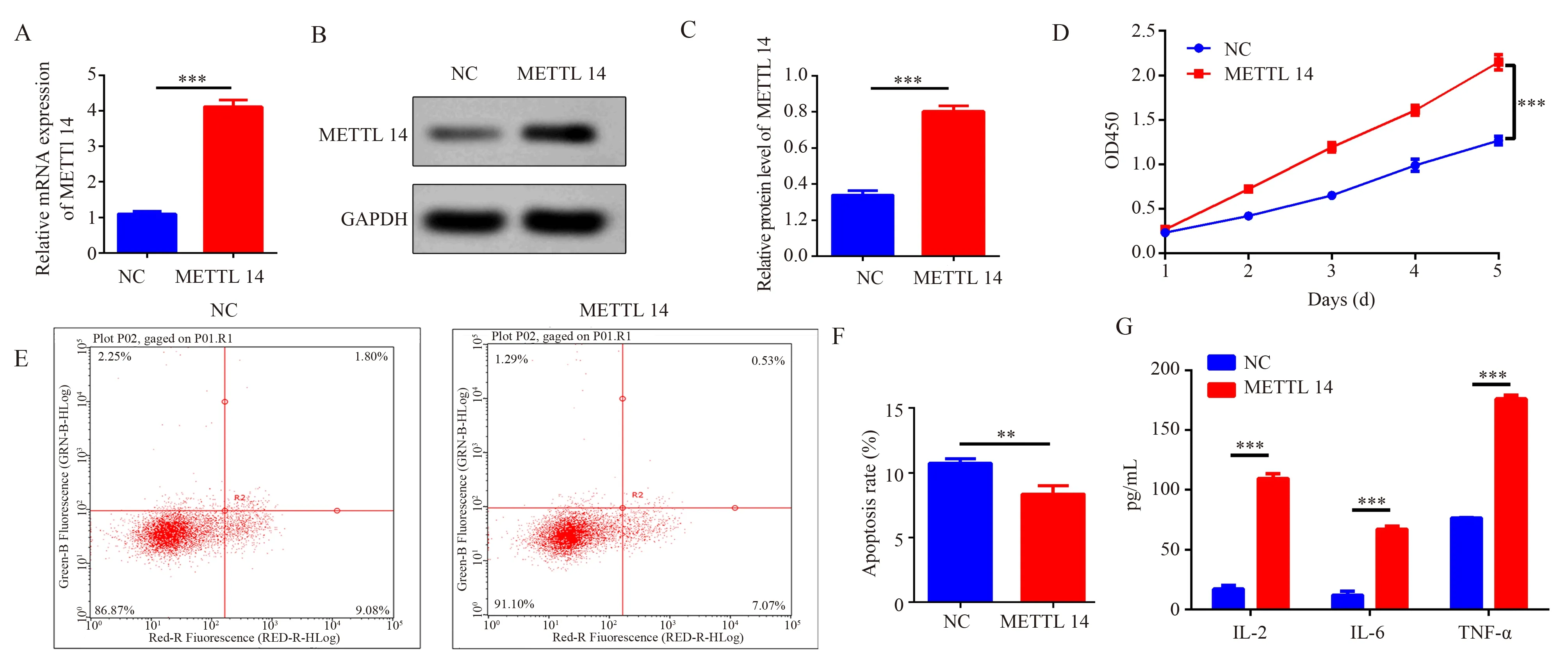
图1 METTL14 促进肺成纤维细胞增殖与炎症因子释放Fig 1 Lung fibroblast proliferation and inflammatory cytokine release promoted by METTL14
2.2 METTL14 促进成纤维细胞增殖并抑制其凋亡
CCK8 检测结果显示,同对照组相比,高表达METTL14 基因组第5 天的MRC-5 细胞的细胞活力OD450值(2.15±0.08)高于对照组(1.26±0.05)(t=20.00,P<0.001),见图1D。流式细胞术检测显示,高表达METTL14 基因组(8.35%±0.64%)的MRC-5 细胞凋亡率相对对照组凋亡率(10.75%±0.34%)下降(t=5.69,P<0.001),见图1E、F。这提示METTL14 促进成纤维细胞的增殖行为。
2.3 METTL14 促进成纤维细胞的炎症因子释放
ELISA 检测结果显示,同对照组相比,高表达METTL14 的MRC-5 细胞上清中促炎因子IL-2(109.51±4.22)pg/mL、IL-6(67.01±2.57)pg/mL和TNF-α(176.19±3.01)pg/mL 的含量都高于对照组 中的IL-2[(17.03±2.84)pg/mL,(t=31.51,P<0.001)]、IL-6[(11.86±3.17)pg/mL,(t=23.38,P<0.001)]和 TNF-α[(76.37±0.55) pg/mL,(t=56.41,P<0.001)]的含量,见图1G。这提示METTL14 高表达促进成纤维细胞释放炎症因子。
2.4 METTL14 增 加pri-miR-141 的m6A 修 饰
使用数据库预测发现miR-141 的前体pri-miR-141 具有m6A 结合位点。为确认miR-141上m6A 位点的修饰情况,采用meRIP 检测pri-miR-141 的m6A 甲基化修饰情况。结果显示:与IgG 组 相 比(1.03±0.09), m6A 组 中pri-miR-141 mRNA 的富集相对表达(13.55±1.16)增加,提示pri-miR-141 具 有m6A 修 饰 位 点(t=18.64,P<0.001),见图2A。IP 进一步检测发现,相对阴性载体富集IgG 对照组(1.12±0.13),METTL14 抗体组中富集的pri-miR-141 相对表达(5.43±0.30)提高(t=22.91,P<0.001),见图2B,提示pri-miR-141 能够直接结合METTL14。采用qPCR 检测发现,相对阴性对照组(1.12±0.15),METTL14 高表达组中miR-141 相对表达(3.44±0.20)提高(t=16.05,P<0.001),见 图2C。以 上 结 果 提 示,METTL14 与m6A 均与miR-141 前体结合,可能通过METTL14促进pri-miR-141 上的m6A 修饰,促进miR-141表达。
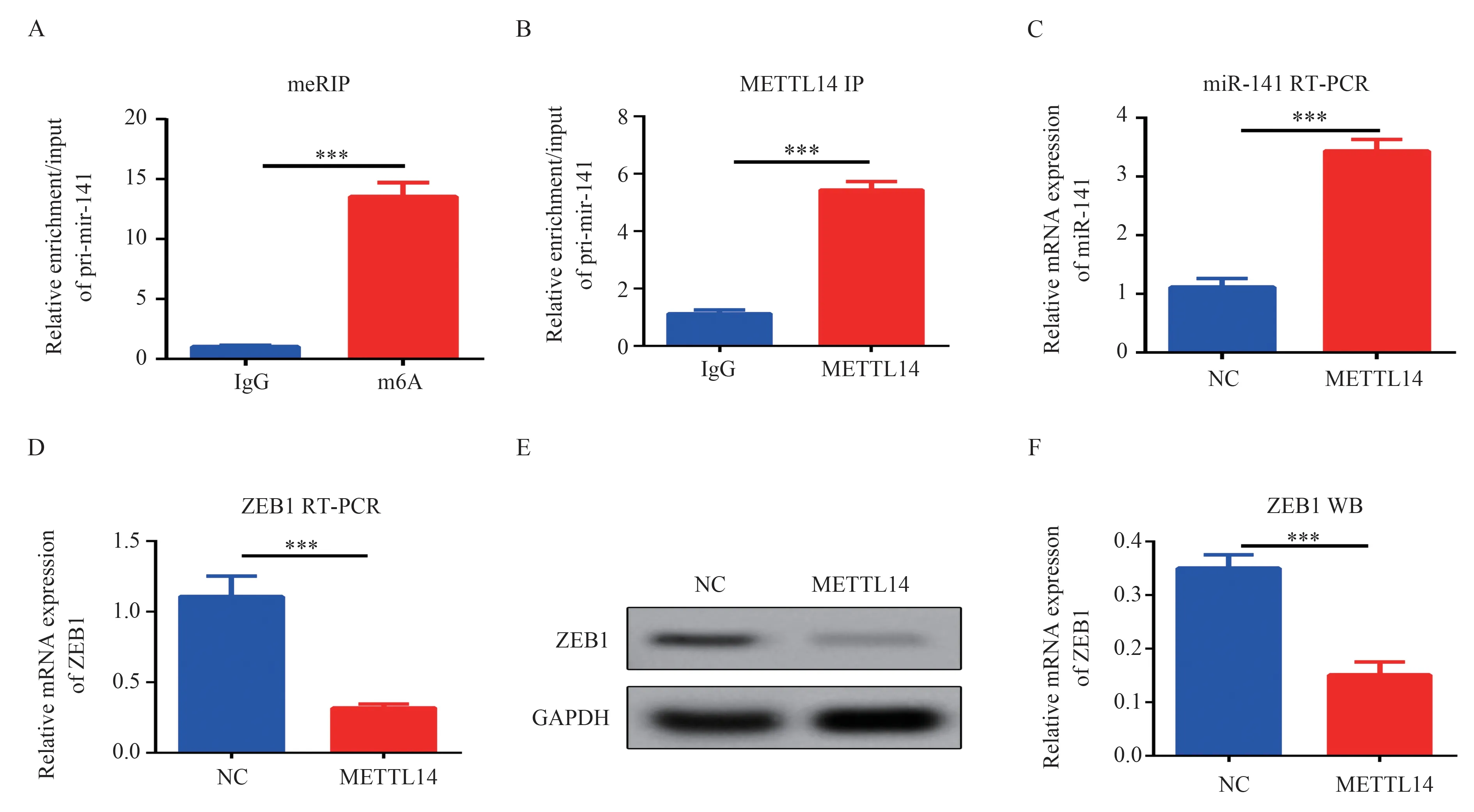
图2 METTL14 通过增加miR-141 的m6A 修饰抑制ZEB1 表达Fig 2 METTL14 inhibited ZEB1 exprission by increasing the m6A modification of miR-141
2.5 METTL14 抑 制ZEB1 表 达
本课题组前期研究发现,miR-141 靶向抑制ZEB1 促进肺成纤维细胞的增殖,并抑制其凋亡[6]。为了探明METTL14 是否通过影响ZEB1 调控成纤维细胞的生物学行为,我们采用qPCR 和western blot 检测ZEB1 的表达量。结果显示,相对阴性载体对照组(1.11±0.14),METTL14 过表达组中ZEB1 mRNA 相 对 表 达(0.31±0.03)下 调(t=9.33,P<0.001),见图2D;采用western blot 检测ZEB1 蛋白表达,结果显示,相对阴性载体对照组(0.35±0.02),METTL14 过表达组中ZEB1 蛋白相对表达(0.15±0.02)下 调(t=9.90,P<0.001),见 图2E、2F。以上结果提示,METTL14 通过增加miR-141的m6A 修饰抑制ZEB1 表达。
3 讨论
COPD 是一种具有气流阻塞特征的慢性支气管炎,可进一步发展为肺心病和呼吸衰竭的常见慢性疾病[12]。由于人口老龄化加剧和高吸烟率,COPD 的致残率和病死率很高,全球40 岁以上发病率已高达9%~10%,给个人和社会都带来了沉重的经济负担[13]。目前的治疗方法并不能够完全阻止COPD 患者的病程进展,进一步探究COPD 发展的分子机制对于理解COPD 的病理过程和寻找可能的干预治疗靶点具有重要的意义。
肺成纤维细胞是通过产生细胞外基质蛋白、基质金属蛋白酶和基质金属蛋白酶组织抑制剂来控制细胞外基质稳态的主要细胞,是COPD 潜在特征的异常组织修复和重塑的关键[14]。近年来,随着对COPD 的持续研究,发现成纤维细胞和相关细胞因子参与COPD 的炎症发病机制[15]。因此,研究成纤维细胞分泌相关细胞因子参与COPD 炎症发病机制可为其提供治疗思路。
microRNAs(miRNAs)是一种内源性小的非编码RNA(19~25 个核苷酸),负调控基因蛋白表达[5]。最近研究表明,非编码RNA 尤其是miRNA,与COPD 发生发展相关,可能作为COPD 诊断、治疗、预后等生物标记物[16-18]。大量的研究表明,miR-141 在多种肿瘤起始和进展中起到重要的调控作用。miR-141-3p 调节通过调控不同的靶基因促进胃癌、鼻咽癌。结直肠癌等肿瘤的增殖和迁移[19-21]。高表达的miR-141-5p 抑制BTG1 促进宫颈癌进展[22]。低表达的miR-141 靶向激活STAT4 促进肝癌细胞增殖和转移[23],且miR-141 被证实能够作为胆囊癌诊断、预后和治疗靶点的潜在生物标志物[24]。本课题组前期研究表明,miR-141 在COPD中高表达,通过靶向抑制ZEB1 促进肺成纤维细胞增殖,并抑制其凋亡[6]。但miR-141 高表达的上游调控机制,尚不清楚。
m6A 修饰主要在组织发育中发挥其生物学功能,调控干细胞分化,胚胎发育,DNA 损伤、昼夜节律周期、精子发生等[25]。m6A 修饰几乎涉及RNA代谢的所有方面,基于甲基转移酶和去甲基酶的定位,m6A 可以在细胞核或细胞质中被引入或去除。稳定pri-miRNA,促进其剪切是m6A 的经典功能之一[26]。最近的研究发现m6A 修饰在恶性肿瘤进展中 起 着 关 键 的 作 用[27,28]。作 为 一 种 关 键 的m6A 甲基转移酶,METTL14 已被报道通过调控不同的靶基因在肝细胞癌,膀胱癌和胰腺癌的肿瘤起始和进展 中 扮 演 重 要 的 角 色[29-31]。然 而,METTL14 在COPD 中的作用及相关机制尚未见报道。在本研究中,我们发现高表达METTL14 促进成纤维细胞的增殖,并抑制其凋亡,促进炎症因子IL-2,IL-6 和TNF-α 的表达。这提示我们METTL14 可能通过调控成纤维细胞活性和相关细胞因子参与COPD进展。
此外,METTL14 已被报道参与调控pri-miRNA 的m6A 位 点 修 饰。METTL14 通 过 增加pri-miR-19a 的m6A 甲基化修饰位点以促进心血管内皮细胞增殖和侵袭[11],通过调节m6A 修饰和miR-146a-5p 促 进 乳 腺 癌 细 胞 的 迁 移 和 侵 袭[10],通过增加pri-miR-126 的m6A 修饰位点抑制肝细胞癌的转移潜能[30]。数据库预测,我们发现miR-141 的前体pri-miR-141 存在m6A 修饰位点。因此,我们推测METTL14 可能通过调控pri-miR-141 上的m6A 修饰位点参与COPD 进展。本研究中,我们通过meRIP 实验证实pri-miR-141 上确实存在m6A 修饰位点,通过IP 和qPCR 实验证明METTL14 能靶向结合pri-miR-141 并增加miR-141 的表达量。这表明METTL14 可能通过增加pri-miR-141 的m6A修饰位点稳定miR-141 的表达,从而参与调控成纤维细胞的增殖和炎症因子的分泌。
转录因子ZEB1 属于锌指同源家族成员,通过锌指结构与下游靶基因启动子区的E-box 序列结合发挥作用[32]。ZEB1 被证实在多种肿瘤中异常表达来促进肿瘤细胞迁移、侵袭和转移,并且和癌症预后不良或存活率低密切相关[33]。我们前期研究表明,miR-141 通过靶向抑制ZEB1 促进肺成纤维细胞增殖,抑制凋亡[6]。本研究中我们发现,METTL14高表达能够显著抑制ZEB1 在mRNA 和蛋白水平的表达,这表明METTL14 通过调控miR-141/ZEB1 轴参与调控肿瘤进展。
本 文 数 据 显 示 METTL14 通 过 增 加pri-miR-141 的m6A 修饰位点稳定miR-141 的表达,进而抑制ZEB1 从而参与促进成纤维细胞的增殖和炎症因子的分泌,这可能是COPD 进展关键机制。METTL14 调节成纤维细胞增殖和炎症因子分泌机制的阐明有助于理解COPD 的病理过程和寻找可能的干预治疗靶点。
作者贡献度说明:
杨益秀:实验设计与写稿;陈洁:载体构建与验证;李全妮:细胞培养、转染与检测;林梅:数据分析与制图;丁毅鹏:实验指导与修稿。
所有作者声明不存在利益冲突关系。
