乔松素对缺氧/复氧诱导大鼠心肌细胞焦亡的预防作用及其机制
2023-02-14张威卢小伟许浩
张威,卢小伟,许浩
湖北医药学院附属国药东风总医院心血管内科,湖北十堰 442008
心血管疾病是全球病死率最高的疾病,占世界总死亡率的1/3,急性心肌梗死(AMI)是其中较为严重的一种心血管系统疾病[1]。临床治疗AMI的常用方法为再灌注,以此来改善心肌缺血的症状[2]。但心肌缺血改善后,可能会出现心肌缺血再灌注损伤(MIRI),表现为心肌组织损伤或心功能异常。MIRI的发作机制主要与氧化应激、炎症、钙超载、细胞因子释放与中性粒细胞浸润等密切相关[3]。细胞焦亡是一种新型的细胞程序性死亡形式,但其对炎症具有促进作用,并与NLRP3的激活相关。研究[4]表明,细胞焦亡与MIRI有一定关系。乔松素(PIN)是从某些植物、蜂胶或蜂蜜中提取出来的黄酮类化合物,药理学研究显示PIN 具有抗炎、抗氧化、抗肿瘤、抗菌和神经保护等作用。研究[5]发现,PIN能够使大鼠主动脉平滑肌细胞引起的血管收缩能力减弱,发挥舒张血管的作用。也有证据显示PIN 能改善缺血性心力衰竭大鼠的心律失常[6]。但是PIN 能否抑制缺氧/复氧(H/R)诱导的心肌细胞焦亡,目前还未明确。PI3K/AKT/NF-κB 是涉及炎症的一种常见信号通路,LIU等[7]发现,葵洁元汤通过影响TLR4依赖性PI3K/AKT/NF-κB 氧化和炎症信号及肠道微生物改善溃疡性结肠炎的肠屏障损伤,但是该通路在H/R诱导的心肌细胞焦亡中的机制还尚不明确。2022年7月—2022年9月,本研究通过观察预先加入PIN的大鼠心肌细胞H9c2 H/R 处理后的细胞活力、细胞焦亡情况、LDH 水平、细胞焦亡相关蛋白相对表达量变化,以探讨PIN 对H/R 诱导的大鼠心肌细胞焦亡的预防作用及其机制。
1 材料与方法
1.1 细胞、主要试剂及仪器 大鼠心肌细胞H9c2由中国科学院上海细胞库提供。大鼠心肌细胞H9c2 培养在含10%胎牛血清的DMEM 高糖培养基中,在温度37 ℃、5% CO2的细胞培养箱中培养,每2~3 天更换一次培养基。待细胞生长至80%左右进行传代,传代3 次后的对数生长期细胞用于实验。乔松素(>99%)购自于武汉科斯坦生物科技有限公司;高糖DMEM 培养基、胎牛血清、胰蛋白酶购自Gibco 公司(美国);青霉素-链霉素混合液、CCK-8 试剂盒购自北京索莱宝生物科技有限公司;乳酸脱氢酶(LDH)试剂盒购自上海碧云天生物技术有限公司;PI、Hoechst 33342、BCA 蛋白定量试剂盒、PI3K、AKT、NF-κB、p-PI3K、p-AKT、p-NF-κB p65、Caspase-1、ASC、NLRP3 一抗及其相应二抗购自Sigma 公司(美国);PI3K 激活剂740-Y-P 购自Selleck 公司。仪器:全自动酶标仪(F.A.M.E.16/20 型)购自瑞士哈美顿公司;全自动化学发光凝胶成像系统购自美国Bio-Rad 公司;荧光显微镜购自德国Leica 公司;荧光定量PCR仪购自北京安诺伦生物科技有限公司。
1.2 H9c2 细胞分组、PIN 的加入、H/R 处理、将H9c2 细胞随机分为PIN-H + 740-Y-P 组(25 μmol/L PIN + 50 μg/mL 740-Y-P[8])、PIN-H 组(25 μmol/L PIN[9])、PIN-L 组(12.5 μmol/L PIN)、模型组、对照组。对照组细胞的培养条件如1.1所述。其余各组细胞加入相应浓度的药物共同孵育1 h,之后进行H/R处理。根据参考文献[10],首先对细胞培养基进行处理。取无糖无血清的DMEM 培养基,将其置于37 ℃的低氧培养箱中,混合通入流速为2 L/min的95%N2和5%CO2气体3 h。之后将H9c2细胞原有的培养基迅速换成上述处理好的DMEM 培养基,并放在低氧培养箱中继续培养12 h。之后重新将培养基置换为含10%胎牛血清的高糖DMEM 培养基,在温度37 ℃、CO2体积分数5%的细胞培养箱中继续培养4 h。
1.3 H9c2 细胞的活力检测 采用CCK-8 法。将1.2 所述的各组细胞继续培养24 h、48 h、72 h 后每孔中加入10 μL CCK-8 试剂,继续培养2 h 后,在酶标仪450 nm下测定每孔的吸光度(OD450值)。
1.4 各组焦亡心肌细胞的比例测算 采用PI 染色法。将1.2 所述的各组细胞的培养基弃去,加入细胞染色缓冲液0.1 mL,加入Hoechst 染色液和PI 染色液各5 μL,轻轻晃匀,在4 ℃环境下避光孵育0.5 h。孵育结束后用PBS 洗涤,在荧光显微镜下观察细胞染色结果。Hoechst 染色结果阳性细胞呈蓝色,PI 染色阳性细胞呈红色。PI 阳性表示细胞出现焦亡。结果用PI阳性细胞比例表示。
1.5 各组H9c2 细胞中LDH 检测 采用ELISA 法。将1.2 所述的各组细胞继续培养24 h 后,离心后取上清液。按照LDH试剂盒的说明书操作,测定H9c2细胞中的LDH。
1.6 各组H9c2 细胞中PI3K/AKT/NF-κB 信号通路和细胞焦亡相关蛋白检测 采用Western blotting 法检测。取1.2 所述的各组细胞,加入RIPA 裂解液提取细胞总蛋白,BCA 法测定蛋白浓度。配制分离胶和浓缩胶,上样后电泳、转膜、脱脂奶粉封闭。加入PI3K、AKT、NF-κB p65、p-PI3K、p-AKT、p-NF-κB p65、Caspase-1、NLRP3、ASC、β-actin 一抗孵育过夜(4 ℃)。次日加入相应二抗室温下孵育1 h,进行显色、拍照和蛋白条带灰度值的测定。
1.7 各组H9c2 细胞中PI3K、AKT 和NF-κB mRNA检测 采用荧光定量PCR 法。取1.2所述的各组细胞,加入TRIzol 试剂提取细胞RNA,通过紫外分光光度法对RNA 进行定量测定。将RNA 逆转录为cDNA 后进行PCR 扩增。PCR 扩增条件为:94 ℃预变性5 min→94 ℃变性30 s→60 ℃退火30 s→72 ℃延伸30 s,共30 次循环。引物序列设计如下:PI3K上游引物:5′CATCACTTCCTCCTGCTCTAT3′,下游引物:5′CAGTTGGTTGGCAATCTTCTTC3′;AKT 上游引物:5′AAACCTGGCGGCCACGCTAC3′,下游引物:5′TTGGCCAGGGCCACCTCCAT3′;NF-κB 上游引物:5′CAAGATCTGCCGAGTAAACC3′,下游引物:5′TCGGAACACAATGGCCACTT3′;β-actin 上游引物:5′GGAGATTACTGCCCTGGCTCCTA3′,下游引物:5′ACTCATCGTACTCCTGCTTGCTG3′。以β-actin 为内参,使用2-ΔΔCt方法计算PI3K、AKT 和NF-κB mRNA的相对表达量。
1.8 统计学方法 采用GraphPad 7.0 软件。正态分布检验采用Shapiro-Wilk 法,符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,进一步两组间比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组H9c2 细胞活力比较 与对照组相比,模型组细胞OD450值(48 h、72 h)降低(P均<0.05);与模型组相比,PIN-H 组细胞OD450值(48 h、72 h)升高(P均<0.05);与PIN-L组相比,PIN-H组细胞OD450值(48 h、72 h)升高(P均<0.05);与PIN-H 组相比,PIN-H + 740-Y-P 组细胞OD450值(48 h、72 h)降低(P均<0.05),详见表1。
表1 各组大鼠H9c2细胞活力比较(±s)
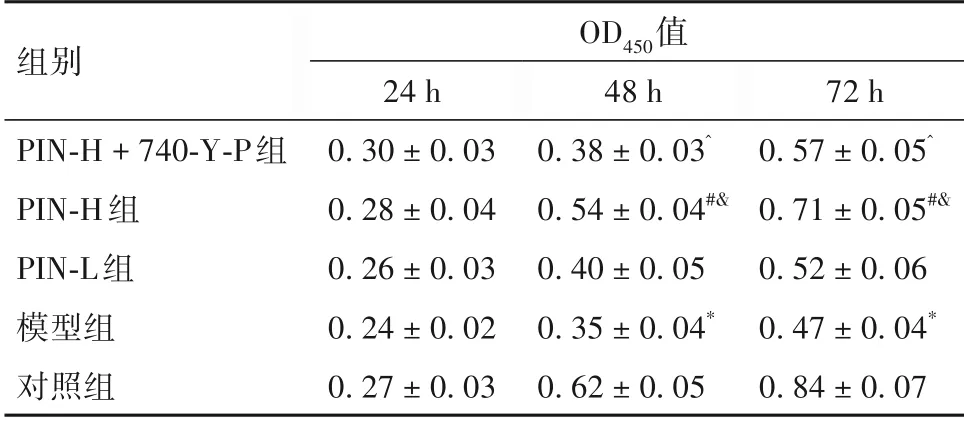
表1 各组大鼠H9c2细胞活力比较(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与PIN-L组比较,^P<0.05;与PIN-H组组比较,&P<0.05。
组别OD450值72 h 0.57 ± 0.05^0.71 ± 0.05#&0.52 ± 0.06 0.47 ± 0.04*0.84 ± 0.07 PIN-H + 740-Y-P组PIN-H组PIN-L组模型组对照组24 h 0.30 ± 0.03 0.28 ± 0.04 0.26 ± 0.03 0.24 ± 0.02 0.27 ± 0.03 48 h 0.38 ± 0.03^0.54 ± 0.04#&0.40 ± 0.05 0.35 ± 0.04*0.62 ± 0.05
2.2 各组PI 阳性心肌细胞比例、LDH 水平、细胞焦亡相关蛋白相对表达量比较 与对照组相比,模型组PI 阳性心肌细胞比例,LDH 水平,Caspase-1、ASC和NLRP3蛋白相对表达量升高(P均<0.05);与模型组相比,PIN-H 组PI 阳性心肌细胞比例,LDH 水平,Caspase-1、ASC 和NLRP3 蛋白相对表达量降低(P均<0.05);与PIN-L 组相比,PIN-H 组PI 阳性心肌细胞比例,LDH 水平,Caspase-1、ASC 和NLRP3 蛋白相对表达量降低(P均<0.05);与PIN-H 组相比,PIN-H+ 740-Y-P 组PI 阳性心肌细胞比例,LDH 水平,Caspase-1、ASC 和NLRP3 蛋白相对表达量升高(P均<0.05),详见表2。
表2 各组PI阳性心肌细胞比例、LDH水平及细胞焦亡相关蛋白相对表达量比较(±s)
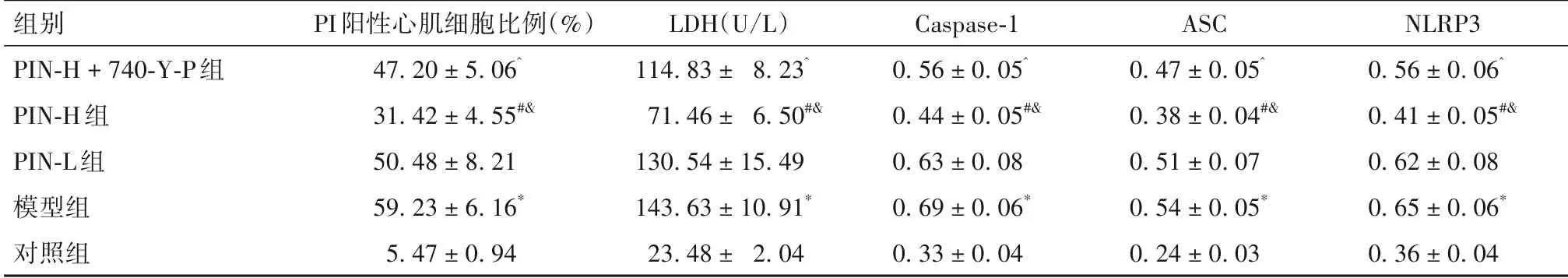
表2 各组PI阳性心肌细胞比例、LDH水平及细胞焦亡相关蛋白相对表达量比较(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与PIN-L组比较,^P<0.05;与PIN-H组组比较,&P<0.05。
组别PIN-H + 740-Y-P组PIN-H组PIN-L组模型组对照组NLRP3 0.56 ± 0.06^0.41 ± 0.05#&0.62 ± 0.08 0.65 ± 0.06*0.36 ± 0.04 PI阳性心肌细胞比例(%)47.20 ± 5.06^31.42 ± 4.55#&50.48 ± 8.21 59.23 ± 6.16*5.47 ± 0.94 LDH(U/L)114.83 ± 8.23^71.46 ± 6.50#&130.54 ± 15.49 143.63 ± 10.91*23.48 ± 2.04 Caspase-1 0.56 ± 0.05^0.44 ± 0.05#&0.63 ± 0.08 0.69 ± 0.06*0.33 ± 0.04 ASC 0.47 ± 0.05^0.38 ± 0.04#&0.51 ± 0.07 0.54 ± 0.05*0.24 ± 0.03
2.3 各组细胞中PI3K/AKT/NF-κB 信号通路相关蛋白及PI3K、AKT 和NF-κB mRNA 表达的比较 与对照组相比,模型组细胞中PI3K、AKT 和NFκB mRNA 相对表达量及PI3K、AKT 和NF-κB p65 蛋白磷酸化水平升高(P均<0.05);与模型组比较,PIN-H 组细胞中PI3K、AKT 和NF-κB mRNA 相对表达量及PI3K、AKT 和NF-κB p65 蛋白磷酸化水平降低(P<0.05);与PIN-L 组相比,PIN-H 组细胞中PI3K、AKT 和NF-κB mRNA 相对表达量及PI3K、AKT 和NF-κB p65 蛋白磷酸化水平降低(P<0.05);与PIN-H 组相比,PIN-H + 740-Y-P 组细胞中PI3K、AKT 和NF-κB mRNA 相对表达量及PI3K、AKT 和NF-κB p65 蛋白磷酸化水平升高(P均<0.05),详见表3。
表3 各组细胞中PI3K、AKT和NF-κB mRNA相对表达量及PI3K、AKT和NF-κB p65蛋白磷酸化水平比较(±s)

表3 各组细胞中PI3K、AKT和NF-κB mRNA相对表达量及PI3K、AKT和NF-κB p65蛋白磷酸化水平比较(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与PIN-L组比较,^P<0.05;与PIN-H组比较,&P<0.05。
组别PIN-H + 740-Y-P组PIN-H组PIN-L组模型组对照组p-NF-κB p65/NFκB p65 0.64 ± 0.07^0.51 ± 0.05#&0.72 ± 0.09 0.76 ± 0.08*0.40 ± 0.05 PI3K mRNA 1.69 ± 0.02^1.32 ± 0.01#&1.83 ± 0.04 1.86 ± 0.02*1.00 ± 0.00 AKT mRNA 1.66 ± 0.03^1.46 ± 0.02#&1.74 ± 0.05 1.78 ± 0.02*1.00 ± 0.00 NF-κB mRNA 1.52 ± 0.02^1.37 ± 0.03#&1.61 ± 0.05 1.65 ± 0.04*1.00 ± 0.00 p-PI3K/PI3K 0.70 ± 0.07^0.54 ± 0.05#&0.78 ± 0.08 0.81 ± 0.06*0.44 ± 0.05 p-Akt/Akt 0.77 ± 0.08^0.59 ± 0.06#&0.81 ± 0.10 0.85 ± 0.09*0.56 ± 0.06
3 讨论
MIRI 是心血管疾病中常见的组织损伤,它是缺血的心肌组织灌注血液后出现心率失常、心肌能量代谢障碍、甚至出现梗死面积扩大等不良现象[11]。目前针对MIRI 并无特效药,其严重影响了AMI 的治疗效果,为临床治疗带来阻碍和困难。H9c2 细胞能完整复制成年大鼠的心肌细胞形态学和电生理学等生理学特征,且H9c2 的H/R 损伤能与人体心肌细胞MIRI 的病理学特征与机制契合。如今使用H9c2 细胞构建大鼠心肌细胞H/R 模型已被广泛熟知与应用[12-13]。有证据表明当H/R 发生时,心肌细胞膜通透性增加,心肌中LDH 大量释放入血,使血清中LDH 水平升高[14]。本研究结果显示,模型组H9c2 细胞活力下降;细胞焦亡比例、LDH 水平升高,说明大鼠心肌细胞H/R 模型建立成功。
细胞焦亡是一种促炎性、程序性的细胞死亡方式。细菌、病毒、毒素或化疗药物等作为细胞损伤的诱因,通过Caspase-1 蛋白介导细胞焦亡的发生。当细胞焦亡发生时,细胞质膜破裂,内容物流出,促炎因子释放[15-16]。细胞焦亡在神经系统疾病、感染性疾病、自身免疫性疾病、心血管疾病如心肌MIRI 和肿瘤的发生发展中起着重要的作用[17-18]。研究[19]发现,MIRI 发生时细胞焦亡引起的炎症损伤会使病情加重,抑制细胞焦亡可以有效减轻MIRI 的心肌损伤。BIAN 等[20]研究发现,与对照组相比,模型组小鼠心肌梗死面积和LDH水平增加,焦亡相关蛋白GSDMD-NT 和Caspase-1水平增加。本研究结果显示,与对照组相比,模型组心肌细胞焦亡比例,血清LDH 水平,细胞焦亡相关蛋白Caspase-1、ASC 和NLRP3 的表达升高,与文献报道相一致。说明心肌细胞的H/R 模型造模成功。
PIN 存在于多种植物、蜂胶中,这种黄酮类单体化合物对很多疾病均有治疗作用。TAO 等[21]研究发现,PIN 能保护缺血/再灌注引起的脑损伤,机制可能与细胞自噬有关。艾世鹏等[22]研究发现,PIN能够保护肠缺血/再灌注的肠黏膜损伤,这种作用可能与其抗炎、抗氧化和抑制p38 MAPK 信号通路活性有关。于飞等[23]研究发现,PIN 能减轻内质网应激引起的人脐静脉内皮细胞的凋亡,其机制可能与抑制ATF6/PERKCHOP 信号通路有关。这些结果都提示PIN可能通过发挥其抗炎作用来减轻H/R心肌细胞的损伤。本研究结果显示,与模型组相比,PIN-H 组细胞活力(48 h、72 h)提高,心肌细胞焦亡比例,LDH 水平,焦亡相关蛋白Caspase-1、ASC 和NLRP3 表达降低,说明PIN 能预防H/R 诱导的心肌细胞焦亡。
PI3K/AKT/NF-κB 信号通路是调节细胞生长、凋亡和血管生成的重要信号通路之一,它能减轻炎症和损伤[24]。越来越多研究者发现,PI3K/AKT/NF-κB 信号通路在调节H/R 中发挥重要作用。LUAN 等[25]发现,黄芩苷能通过调节PI3K/AKT,抑制NF-κB 信号传导来减轻心肌H/R 损伤,减轻炎症和抑制凋亡。DONG 等[26]研究发现,囊性纤维化跨膜电导调节剂的过表达能保护人克隆结肠腺癌细胞免受H/R 诱导的细胞凋亡,可能是通过调节PI3K/AKT/NF-κB 信号通路实现的。本研究结果显示,与对照组相比,模型组心肌细胞PI3K、Akt 和NFκB mRNA 相对表达量,PI3K、Akt、NF-κB p65蛋白的磷酸化水平上升;与模型组相比,PIN-H 组心肌细胞PI3K、Akt 和NF-κB mRNA 相对表达量,PI3K、Akt、NF-κB p65 蛋白的磷酸化水平下降。这些结果说明PIN 可能通过抑制PI3K/AKT/NF-κB 信号通路,抑制H/R 诱导的心肌细胞焦亡。为了验证此猜想,我们用PI3K 激活剂740-Y-P 来干预高浓度的PIN 组,结果发现740-Y-P 减弱了PIN 对心肌细胞焦亡的抑制作用。
综上所述,PIN可能通过下调PI3K/AKT/NF-κB信号通路,预防H/R 诱导的心肌细胞焦亡。该研究为MIRI 临床治疗方法及其机制提供了新的思路。但本研究是在细胞水平上进行的研究,为探索其在体内作用的影响与机制,还需进一步设计相关动物试验及临床试验。
