老年慢性心力衰竭患者合并心房颤动后心脏结构变化及相关因素分析
2023-02-14秦越
秦 越
黑龙江省佳木斯市中心医院全科医学科 (黑龙江 佳木斯 154002)
慢性心力衰竭(chronic heart failure,CHF)以中老年人多见,由于心肌收缩力下降及心肌细胞凋亡等多种病理改变,患者心脏结构和功能亦随之改变,起初多表现为代偿性心肌扩张与肥大,后期则出现失代偿期,影响心脏的收缩和舒张功能[1],因此研究CHF患者的心脏结构变化有助于医师及时了解并判断CHF的发生和发展情况。CHF患者的心律失常以心房颤动(atrial fibrillation,AF)最为常见,作为CHF最常见的心律失常,AF在诱发和加重CHF方面扮演重要角色,二者互为因果[1],患者的血流动力学会发生明显改变,致使患者心功能更低,预后更差。目前有关CHF合并AF患者的心脏结构改变受到关注,研究重点各有不同。本研究从心脏结构及相关因素两个角度进行回顾性分析,为后期有关CHF合并AF患者评估的循证医学提供有效信息。
1 资料与方法
1.1病例
本研究采用回顾性研究方法。收集2018年6月至2021年6月黑龙江省佳木斯中心医院诊治的符合病例纳入和排除标准的268例老年CHF患者的临床资料,其中男118例,女150例;平均60~75岁,平均(67.59±1.21)岁。
纳入标准:符合中华医学会中有关CHF诊断标准[2];年龄≥60岁;纽约心脏病协会(New York heart association,NYHA)心功能分级Ⅱ~Ⅳ级;资料齐全。排除标准:合并自身免疫系统疾病、严重血液系统疾病、恶性肿瘤者;有急性冠脉综合征、心源性休克、心包填塞、脑血管疾病及甲状腺功能亢进等重大疾病;有明确精神疾病者;近半年存在手术史或外伤史。按照是否合并AF分为合并AF组(90例)和非AF组(178例)。所有入组患者均签署相关知情同意书,且该研究获得本院伦理委员会批准同意。
1.2 方法
收集患者年龄、性别、NYHA心功能分级、合并症(高血压、糖尿病、高脂血症)、吸烟史、饮酒史、入院时心率、住院时间、体质量指数(BMI)、血浆脑钠肽(BNP)水平及心脏结构相关指标等临床资料。血浆BNP水平检测方法:取空腹静脉血5mL,3500r/min离心5min,采用酶联免疫法测定血浆BNP水平。心脏结构相关指标检测方法:患者平躺休息半小时后采用M型超声(美国GE公司生产)检测患者左心室射血分数(LVEF)、左心室舒张末内径(LVEDD)、左心房内径(LAD)、舒张期末室间隔厚度(IVST)和舒张期后壁厚度(PWT)。
1.3 统计学处理
数据分析采用SPSS 20.0软件进行。计数资料用例数和百分数(%)表示,采用χ2检验;计量资料用()表示,两组间的数据均符合正态性及方差齐性后行t检验;多因素分析采用Logistic多元逐步回归分析;P<0.05为差异有统计学。
2 结 果
2.1 两组患者基础及临床资料比较
合并AF组患者的年龄高于非AF组,NYHA心功能分级中Ⅳ级比例、静息心室率及血浆BNP水平均高于非AF组(P<0.05);两组的性别、合并高血压、糖尿病、高脂血症、吸烟史,饮酒史比例,以及BMI、住院时间比较差异无统计学意义(P>0.05),见表1。
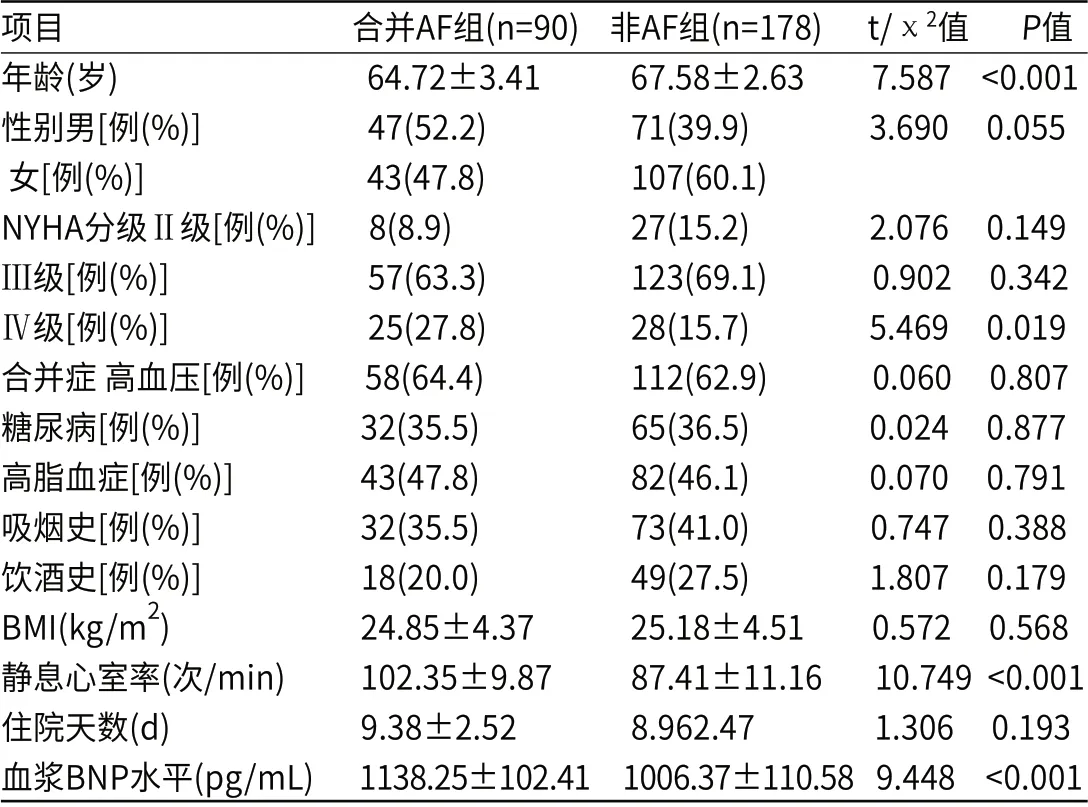
表1 两组基础及临床资料比较
2.2 两组心脏结构相关指标的比较
合并AF组LVEF比非AF组低(P<0.05);合并AF组LVEDD、LAD比非AF组高(P<0.05);两组IVST和PWT比较差异无统计学意义(P>0.05),见表2。
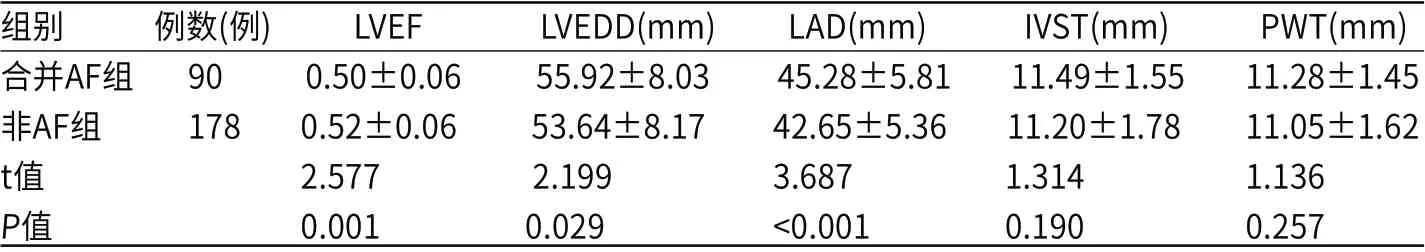
表2 两组心脏结构相关指标的比较
2.3 CHF合并AF的相关因素多因素分析
多元逐步回归分析显示,血浆BNP水平、LAD、LVEDD、NYHAⅣ级、静息心室率均为CHF合并AF的高危因素,LVEF是保护因素(P<0.05),见表3。
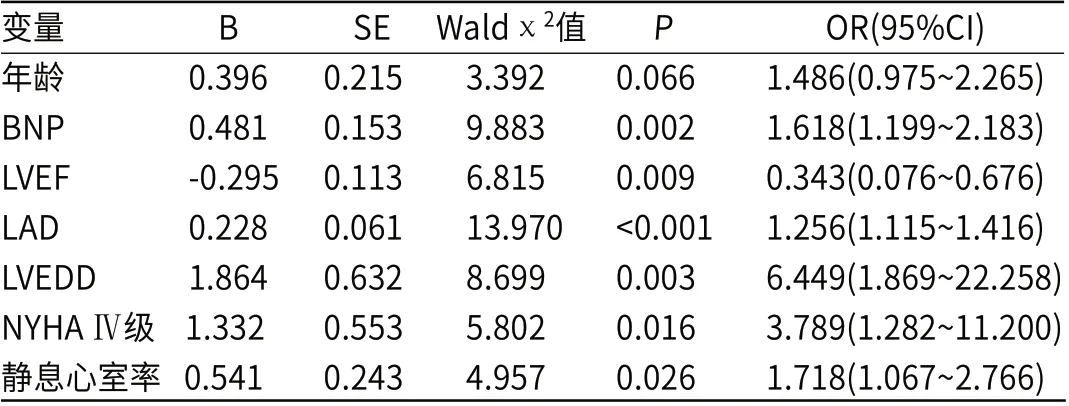
表3 CHF合并AF多因素分析
3 讨 论
CHF患者常合并AF,二者互相促进,共同推动病情发展。老年人心脏窦房结结节状纤维逐级缺失,心肌逐渐出现脂肪组织及纤维化,增加心肌僵硬度,降低其延展性,致使左房增大,AF风险增加[3-5],且CHF合并AF患者通常为高龄、心功能较差,且患者的静息心室率和血浆BNP水升高,心脏结构相关指标LVEF、LVEDD、LAD均异常。但作为AF的独立影响因素中,本研究初步认为血浆BNP水平、LAD、LVEDD、NYHAⅣ级均为CHF合并AF的高危因素,LVEF是保护因素。
随着年龄增加,身体功能亦发生老化,如合并基础疾病增多、心脏功能减弱等,均增加了合并AF的风险,但并不是独立的一个影响因素,有关年龄与心血管疾病的关系,仍值得进行深入的探讨。因大部分房颤患者的心室率因心房节律发生完全或不完全紊乱容易出现心房颤动波,影响了心脏供血,加之患者本为CHF,表现出的心室率更高于单纯CHF患者,因此表1可出现合并AF组的静息心室率高于非AF组。因过快的心室率可能减少左心室充盈量导致心功能不全诱发AF,另一方面,在崔亦锴[6]的研究中认为,针对CHF患者,如能降低心室率并保持在一定范围内,能缓解心室重构,避免后期合并CHF,可认为心室率不仅能反应CHF的一种严重程度,同样也是患者合并AF的危险因素。BNP通常是心力衰竭的一种重要标志物,能够持续兴奋神经系统,当机体出现心室体积增大、心室负荷压力增大时会释放大量BNP,BNP又参与抑制肾素的病理机制,加重CHF,不仅增加心肌重塑风险,同时还可导致AF。同时,CHF合并AF患者因心室收缩力下降,心脏血流动力学出现变化,促使BNP分泌速度加快,同时AF能够引起心房出现不规则收缩,导致心肌细胞能量尚未被完全利用,心室充盈力降低,进而使心室功能降低,加重病情,是故BNP不仅是CHF病情的评估指标之一,同样可作为患者合并AF的危险因素之一[7]。此外,在表1的数据中,CHF患者合并AF后的心室率高于非AF组患者,而心室率增快后心房收缩功能降低,心室充盈时长减少,充盈压降低,左心房泵入左心室血流下降,从而导致心脏射血量降低,即LVEF下降,与表2中的AF组患者LVEF下降及LAD、LVEDD结果对应,CHF合并AF患者的心脏结构相关指标上存在较大差异。在后续的多元逐步回归分析显示,LAD、LVEDD、LVEF参与患者合并AF的过程,是其发生的影响因素。既往大量研究证实,AF的发生与左房内径存在一定关联。Frankstarling机制显示,心脏处于长期衰竭状态时其舒缩功能异常,增加心室前负荷,增高左心室压力与容积,导致左心房压力升高,加大左心房失代偿性,增加心房肌折返环及纤维化,加速AF发生并维持,因此心脏结构相关指标与CHF合并AF关系密切。另有研究者全进伟等[8]认为,CHF与AF共病的一种重要病理生理机制为心房重构,主要为心房电重构及结构重构。Zhu等[9]研究显示,AF复发的预测因子为LAD,LAD每增加5 mm,AF发生的相对危险度增加1.74。本研究中,LAD每增加1mm,AF发生的风险值增加1.256,可间接证实本次研究的可靠性。当然,也有研究显示,CHF合并AF者心脏LVEF与LVEDD与单纯CHF患者比较并无统计学意义(P>0.05),尽管存在绝对数值上的差异[10]。出现此结论,考虑本研究中NYHA心功能分级Ⅳ级的人数较多有关,且入组年龄均为高龄,电生理特征及神经内分泌等影响导致其心脏结构改变的较为明显。因此在后续的研究中,还需尽可能纳入不同年龄层次的患者,充分了解心功能不同的CHF患者合并AF情况。
综上所述,老年慢性心衰患者合并心房颤动的诱因包括血浆BNP水平、静息心室率、LVEF、LAD等,而LVEF则是保护因素,如CHF患者出现心脏结构改变,临床医师需引起高度关注,避免患者合并AF。
