浮床空心菜对罗非鱼养殖池塘水体微生态环境影响方式分析
2023-02-14范立民裘丽萍孟顺龙苏永腾胡庚东陈家长
范立民,王 庆,陈 曦,裘丽萍,孟顺龙,宋 超,苏永腾,胡庚东,陈家长
(1中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室,江苏无锡 214081;2南京农业大学无锡渔业学院,江苏无锡 214081;3无锡中粮工程科技有限公司,江苏无锡 214062;4江苏溢荟生物技术有限公司,南京 211225)
0 引言
浮床空心菜种植对水质的净化能力已经被很多的研究证明[1-3],并且和水芹、水龙、生菜等多种其他的植物相比,浮床空心菜还具有相对更好的净化效果[4]。浮床空心菜种植在罗非鱼[5-7]、鲤鱼[8-9]、中华绒螯蟹[10]、甲鱼[11]、鲫鱼[12]、草鱼[13]养殖池塘中均表现出了较好的净化效果。除此以外,浮床空心菜在高原地区的种植[14]、和其他水生植物的轮作[15],甚至在尾水净化实验中[16-17]均得到了较好的应用。空心菜可以通过从水中吸收氮、磷和微量元素等营养物质的方式对水质进行净化;空心菜浮床对水面的遮挡降低了水体的光能量摄入,与营养竞争作用一起会在一定程度上抑制藻类的生长;浮床空心菜对藻类生长的影响和空心菜夜晚的呼吸耗氧会造成水体溶解氧的下降;空心菜尽管可以一定程度上降低水中藻类对空气中二氧化碳的固定,但是其自身的光合作用所固定的二氧化碳也会经新陈代谢后完成向水中的迁移。这些都是浮床空心菜种植在理论上能够影响水体理化指标的因素,对于影响程度会受到多种因素的影响,包括空心菜生长状况、种植面积、池塘养殖过程中人为的物质和能量输入输出状况等。而具体在什么情况下是以哪种作用为主,目前为止尚缺乏系统性的报道。但是已有的一些研究证明,这些作用都是存在的,都是浮床空心菜影响池塘生态系统的重要方式。
另一方面,浮床栽培空心菜对养殖池塘水体微生物状况影响的也引起了学者们的重视,已有的一些研究表明,浮床栽培空心菜可以一定程度上对系统微生物群落造成影响。已有的一些对空心菜对水中细菌群落多样性的研究结果略有不同,有的研究表明空心菜栽培对水中细菌的群落多样性没有影响[18],另一些研究认为其能在一定程度上对池塘细菌多样性造成影响,但未见其差异显著性分析结果[19-20],笔者以为,这些研究结果是不矛盾的,差别是由浮床空心菜的覆盖率和养殖水体自身营养物质水平差异等因素造成的。另外,即使在分类多样性层面或一些细菌分类学水平上未造成显著性的差异,以功能进行区分的一些微生物群落的相对丰度或多样性可能已经在发生一些变化了。因为作为养殖池塘物质循环和能量流动的重要驱动力,微生物功能多样性的变化是水体理化状况变化的重要生物学基础。有研究表明,水中栽培空心菜可以增加水体微生物的数量,促进水体氮循环[21]。不仅如此,浮床空心菜还有利于促进水中脱氮细菌直接的稳定生长[22],包括改变不同种类氮循环细菌在生态系统中的分布状况[23]。与此同时,作为一种生物附着基,空心菜根系在养殖池塘水体总同样会附着一些根际微生物群落,形成生物膜来发挥作用。因此,即使其没有对所在水体微生物组成造成显著影响,但是通过增加单位面积水体功能性微生物的相对丰度,空心菜根系同样会发挥除直接吸收营养物质之外的功能。已有研究表明,浮床空心菜根际微生物在不同富营养程度水体中会发挥不同程度的营养物质分解净化的功能[24],但是其他促进营养物质向水体中转移的能力是否也同时有变化还未见报道。另外,总体而言,浮床空心菜对养殖水体微生物群落的影响相对还较少,还需要从不同角度积累更多的报道,从而更加系统化和精细化完善浮床空心菜、乃至其他浮床生物在水质净化中的基础数据。
本研究拟从浮床空心菜根际细菌群落和水中细菌群落之间相互作用的角度来分析其对水中细菌群落的影响,从浮床空心菜对单位面积养殖水体固氮酶基因丰度增加量的角度来分析其是否在发挥氮移出的同时可能会促进空气中氮素向养殖水体的输入,进而来综合分析浮床栽培空心菜对养殖池塘水体微生态环境的影响,为有关研究提供基础数据。
1 材料与方法
1.1 样品采集
样品采集的6口养殖池塘位于中国水产科学研究院淡水渔业研究中心宜兴屺亭养殖基地。每口面积约为1330 m2,初期水深约0.7 m,7月上旬加水至约2 m。养殖所用吉富罗非鱼(Oreochromis niloticus)鱼苗由养殖基地自己繁殖(5月上中上旬),2015年5月20日放苗,放养密度为2.6尾/m2。其中3口试验塘为对照塘,只进行罗非鱼养殖.在另3口试验塘中浮床种植空心菜(Ipomoea aquatica),浮床投放时间为2015年6月上旬。浮床制作选用PVC管材料(φ=50 mm),规格为2 m×2 m。在浮床上用尼龙绳系住网孔直径为30 mm的网片,用于插播空心菜。插种时,将空心菜菜秧去叶,剪成10 cm左右且带有腋芽或顶芽的小段,将3个这样的小段植入一个网孔中按株行距20 cm×20 cm进行扦插。将浮床用尼龙绳连接固定。种养面积占池塘总面积10%左右。养殖期间对照组塘和试验组塘的日常管理一致,期间不换水。
分别于2015年7月和8月下旬进行样品的采集。水样采集自水面下深度0.01 m处(约与空心菜根系长出后同一深度范围),沿池塘矩形长边方向中线均匀设点,对照塘和处理塘采样点布设见图1。将相同池塘三个点水样等比例均匀混匀后,作为该池塘该次样品,100 mL混合水样经孔径0.22 μm微孔滤膜过滤,滤膜放置2 mL灭菌离心管后浸于液氮罐中短暂处理,然后放于-80℃超低温冰箱中备用。3口对照塘7月得到的3个滤膜样品命名为W11、W12、W13,8月份得到的样品分别命名为W21、W22、W23。与之对应的3口处理塘得到的滤膜样品分别命名为RW11、RW12、RW13、RW21、RW22、RW23。采集1 g空心菜根部样品,放入100 mL灭菌重蒸水中,置于摇床上500 rpm震荡10 min,将100ml震荡过的水同样用0.22 μm孔径的水相微孔滤膜过滤,将过滤完的滤膜放于灭菌离心管中后,置于-80℃超低温冰箱中备用。3口处理塘两次得到的根系滤膜样品分别命名为R11、R12、R13、R21、R22、R23。

图1 池塘采样点布设示意图
1.2 水质分析
采用分光光度法测定水中氨氮(NH3-N)和亚硝酸盐氮(NO2-N)浓度;采用有机碳分析仪(GE SieversInnovOx Laboratory TOC Analyzer)测定水中总有机碳(TOC)、总碳(TC)、无机碳(IC)浓度;采用过硫酸钾氧化法测定水中总磷(TP)和总氮(TN)浓度;采用酸性高锰酸钾氧化法测定水中高锰酸盐指数COD mn。
1.3 样品DNA的提取和纯化
采用PowerWater DNA Isolation Kit(MO BIO,美国)进行水样总DNA的提取,采用PowerSoil DNA Isolation Kit(MO BIO,美国)进行根系总DNA的提取;采用Mobio PowerClean DNA Clean-Up Kit进行提取到的DNA的纯化;采用琼脂糖凝胶电泳(1%)检测纯化后的DNA样品。
1.4 细菌16S rRNA基因的扩增及高通量分析
采用带有barcode(标签)的特异引物(引物序列为338F:5′-ACTCCTACGGGAGGCAGCAG-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′),扩 增 细 菌 16S rRNA基因V3~V5可变区;扩增体系包括(终体积20 μL):10 ng模板DNA,2 μL 2.5 mM dNTPs,4 μL 5×FastPfu buffer(TransGen Biotech,中 国 ),0.4 μL FastPfu polymerase(TransGen Biotech,中国)和正反引物各0.8 μL(5 μM);采用ABI GeneAmp® 9700型基因扩增仪进行PCR扩增,扩增程序参照文献[25]。采用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)回收扩增产物,采用QuantiFluor™-ST蓝色荧光定量系统(Promega公司)进行定量。采用Illumina MiSeq PE300平台对产物进行高通量测序(由上海美吉生物有限公司完成)。
1.5 数据优化
参照文献[26]的标准进行数据优化和质控。
1.6 生物信息学分析
采用Usearch(vsesion 7.1 http://drive5.com/uparse/)软件序列进行可操作性分类单元OTU(operational taxonomic unit)的聚类分析(97%相似度水平);采用Qiime(http://qiime.org/scripts/assign_taxonomy.html)软件、RDP classifier贝叶斯算法对OTU代表序列进行分类学分析(silva数据库、97%相似度水平)。
1.7 nifH基因的荧光定量分析
采用ABI 7500荧光定量PCR仪(美国),使用SYBRGreen Real-Time PCR试剂盒(ABI Power SybrGreen qPCR Master Mix(2X)),采用 SYBRGreen Ⅰ法荧光定量分析细菌nifH基因拷贝数。引物序列为 nifH-1F:5'-AAAGGCGGAATCGGCAAGTC-3'和nifH-2R:5'-TTGTTCGCGGCGTACATG-3'。
为了计算空心菜根系对单位体积水体中固氮酶nifH基因拷贝数的贡献量,在2次采样时同时随机采集并测量浮床下50根空心菜根系的长度和重量,计算根系的平均长度和平均重量,然后根据每个浮床所种植的空心菜的数量估算空心菜根系在采样时对其所占据水体单位体积贡献的固氮酶nifH基因拷贝数。计算见公式(1)。

其中RnifH:空心菜根系对所占据单位体积水体固氮酶nifH基因拷贝数,单位Copies/mL;Q:1 g空心菜根系所得到滤膜样品固氮酶nifH基因拷贝数,单位Copies/g;Ga:每株空心菜根系的平均重量,单位g:空心菜的平均长度,单位m。
2 结果与分析
2.1 浮床空心菜种植对“门”水平细菌群落在罗非鱼养殖池塘水体中分布的影响
通过对包括水样和根系样品在内的18个样品的高通量测序及分析,本次试验共得到554700条有效序列,序列平均长度为438.88 bp。这些序列可以归纳为1741个OTUs(Operational Taxonomic Units()图2(a)),其中空心菜根系(R)中1440个OTUs,空心菜栽培池塘水(RW)中 1264 个 OTUs,对照塘水(W)中 1205 个OTUs。
采用Venn图2(a)分析对照塘水、空心菜栽培池塘水和空心菜根系OTUs数量的关系,结果表明,空心菜根系中独有的OTUs有385个,占总OTUs的22.11%,空心菜栽培塘水和对照塘水中独有的OTUs均只有10个,分别占总OTUs的0.57%,表明空心菜根系上附着的细菌组成与其所在的塘水间具有明显的区别。对基质间共有OTUs的分析表明,3种基质间两两共有OTUs占总OTUs的百分比分别为64.04%(RW/W),61.74%(R/RW)和58.36%(R/W),单因素方差分析表明空心菜根系中的OTUs显著多于塘水中(p<0.05),但空心菜栽培并没有对池塘水体中细菌的OTUs数量造成影响(p>0.05)。
测序得到的这些OTUs则可以归纳为37个门(phyla)或 组(groups)。 图 2(b)显 示 ,变 形 菌 门(Proteobacteria)、蓝细菌门(Cyanobacteria)、硬壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)在空心菜根系及空心菜栽培塘和对照塘水中均具有相对较高的丰度。对这5个门在这3种基质中的的相对丰度进行对比表明,硬壁菌门(Firmicutes)的相对丰度在3种基质中的相对丰度无显著差异(p>0.05()根系:12.55%±16.13%,浮床栽培塘水:14.49%±7.72%,对照塘水:8.61%±5.44%,变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)的相对丰度均表现为根系中与2种塘水中的差异显著(p<0.05),而对照塘和处理塘水间的差异不显著(p>0.05)。其中变形菌门(Proteobacteria)(根系:47.00%±6.21%,浮床栽培塘水:25.53%±7.53%),对照塘水:20.89%±4.67%)和拟杆菌门(Bacteroidetes)(根系:13.73%±4.41%,浮床栽培塘水:8.35%±1.29%),对照塘水:8.18%±1.41%)在根系中具有较高的相对丰度,蓝细菌门(Cyanobacteria)(根系:13.66%±7.00%,浮床栽培塘水:25.08%±10.28%),对照塘水:30.19%±10.04%)和放线菌门(Actinobacteria)(根系:1.50%±0.52%,浮床栽培塘水:11.69%±1.72%),对照塘水:12.35%±2.18%)在水中具有较高的相对丰度。
以上结果表明空心菜根系具有明显的细菌群落选择性,但试验条件下其没有对水中主要的细菌群落组成在门水平造成显著的影响。
2.2 空心菜根系和水中细菌群落及关系
2.1 的分析表明,无论是OTU数量还是“门”水平的群落组成,在空心菜根系和所在池塘水中之间均存在着显著差别。我们希望进一步分析这些差别。图2(c)显示了“纲”水平的空心菜根系独有的细菌群落组成,独有OTU平均相对丰度占总平均相对丰度的10.25%,这些“纲”水平细菌群落组成主要包括Sphingobacteriia、Deltaproteobacteria、Alphaproteobact eria、Betaproteobacteria、Cytophagia、Gammaproteobact eria和 Flavobacteriia等 ,其 中 Sphingobacteriia、Deltaproteobacteria、Alphaproteobacteria是优势菌群。对空心菜根系和所在池塘水中共有细菌群落分析表明,有140个OTU的相对丰度在空心菜根系上显著上调(占共有OTU丰度的30.5%),有149个OTU的相对丰度在空心菜根系上显著下调(占共有OTU丰度的3.3%)(图2(d)),表明空心菜根系对水中的相当一部分浮游细菌存在着较强的选择性富集作用。同样,在“纲”水平对这些共有菌群进行分析,结果表明(图2(e)),空心菜根系对Betaproteobacteria的富集能力相对较强,而对Actinobacteria的相对丰度显示出“下调”作用。蓝细菌纲在水中具有最高的相对丰度,在空心菜根系相对丰度出现明显的下降,但是仍然是其主要细菌组分之一。

图2 水和空心菜根系细菌OTU及群落组成情况
2.3 空心菜种植对池塘水体浮游细菌群落α多样性的影响
对来自3中基质的细菌群落Ace(图3(a))丰富度指数及多样性指数Shannon(图3(b))进行分析表明,空心菜根系、空心菜种植塘水中和对照塘水中细菌群落丰富度指数Ace平均分别为1195.33、947.83和914,多样性指数Shannon平均分别为5.25、4.89和4.94。空心菜根系细菌丰富度指数Ace的值显著高于空心菜所在塘水和对照塘水(p<0.05),但空心菜种植塘水和对照塘水间细菌丰富度指数Ace差异不显著(p>0.05);空心菜根系细菌多样性指数Shannon的值虽然略高于空心菜所在塘水和对照塘水,三者之间细菌丰富度指数Ace差异均不显著(p>0.05)。

图3 不同基质的丰富度和多样性指数
2.4 空心菜种植对池塘水体浮游细菌群落β多样性的影响
对所有样品测序所得到的OTUs进行NMDS分析(图4),结果表明空心菜根系样品中的细菌群落和池塘水中细菌群落具有较大差异;无论是空心菜根系中的细菌群落还是池塘水中的细菌群落均随着时间的变化有产生变化的趋势。为了进一步验证这些差异的显著性水平,笔者分别对不同分组样品进行ANOSIM分析,结果显示空心菜种植池塘的细菌群落和对照塘的细菌群落之间差异不显著(R=0.628,P=0.47),空心菜根际细菌群落与空心菜种植塘以及与对照塘细菌群落之间均差异显著(均为R=0.628,P=0.002);池塘水中细菌群落(包括空心菜种植塘和对照塘)在不同采样时间间差异显著(R=0.999,P=0.002),但空心菜根际细菌群落在两次不同采样时间见的差异不显著(R=0.999,P=0.10)。综合以上结果,本研究认为,尽管空心菜根系附着的细菌群落明显不同于其所在水中的细菌群落,但在种植面积10%的情况下,池塘浮床种植空心菜不会对水中浮游细菌的群落结构造成显著影响;水中的细菌群落会随着时间的变化而变化,空心菜根际细菌群落可能也有随着时间变化而发生变化的趋势。
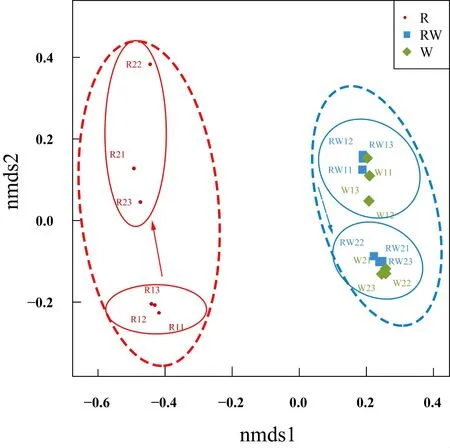
图4 池塘系统中细菌群落的NMDS排序分析
为了了解空心菜种植池塘以及对照池塘水中浮游细菌群落和水环境质量状况之间的关系,首先采用Mantel检验对水中浮游细菌群落和环境变量进行相关性分析,结果表明,环境变量能够解释水中浮游细菌的群落结构多样性状况(p=0.002,r=0.538);在此基础上,采用enfit函数来检验不同环境变量解释水中浮游细菌群落排序(NMDS)的显著程度,结果如表1所示,表1表明无机碳、氨氮和亚硝态氮与水中浮游细菌的群落结构间具有显著的相关关系(p<0.05);采用Bioenv函数来分析筛选与水中浮游细菌群落结构具有显著相关关系的环境变量组合,结果表明环境变量中只有无机碳一个变量入选(r=0.839)。

表1 水中细菌群落与环境因子之间的关系
2.5 空心菜种植对池塘水质的影响
如前所述,罗非鱼养殖池塘水中浮游细菌群落和水质无机碳、氨氮和亚硝氮间具有显著的相关性,特别是无机碳。除此以外,笔者还希望了解空心菜种植是否对池塘水质产生了显著的影响。通过对空心菜种植塘和对照塘环境因子的分析,可以发现空心菜种植可以使得池塘中总氮、总磷、高锰酸盐指数、总有机碳和总碳显著降低(p<0.05)(图5(c)、(d)、(e)、(f)、(g)),和对照组相比分别平均下降7.98%、20.56%、40.29%、27.7%和11.5%。但是这样的影响和与水中浮游细菌密切相关的理化因子组合并不相同,这可能是造成空心菜种植没有对池塘水中浮游细菌群落产生显著影响的原因。


图5 空心菜种植对池塘水质的影响
2.6 空心菜种植对单位体积水中固氮酶nifH基因丰度的影响
前已述及,实验条件下空心菜浮床种植对池塘水中细菌群落结构影响不显著,笔者还希望了解空心菜种植对池塘水中和氮素代谢密切相关的固氮菌丰度的影响。图6可见,空心菜种植塘和对照塘水体中固氮酶基因nifH拷贝数之间没有显著差异(p>0.05),但是经过换算的空心菜根系附着的细菌为其所占据的单位体积水体所贡献的nifH基因拷贝数显著高于其所在的水中的拷贝数(p<0.05),换句话说,即使不考虑空心菜根系所在池塘水体中已有的固氮酶nifH基因,空心菜根系为其所占据的单位体积水体贡献的nifH基因拷贝数也远远大于池塘水体单位体积中的拷贝数。由此可见,池塘种植空心菜并不是简单的植株生长吸收水体中的氮素那么简单,还存在着促进空气中氮气的固定作用这样的过程。

图6 空心菜种植对单位体积池塘水固氮酶nifH基因拷贝数的影响
3 讨论
3.1 浮床空心菜种植对池塘生态系统细菌群落的影响分析
本研究表明,以10%的覆盖面积浮床种植空心菜对池塘浮游细菌群落并没有显著的影响,无论是“门”水平的群落组成,还是群落多样性均未发生显著变化。这与李建柱等[19]在草鱼养殖池塘中的研究类似。李建柱等采用3.5%的浮床空心菜覆盖率研究其对池塘中微生物群落的影响,结果表明,在“门”水平上浮床空心菜没有对水中的浮游细菌群落造成显著影响。然而,两者之间亦有不同之处,3.5%的浮床空心菜覆盖率一定程度上提高了水体浮游细菌丰富度指数、降低了其多样性指数。和本研究相比,其无论是养殖品种、浮床面积还是水质营养状况都存在着不同,这些都可能是原因,但是笔者认为其中水质营养负荷可能是最主要的原因,两者在水质总氮、氨氮等水平都存在非常显著的差别,本研究中的罗非鱼养殖池塘中总氮和氨氮的浓度均接近于2倍于草鱼养殖池塘。有研究表明,以营养物质浓度为代表的环境因子对浮游细菌群落的影响甚至能够大于6000 km空间距离对其的影响[27],一些其他的影响因素往往最终也是通过改变环境因子的浓度来对浮游细菌群落造成影响。因此,对于养殖池塘来讲,营养负荷越高,包括浮床种植在内的外源性干预对浮游细菌群落结构的影响可能也就会越小。尽管如此,浮床种植空心菜在还未明显改变水中浮游细菌群落结构多样性的情况下,一些细微的变化可能已经在发生,例如通过某种机制影响到水中细菌及氮循环细菌的数量。吴伟等[21]的研究就表明,在异育银鲫为主养品种的池塘中分别以10%和20%的覆盖率,浮床空心菜种植40天后能够促进水中细菌总数及氮循环细菌数量的增加;并且随着浮床覆盖率的增加,其影响也越显著,王珊珊等[22]的研究表明,空心菜浮床面积占总面积25%以上时能够促进水中脱氮细菌的稳定生长。
浮床空心菜种植对池塘微生态环境的影响不光是直接对于其接触的浮游细菌群落结构,空心菜根系作为基质为水中微生物提供了附着场所,并且随着根系的不断生长,基质表面积也不断增加。本研究表明,空心菜根系独有OTU占总数的22.11%,这些OTU可能是由空心菜幼苗栽培时带入的,随着空心菜的不断生长,其可能也经历了自然选择的过程,并在系统中发挥着作用;与此同时,根系作为基质对占总数30.5%的OTU发挥了富集作用,使得占总数3.3%的OTU表现为下调作用。这样以富集为主的选择性富集作用和空心菜幼苗带入的独有菌群一起在池塘生态系统中形成了特异性的生物膜,尽管对水中浮游细菌群落的直接影响不显著,但是水中的生物膜同样是池塘微生态环境中重要的组成部分,同样在池塘生态系统包括氮循环在内物质循环中发挥着重要的作用。有研究表明,相较于水中,亚硝化细菌和硝化细菌在空心菜根系具有更多的数量分布[29],因此空心菜根系生物膜为池塘水体的硝化反应的发生提供了生物学基础。而本研究首次对空心菜根系表面的固氮菌进行了定量研究,经换算后其显著增加了空心菜所在区域单位水体固氮菌的数量,因此空心菜根系在促进氮素硝化转化的过程中,也可能在一定程度上促进了空气中氮素向池塘水体的转移。
3.2 浮床空心菜种植对水质影响及原因分析
本研究表明,在吉富罗非鱼养殖池塘中以10%的空心菜浮床覆盖率使得水质指标总氮、总磷、高锰酸盐指数、总有机碳和总碳均显著下降,和对照塘相比下降平均幅度分别达到7.98%、20.56%、40.29%、27.7%和11.5%。目前为止,已经报道了在多个养殖品种池塘中采用浮床空心菜来净化水质的研究。本实验室先前在以异育银鲫为主的养殖池塘中以10%和20%的覆盖率来浮床种植空心菜的研究,和对照组相比,水中总磷、总氮、氨氮、硝态氮、亚硝态氮、叶绿素a和高锰酸盐指数等多个指标均显著下降,并且20%覆盖率下降幅度更大;李文祥等[3]在异育银鲫为主养品种的池塘中同样以10%的空心菜覆盖率,使得水质总磷、总氮和高锰酸盐指数的值在9至11月份间显著低于对照池塘,这与本研究基本吻合;Li等[29]采用10%的覆盖率在中华鳖养殖池塘中种植浮床空心菜对水质进行净化,结果表明氨氮、总氮、总磷、叶绿素a和浊度在7月份以后显著低于对照塘。在罗非鱼养殖池塘中也有学者进行过浮床空心菜净化水质的研究,郭中宝等[5]和宋超等[30]在罗非鱼养殖池塘中应用浮床空心菜来控制氮磷的实验表明,其对水质总氮、总磷、氨氮、亚硝酸盐氮等也都起到了明显的净化效果。和本研究相比,空心菜种植使得水质氨氮、亚硝氮均显著下降。总体而言,池塘中浮床种植空心菜的研究表明均会对水体总氮、总磷到净化作用。这2个指标均包含了几个更具体的指标,例如总氮包括有机氮、氨氮、硝态氮、亚硝态氮等,总磷包括有机态磷、可溶性磷酸盐等,这些具体指标的值在不同的养殖池塘中可能会受到不同的具体条件的影响而呈现出更为多样性的变化,因此浮床空心菜对其的影响也就可能会有所不同,这可能是造成不同的这些研究中这些指标有的显著降低了,而另一些没有显著降低的原因。
对于这些具体的水质指标,有的指标能够直接被空心菜所利用,而其他的主要是通过微生物的转化后而浓度降低的。Zhang等[31]的研究认为,空心菜对水质磷的净化作用主要通过直接吸收,而氨氮和硝酸盐的净化作用主要是基于微生物的作用。本研究中除了总磷和总氮外,和对照组相比空心菜种植塘高锰酸盐指数和总有机碳浓度也显著下降,其显然不会被空心菜直接利用了,而是基于微生物的作用。即使是总氮,由于处理塘氨氮、亚硝氮等无机氮没有明显下降,推测其有机氮部分应该通过微生物的转化使得其浓度降低了,与此同时,相当多的无机氮也会被移出到系统之外,只不过增加和降低的联合作用结果是氨氮和亚硝氮浓度没有显著降低。而发挥作用的微生物一部分来自水中的浮游微生物,其群落结构尽管没有被显著改变,但是根据先前的一些研究,浮床空心菜可以通过某种机制促使水中的细菌总数和氮循环细菌总数增加,从而间接发挥水质净化的作用,至于水中微生物群落和水质无机碳、氨氮和亚硝态氮间的相关关系可能是因为刚好两者最终的结果是都没有因浮床空心菜的种植发生显著的改变。另外一部分发挥作用的微生物就来自空心菜根系形成的选择性生物膜。生物膜和根系本身构成了一个复杂的系统,可以同时发生直接吸收营养物质和生物膜中微生物对水质的净化作用,空心菜浮床比仿生植物具有更好的去除效果净化效果可以在一定程度上证明这一点[16]。而生物膜对氮素转化同样包含了促进空气中氮气的固定和促进水体氮素转化双重的效应。从另一方面来说,任何影响到空心菜生长发育的因素均可能影响到其物质吸收和生物膜形成及转化作用,也就会影响到浮床空心菜对水质的净化效果,例如水中的营养状态、酸碱度等均会对空心菜的生长造成影响,也就会对水质净化效果造成影响,这也是不同养殖池塘中使用浮床空心菜来净化水质效果会产生差异的重要原因。酸碱度水体对其中水培的空心菜产量造成影响
4 结论
(1)罗非鱼养殖池塘中,以10%的覆盖率浮床种植空心菜对水体浮游细菌群落结构影响不大;
(2)空心菜根系生物膜细菌的组成包括外源性的独有菌群和来自水中的菌群,其中生物膜对水中菌群的附着大部分相对丰度未显著变化,除此以外的部分基本上都进行了富集(上调)。
(3)生物膜对水质的作用可能包含促进水中氮素的转化的一面,还包含促进对空气中氮气向水中转移的一面。
