不同提取方法的莲子心多糖结构与理化性质比较
2023-02-13方嘉沁郑青松文雨欣郑丹纯阳运军翟永贞张霞李冰
方嘉沁,郑青松,文雨欣,郑丹纯,阳运军,翟永贞,张霞,3,李冰,3*
(1.广州酒家集团利口福食品有限公司,广东广州 511442)(2.华南理工大学食品科学与工程学院,广东广州510640)(3.广东省天然产物绿色加工与产品安全重点实验室,广东广州 510640)
天然活性化合物如多糖、多酚类物质等都具有较好的抗氧化活性,可作为天然抗氧化剂应用于食品工业及多种疾病的治疗中[1-3]。《中国药典》收录记载:莲子心具有清心火、平肝火、清心安神等作用。莲子心作为莲加工的副产物对其所含活性物质的开发利用程度不高。莲子心多糖是莲子心中的主要化学成分之一,具有抗氧化、降血糖等作用,是很有应用前景的活性功能因子。目前关于莲子心多糖的提取方法主要局限于热水浸提,存在提取效率偏低等问题。
植物多糖的提取方法包括传统的热水浸提法以及其他辅助提取技术,传统热水浸提法具有条件温和、不破坏多糖结构的优点,但同时会消耗大量成本和时间,且提取效率不够高。其他辅助提取方法包括酶辅助提取、超声辅助提取、微波辅助提取、脉冲电场辅助提取、超临界流体辅助提取等,各自具有不同的优缺点。在众多新颖的辅助提取方法中,超声辅助提取(UAE)、酶辅助提取(EAE)和微波辅助提取(MAE)是天然活性产物提取目前最常见的方法。已有文献表明,多糖的生物活性与其分子量、单糖组成、糖醛酸含量以及空间构型等有关[4-6]。提取方法的不同对多糖得率、多糖纯度、理化性质、结构特征、功能特性以及生物活性都会造成一定的影响[7]。目前对于不同提取方法对莲子心多糖得率、含量、理化性质以及功能特性的影响尚不明晰。
因此,本研究分别采用超声辅助提取(UAE)、酶辅助提取(EAE)、微波辅助提取(MAE)和传统热水浸提法(HWE)提取莲子心多糖,考察不同方法对莲子心多糖得率、纯度、理化性质以及功能特性的影响。
1 材料与方法
1.1 材料与仪器
干燥莲子心,由湘潭莲子生产基地提供。利用小型中草药粉碎机进行粉碎,得到莲子心粉末备用。乙醇、苯酚、浓硫酸、正丁醇、三氯甲烷为分析纯,国药集团化学试剂有限公司。纤维素酶、蛋白酶、果胶酶、牛血清白蛋白、葡萄糖、单糖标准品为分析纯,上海源叶生物科技有限公司。
XL-20B高速中草药粉碎机,广州旭朗有限公司;Milestone Ethos微波萃取仪,北京莱伯泰科仪器股份有限公司;KQ5200DE超声波清洗仪,昆山舒美超声仪器有限公司;3-30KS高速冷冻离心机,美国Sigma公司;Wizard2.0真空冷冻干燥机,美国VirTis公司;Carry 50紫外可见分光光度计,美国 Varian公司;UltiMate3000高效液相色谱仪,赛默飞世尔科技有限公司;Vertex33红外光谱仪,德国 Bruker公司;JSM-7001F扫描电子显微镜,JEOL,Japan;1525GPC高效凝胶渗透色谱仪,美国 Waters公司;MOS-450圆二色谱仪,法国Biologic公司;STA449F3同步热分析仪,德国耐驰公司。
1.2 实验方法
1.2.1 原料的预处理
将莲子心粉末用乙醇在室温下浸泡3次,每次12 h,以除去部分脂溶性小分子物质、色素等杂质,最后将浸泡后的莲子心粉末用 40 ℃烘箱烘干,装入自封袋保存于干燥皿中备用。
1.2.2 莲子心多糖的提取
(1)热水浸提:取预处理之后的莲子心粉末,以蒸馏水为提取溶剂。参考He等[8]的方法,并做适当改进。设定提取温度为90 ℃,料液比为1:25(g/mL),提取次数为3次,收集3次提取液,得到莲子心多糖热水浸提液。
(2)超声波辅助提取:参照Ying等[9]的方法,取预处理之后的莲子心粉末,以蒸馏水为提取溶剂。设定超声功率为200 W,超声时间为40 min,提取温度为60 ℃,料液比为1:25(g/mL),提取3次,并收集提取液,得到莲子心多糖超声辅助提取液。
(3)微波辅助提取:参照Hu等[10]的方法,做适当改进,以蒸馏水为提取溶剂。设定微波功率为600 W,微波时间为3 min,料液比为1:25(g/mL),提取3次,收集提取液,得到莲子心多糖微波辅助提取液。
(4)酶辅助提取:参照Guo等[11]的方法,以纤维素酶、果胶酶和蛋白酶复合酶法辅助提取,以蒸馏水为提取溶剂。纤维素酶、果胶酶和蛋白酶以 1:1:1的质量比例复配,酶添加量为1%(m/m),酶解温度50 ℃,酶解时间30 min,提取温度70 ℃,提取时间1 h。收集提取液,得到莲子心多糖酶辅助提取液。
1.2.3 醇沉
对四种方法得到的莲子心多糖提取液分别进行除杂和浓缩。首先,离心机转速为6 000 r/min离心5 min,取上清液,抽滤(0.45 μm的水系膜),进一步除去微小固体杂质。利用旋转蒸发仪对所得到的莲子心多糖提取液进行浓缩。浓缩至粘稠状之后,加入4倍体积的无水乙醇,4 ℃条件下,放置12 h,之后6 000 r/min离心 5 min,取沉淀,用蒸馏水复溶得到对应莲子心多糖溶液。
1.2.4 除蛋白
取莲子心多糖溶液,采用 Sevage法除蛋白,按4:1的体积比加入Sevage试剂(三氯甲烷:正丁醇=4:1),离心(3 000 r/min,2 min),取上清,重复操作5次。利用旋转蒸发除去残留的有机试剂,蒸馏水透析36 h(3 500 u透析袋)。最后冷冻干燥得到不同方法所对应的除蛋白后的莲子心多糖粉末:热水浸提莲子心多糖(PNPHWE)、超声波辅助提取莲子心多糖(PNPUAE)、微波辅助提取莲子心多糖(PNPMAE)、酶辅助提取莲子心多糖(PNPEAE)。
1.2.5 多糖得率与纯度
利用苯酚-硫酸法对多糖的含量进行测定[12,13],以葡萄糖为标准品绘制标准曲线,以葡萄糖浓度为横坐标,吸光度为纵坐标绘制葡萄糖标准曲线,依据葡萄糖标准曲线可计算样品多糖得率与纯度(见公式1和2)。

式中:
A——多糖得率,%;
B——多糖纯度,%;
M0——利用标准曲线计算得到的样品中多糖质量,g;
M1——多糖的质量,g;
M2——样品的质量,g。
1.2.6 蛋白含量
参考 Cortes-Rios等[14]的方法,以牛血清白蛋白(BSA)为标准品,利用 BCA试剂盒测定四种样品中蛋白含量。
1.2.7 糖醛酸含量
参考王文平等[15]的方法,以葡萄糖醛酸为标准品,使用咔锉-硫酸法测定莲子心多糖的糖醛酸含量。
1.2.8 分子量的测定
参考 Ren等[16]的方法,采用高效凝胶渗透色谱(High Performance Gel Permeation Chromatography,HPGPC)测定不同方法得到的莲子心多糖的分子量分布。分别称取10 mg多糖样品,充分溶解于10 mL的磷酸二氢钾缓冲溶液(0.02 mol/L),用0.22 μm的水系滤膜过滤之后进行色谱分析。以普鲁兰系列葡聚糖为标准品(Mw:5 200 u、11 600 u、23 800 u、48 600 u、148 000 u、273 000 u、410 000 u、668 000 u)。色谱分离条件如下:仪器型号:Waters ACQUITY APC;色谱柱:Waters ACQUITY APCTM AQ900(4.6 mm×150 mm,2.5 μm)、Waters ACQUITY APCTM AQ450(4.6 mm×150 mm,2.5 μm)、Waters ACQUITY APCTM AQ125(4.6 mm×150 mm,2.5 μm),3根色谱柱串联;流动相:100 nmol/L NaNO3,流量:0.4 mL/min,柱温:35 ℃,示差折光检测器(RID),检测器温度:35 ℃。以出峰时间为横坐标,普鲁兰分子量的对数(logMw)为纵坐标,利用 HPGPC软件拟合得到分子量标准曲线,根据标准曲线计算样品多糖的分子量。
1.2.9 单糖组成测定
参考Chen等[17]的方法,采用高效液相色谱(HPLC)测定不同方法得到的莲子心多糖的单糖组成。
(1)样品的水解
取10 mg多糖样品放入高温高压管密封试管,加入2 mL三氟乙酸(TFA 4 mol/L),混合均匀后,110 ℃油浴4 h,之后在甲醇辅助下,旋转蒸发除去三氟乙酸,得到水解后的多糖样品。
(2)样品的衍生化反应
水解后的多糖样品溶于 200 μL的 NaOH(0.3 mol/L),加入200 μL的PMP(0.5 mol/L)70 ℃反应1 h,加入200 μL的HCl(0.3 mol/L)进行中和,之后用三氯甲烷反复萃取除去 PMP,最后取上清过0.22 μm的有机膜,放进样瓶。单糖标准品的柱前衍生化也按上述步骤进行。
(3)高效液相色谱检测
采用美国Waters生产的2998 HPLC进行检测,色谱柱为C18柱(Waters,4.6 mm×250 mm,5 μm),柱温:30 ℃,流动相:磷酸盐缓冲溶液(pH值6.9)和乙腈(83:17),流速:1 mL/min,检测波长为 245 nm。
1.2.10 傅里叶变换红外光谱(FT-IR)测定
红外光谱的测定采用KBr压片法,取少量多糖样品与适量的KBr干燥粉末混合,充分研磨,然后压片,放入红外光谱仪进行扫描,扫描区间为400~4 000 cm-1,分辨率为4 cm-1。
1.2.11 扫描电子显微镜(SEM)分析
取少量多糖样品,放置于样品台,在真空喷镀仪中喷金处理后,进行扫描电镜分析,扫描电子显微镜为JSM-7001F(JEOL,Japan),在加速电压10.00 kV下观察样样品表面形貌。
1.2.12 圆二色谱(CD)分析
参考 Chen等[18]的方法,用圆二色谱仪对不同提取方法得到的莲子心多糖的圆二色光谱进行测定,配制0.5 mg/mL的多糖样品,扫描条件为:扫描速率为100 nm/min,缝隙宽度1 nm,时间常数1 s,扫描波长范围190~260 nm,扫描次数3次。
1.2.13 热稳定性分析
对莲子心多糖进行热重分析(TG)和差示扫描量热分析(DSC)测定[19]。称取10 mg的多糖样品置于样品托盘中,使用N2作为实验气流,流速为30 mL/min,温度从室温以10 ℃/min的速度升到500 ℃。
1.2.14 流变性质测定
(1)稳态流变学特性的测定参考Yang等[20]的方法,在25 ℃下,利用流变仪测定不同方法得到的莲子心多糖的稳态流变学特性,样品质量分数为2%,剪切速率为:0.1~1 000 s-1,测定时间为15 min条件下,测定不同剪切速率下莲子心多糖的表观粘度。在样品质量分数为2%,温度为:20~80 ℃,剪切应力为2 Pa,加热速度为6 ℃/min条件下,测定温度变化对表观粘度的影响。
(2)动态流变学特性的测定参考Xu等[21]的方法,在 25 ℃下,对莲子心多糖的动态流变学特性进行测定,样品浓度为2%,震动频率为1~100 rad/s,然后固定应变为1%,温度为25 ℃条件下,考察频率变化对损耗模量和储存模量的影响。
1.2.15 数据处理与统计分析
以上所有实验至少重复三次,实验结果采用平均值±标准差表示。所有数据均采用IBM SPSS 22.0进行统计分析,不同组数据采用单因素方差分析,并使用Origin 9.0软件进行绘图。显著性水平为p<0.05。
2 结果与讨论
2.1 不同提取方法对多糖得率与基本组成的影响
多糖得率和纯度是评价提取方法优劣最为重要和直接的考察指标。表1为四种不同提取方法对莲子心多糖得率、多糖纯度、蛋白含量、糖醛酸含量等的影响。多糖得率从高到底的顺序为:MAE>EAE>UAE>HWE,三种辅助提取方法均能够提高莲子心多糖得率,其中微波辅助提取方法多糖得率最高。多糖纯度从高到底的顺序为:PNPMAE>PNPUAE>PNPEAE>PNPHWE,与多糖得率相同,三种辅助提取方法均提高了样品中的多糖纯度,同样 PNPMAE的多糖纯度为最高。超声辅助法是利用超声的空化等效应促使多糖从植物细胞中扩散出来。微波辅助法是利用微波的“内加热”方法加促细胞内多糖扩散,且当细胞内水等极性介质受热膨胀到一定程度,会使细胞破裂,更有利于多糖的渗出。酶辅助法是根据细胞壁的组成,使用相应的酶破坏细胞壁的结构,从而利于细胞壁多糖和细胞内多糖的释放。因此,与传统热提取方法相比,三种辅助方法都可以大大提取多糖的得率与提取率,而微波对植物细胞的破裂作用,更利于多糖的渗出。

表1 不同方法得到的莲子心多糖的得率及基本组成Table 1 Chemical characteristics of crude PNP prepared by different methods
Sevage法是一种较为温和的除蛋白方法,能够减少多糖结构的破坏,但存在不能完全除去蛋白和多糖损失率较高的缺点。经过相同次数的除蛋白操作后,经蛋白含量测定表明,四种多糖样品均仍含有少量蛋白,含量从高到底顺序为:PNPEAE>PNPMAE>PNPHWE>PNPUAE。酶辅助法中含用蛋白酶,蛋白酶对植物细胞壁、膜上的蛋白以及细胞内蛋白都有一定的水解作用,这些蛋白也溶于提取液中,所以,虽然经过除蛋白的处理,但相比之下,酶辅助提取法中蛋白质杂质最多。
已有较多研究表明多糖活性与其糖醛酸含量之间有很大的关联,因此采用咔锉-硫酸法对四种样品中糖醛酸含量进行了测定,糖醛酸含量从高到底顺序为:PNPMAE>PNPEAE>PNPUAE>PNPHWE,其中PNPMAE的糖醛酸含量明显高于其他三种样品(p<0.05)。
表1结果表明不同提取方法会对多糖的基本组成产生影响,与传统热水浸提相比,三种辅助提取方法均能够提高多糖得率和多糖纯度,其中微波辅助提取方法的多糖得率最高,同时其样品的多糖纯度和糖醛酸含量也最高。这与很多文献的报道相一致。Zhao等[22]用超声辅助提取方法增加了刺五加多糖的得率和多糖纯度。Wang等[23]考察了热水回流、超声辅助、酶辅助和微波辅助四种方法对茯苓多糖基本组成和抗氧化活性的影响,结果表明微波辅助方法提高高了茯苓多糖的得率,增加甘露糖和糖醛酸含量的同时还增强了抗氧化活性。
2.2 不同提取方法得到的多糖分子量
多糖的分子量对其单糖组成、空间结构和生物活性都有较大的影响[24],因此,考察不同提取方法对莲子心多糖分子量的分布就尤为重要。如图1所示,PNPHWE(a)、PNPUAE(b)、PNPEAE(c)和 PNPMAE(d)的HPGPC谱图均有四个信号峰(峰4为溶剂峰),意味着莲子心多糖分子量分布主要包括三个组分,根据其分子量分布设定为高分子量组分(200 ku~350 ku,标记为峰1)、中分子量组分(50 ku~150 ku,标记为峰2)、低分子量组分(5 ku~25 ku,标记为峰3),根据各个峰的面积可以计算出各组分的占比。从图1可以看出:HWE和EAE得到的莲子心多糖主要组分均为低分子量组分,UAE和MAE主要组分为高分种子量组分和低分子量组分。三个组分峰面积占比从高到底的顺序为:高分子量组分:PNPMAE>PNPUAE>PNPHWE>PNPEAE;中分子量组分:PNPEAE>PNPHWE>PNPUAE>PNPMAE;低分子量组分:PNPEAE>PNPHWE>PNPUAE>PNPMAE。与传统方法对比,三种辅助提取方法对莲子心多糖三种分子量组分的分布有较大的影响,EAE一定程度上减少了高分子量组分的占比,增加了中分子量和小分子量组分的占比,这可能是由于酶辅助提取过程中破坏细胞结构增加多糖溶出的同时会对多糖本身的链结构造成破坏,从而导致高分子量组分的降低以及中分子量和小分子量组分的增加。MAE和UAE均明显增加了高分子量组分的占比,减少了小分子量组分的占比。这可能是因为微波辅助提取方法可以在短时间内提高温度,迅速破坏组织结构,从而增加高分子量组分的溶出[25]。同样地,由于超声波的空化作用、机械效应和热效应等,经过短时间的超声处理,加速了高分子量多糖的释放、扩散和溶解,从而提高了莲子心多糖中高分子量组分的占比。

图1 莲子心多糖的分子量分布:水提(a)、超声(b)、酶解(c)、微波(d)Fig.1 Molecular weight (Mw) distribution of PNP obtained by different extraction methods, PNPHWE (a), PNPUAE (b), PNPEAE(c) and PNPMAE (d)
以上结果表明,不同提取方法不仅会影响莲子心多糖的分子量大小,而且会对不同分子量组分的分布产生较大的影响。已有较多研究表明,多糖的分子量对其空间结构、表面形貌以及热力学性质、流变学性质等有较大影响,如Guo等[26]的研究表明,玉米丝三种不同分子量多糖的空间结构和表面形貌存在较大差异。Wang等[27]用超声波降解黄茶多糖后发现其空间结构、表面形貌均发生较大变化。同时,Hu等[28]的研究表明酶解反应对桑叶多糖的分子量带来较大影响,最终带来不同的热力学性质和流变学性质。
2.3 单糖组成分析
多糖中单糖种类和含量的不同会对多糖糖链的连接方式及其空间结构造成影响,并最终导致生物活性的不同。因此我们需要探究不同提取方法对莲子心多糖的单糖组成的影响。结果如图2所示,对照标准品,根据出峰时间判断不同方法得到的莲子心多糖的单糖组成,表2列出了各个样品单糖组成的摩尔百分比。根据四种多糖样品的摩尔百分比结果可知,莲子心多糖主要单糖组成包括葡萄糖、半乳糖和阿拉伯糖。与传统热水浸提相比,超声辅助法使得半乳糖含量增高,葡萄糖的含量减少,并且在PNPUAE样品中没有检测到木糖的存在;微波辅助提取法在保持单糖组成类型不变的情况下,改变了摩尔百分比,增加了半乳糖糖醛酸的占比,和 2.1中糖醛酸含量的测定结果相符;经过酶解处理后的莲子心多糖半乳糖、葡萄糖和甘露糖的含量都有所增加,与超声处理后相同,PNPEAE样品中未见有木糖的出现。由此可见,不同处理方法对莲子心多糖的单糖组成的种类和比例都有所影响。已有较多研究表明,多糖的单糖组成中糖醛酸的含量会对其生物活性有较大影响[29-33],在不改变多糖单糖组成类型的情况下,微波辅助提取法增加了糖醛酸的占比,可作为一种用来增加莲子心多糖的生物活性的辅助提取方法。

图2 莲子心多糖的傅里叶变换红外光谱图Fig.2 The FT-IR spectrum of PNP obtained by different methods
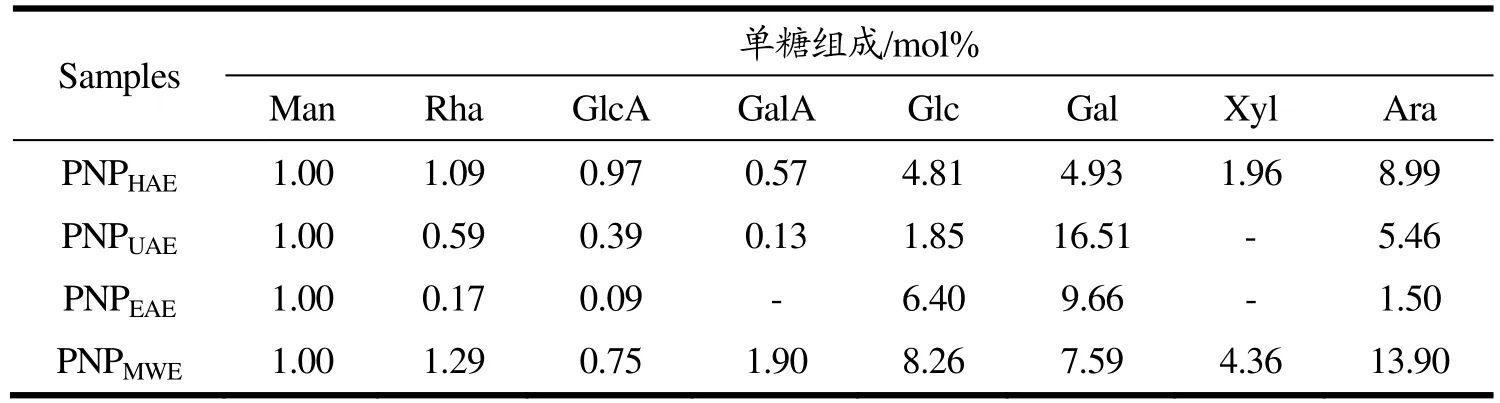
表2 不同样品单糖组成的摩尔百分比含量Table 2 Mole percentage content of monosaccharide composition of different samples
2.4 红外光谱对比分析
红外光谱可以用来分析多糖的糖苷键类型、官能团的类型以及糖环构型等[34],通过对比分析四种不同方法得到的莲子心多糖的红外光谱图,可以判断不同提取方法对莲子心多糖特征结构带来的影响。如图2所示,在4 000~500 cm-1的范围内,四种莲子心多糖样品均具有相似的多糖特征吸收峰,说明四种多糖有相似的特征结构。在3 367.7 cm-1处是-OH伸缩振动吸收峰[35],2 931.8 cm-1处是C-H的伸缩振动吸收峰[36],1 650.1 cm-1和1 549.8 cm-1是C=O的不对称和对称伸缩振动吸收峰[37],1 245.0 cm-1为C-O伸缩振动的信号吸收峰,1 000~1 200 cm-1的信号峰表示莲子心多糖中同时存在吡喃糖环和呋喃糖环。在834.3 cm-1处有吸收峰,表明莲子心多糖存在α-糖苷键。和其他三种方法相比,微波提取得到的多糖样品在1 753.2 cm-1处有较为微弱的信号峰,意味着有较多的糖醛酸含量[38]。以上结果表明,不同的提取方法不会影响莲子心多糖的一级结构和糖环的类型。
2.5 扫描电子显微镜分析
扫描电子显微镜(SEM)是一种用于高分辨率微区形貌分析的大型精密仪器。可用来观察蛋白、多糖等生物大分子的表面形貌。采用SEM对不同方法提取得到的莲子心多糖表面形貌特征进行测定,结果如图3所示。PNPHWE呈现出大的块状结构形貌并且表面粗糙。经过UAE提取得到的莲子心多糖PNPUAE形状更为碎片化,部分呈现圆块儿状,且表面光滑,这说明超声辅助提取在破坏细胞结构增加提取率的同时还会对多糖表面形貌带来影响[39,40]。EAE提取得到的莲子心多糖PNPEAE表面形貌和热水浸提得到的莲子心多糖较为相似,能够最大限度的保持原来的表面形貌。MAE提取得到的莲子心多糖PNPMAE仍然呈现片状,但与其他三种方法提取得到的莲子心多糖相比,PNPMAE最大的改变在于表面形貌呈现疏松多孔状。这种疏松多空状结构可能是由于在微波提取过程中提取温度快速升高所导致[41,42],这种多孔状结构可能会导致莲子心多糖暴露出更多活性基团,从而使得其具有较好的生物活性。

图3 不同提取方法对应莲子心多糖的表面形态Fig.3 Surface Morphology of PNP prepared by different methods
2.6 圆二光谱分析
圆二色光谱是用于推断非对称分子的构型和构象的一种旋光光谱,常用于蛋白质、核酸、多糖等生物大分子的分析。多糖的圆二色性与其糖苷键类型、空间结构及基团相互作用等有关[43]。因此,可以通过对比圆二光谱图来评估不同提取方法对莲子心多糖的影响。如图4所示,在190~260 nm范围内,PNPHWE、PNPUAE、PNPEAE、PNPMAE的圆二色谱表现出相似的趋势。PNPHWE在208和222 nm附近表现出负的科顿效应,超声辅助和微波辅助提取使得圆二色谱信号发生一定程度的蓝移并且信号强度有所增强。而酶辅助提取法使得莲子心多糖发生明显红移,并且在 208 nm附近的信号明显减弱,222 nm附近的信号有所增强。科顿效应位置和强度的改变与样品中不对称结构及其程度有关,这说明不同种提取方法对莲子心多糖的空间结构会有一定的影响[44,45]。
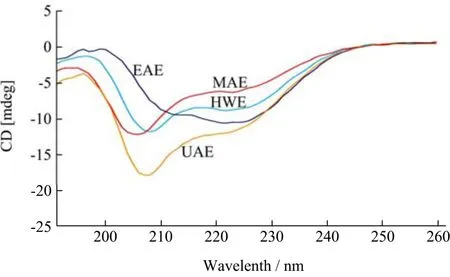
图4 不同提取方法得到的莲子心多糖的圆二色谱图Fig.4 CD spectrum of PNP obtained by different methods
2.7 热稳定性分析
多糖的热稳定性会影响其在食品工业的应用,利用TG、DTG和DSC对莲子心多糖的热稳定性进行分析,结果见图5和表3。如图5所示,根据TG曲线,四种样品的第一次的质量变化主要是由于样品中结合水的失去所导致的,由此可得出四种样品结合水的含量分别为:PNPHWE14.37%,PNPUAE11.56%,PNPEAE12.38%,PNPMAE13.75%。而之后的失重变化是由于样品多糖的解聚和裂解所导致,包括C-C、C-O键的断裂等,从而生成CO、CO2和H2O,并最终形成多核芳香族和石墨碳结构。根据DSC曲线:四种样品均具有两个吸热峰,根据主要吸热峰的ΔH值排序PNPMAE(54.89 J/g)>PNPHWE(49.28 J/g)>PNPUAE(39.35 J/g)>PNPEAE(38.95 J/g),可见,微波辅助提取得到的莲子心多糖有更高的热稳定性,与DTG得到的结果一致。

图5 不同提取方法得到的莲子心多糖的TG-DSC分析结果Fig.5 TG-DSC analysis of PNP prepared by different methods
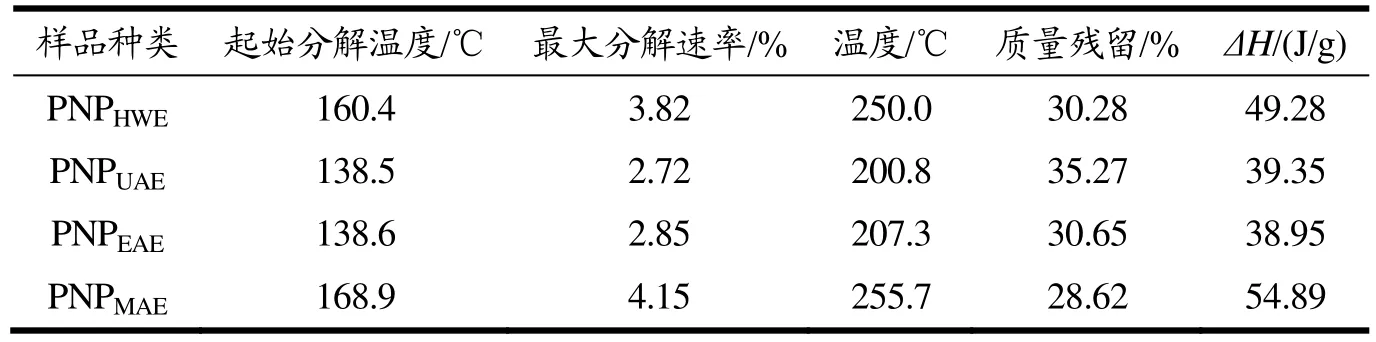
表3 不同提取方法得到的莲子心多糖的TG/DTG/DSC结果Table 3 TG/DTG/DSC results of PNP prepared by different methods
微波辅助提取方法得到的莲子心多糖稳定性最好,超声和酶解处理会导致莲子心多糖稳定性有所下降。总而言之,所有四种方法得到的莲子心多糖都具有较好的热稳定性。可以满足其在食品、化妆品、医药等领域的生产应用。
2.8 流变性质分析
分别测定了不同剪切速率和不同温度对不同提取方法得到的莲子心多糖表观粘度的影响,如图6所示,PNPHWE、PNPUAE、PNPEAE和 PNPMAE溶液均表现出典型的剪切稀化行为。样品溶液的表观粘度随剪切速率的增加而降低。另外,热水浸提、超声辅助提取和酶辅助提取表现出相似的表观粘度,而微波辅助提取得到的莲子心多糖相比其他三种方法有更高的表观粘度,说明微波辅助提取会增加莲子心多糖溶液的表观粘度,但并不会改变其剪切稀化行为。这种表观粘度的增加可能和 PNPMAE大分子量组分的含量较高有关,有很多研究表明较大分子量的多糖有更高的表观粘度,如 Yang等[46]的研究发现超声降低黑醋栗多糖分子量后,其表观粘度也随之降低。Nie等[47]从不同品种的黄秋葵中提取得到不同分子量的多糖,发现其表观粘度随着分子量的增加逐渐增强。

图6 不同提取方法得到的莲子心多糖的稳态流动剪切曲线Fig.6 Steady shear flow curves of PNP obtained by different methods
动态流变学特性的测定,莲子心多糖溶液的动态振荡剪切测试结果可以通过振动试验来确定,如图7所示,在0.1~100 rad/s范围内,莲子心多糖样品的G'和G''随扫描频率的增加而不同程度地增加,表明,所有样品均有扫描频率依赖性,结合图8莲子心多糖样品的tanδ值,能够得知四种莲子心多糖样品均表现出液体和固体的特征[21]。在较低的频率下,四种多糖样品的G''模量高于G'模量,即tanδ>1,多糖样品表现出更强的液体粘性;在较高的频率下,四种多糖样品的G'模量高于G''模量,即tanδ<1,多糖样品表现出较强的固体弹性[48]。而当频率达到某个特定值时,两条曲线相交,此时tanδ值为1,交点为交叉频率,交叉频率的值能够反映多糖样品的粘弹性[49]。PNPHWE、PNPUAE、PNPEAE和PNPMAE交叉频率值分别为39.81、37.44、38.46和50.23 rad/s。其中PNPMAE的交叉频率较高,说明其具有较好的成胶性能,这可能和微波提取得到的莲子心多糖有更多大分子量组分有关[48,50]。

图7 不同频率扫描下莲子心多糖的储存模量和损耗模量Fig.7 Frequency sweeps performance for determining the storage modulus G' and loss modulus G″ for PNP prepared by different methods

图8 莲子心多糖的损耗角正切值Fig.8 The tanδ of PNP prepared by different methods
3 结论
本文探究了四种提取方法对莲子心多糖基本性质、分子量分布、单糖组成、红外光谱、SEM、圆二色谱、热力学性质、流变学性质的影响。三种辅助提取方法提高了莲子心多糖的得率,分子量发生不同程度的降解。不同提取方法对莲子心多糖单糖组成的种类和比例也有所影响,三种辅助提取方法增加了半乳糖的含量,而且微波辅助提取法与热水浸提法单糖组成种类相同。通过热力学和流变学分析,可知微波辅助提取方法得到的莲子心多糖有高的热稳定性和更好的流变性能。综上所述,微波辅助提取法具有更高的得率、多糖纯度以及糖醛酸含量,多孔的表面结构、更好的热稳定性以及流变学性能使得其具有更大的食品工业应用潜力。微波辅助提取多糖工艺的优化、分离纯化及其结构特征和生物活性需要进一步探究。
