高链玉米淀粉-不饱和脂肪酸复合物的体外大肠发酵特性及其对肠道菌群的影响规律
2023-02-13徐诗琪周倩雯扶雄黄强张斌
徐诗琪,周倩雯,扶雄,黄强,张斌
(华南理工大学食品科学与工程学院,广东广州 510640)
人类肠道菌群是一种相当复杂的生态系统,约由1013~1014种菌群所构成,维持机体代谢平衡[1]。肠道菌群的形成受宿主和环境因素共同影响,涉及生活环境、食物、用药习惯等,而饮食结构是其中最重要的因素之一[2]。肠道菌群与人类是互利共生的关系:人类为微生物群落提供营养和保护,同时微生物群落也对人类免疫、神经系统调节起到了一定的效果,帮助调节肠道健康[3]。肠道菌群参与生理调节的过程,普遍是基于酵解所产生的有益代谢产物短链脂肪酸(Short Chain Fatty Acids,SCFAs)来实现的。SCFAs通过激活活性物质和神经系统间接影响外部组织和器官,从而在调节宿主代谢、免疫和细胞增殖等功能发挥重要作用[4]。
抗性淀粉(Resistant Starch,RS)是指淀粉和部分淀粉制品在通过胃肠道时,120 min内α-淀粉酶和葡萄糖淀粉酶的消化产生抵抗的部分,但可在大肠中作为底物被结肠菌群完全或部分发酵[5]。目前,RS根据来源和抗性机理的不同,主要分物理包埋淀粉(Type 1 Resistant Starch,RS1)、天然抗性淀粉(Type 2 Resistant Starch,RS2)、老化淀粉(Type 3 Resistant Starch,RS3)、化学改性淀粉(Type 4 Resistant Starch,RS4)和淀粉-脂质复合物(Type 5 Resistant Starch,RS5)等五类,其中RS5是一种新型抗性淀粉,它是由直链淀粉与脂质等配体复合而成的单螺旋结构,具有良好的热稳定性和抗酶解性等特点[6]。抗性淀粉对结肠具有重要作用,能够降低肠道内pH值,促进益生菌增长,产生高浓度的SCFAs以及降低肠道性疾病的发生等生理功能[7]。淀粉和脂质都是人体重要的能量来源和营养物质,它们在人体内具有特定的生理功能,而当淀粉和脂质形成稳定的单螺旋结构后将拥有热稳定性、抗消化性等功能特性和控制肥胖、调节血糖、调控肠道菌群等营养特性[8-10]。例如,Annor等[11]通过测定血糖生成指数,发现小米淀粉与棕榈酸、油酸和亚油酸形成的复合物血糖生成指数显著低于小米淀粉。目前,已有大量研究报道了淀粉-脂质复合物的形成机理、结构和功能特性(如糊化、粘弹性和消化)[9,12,13],但研究多局限于 RS5的制备方法、加工特性等问题。鉴于淀粉和脂肪的种类丰富、结构多样化,而不饱和脂肪酸被认为具有重要的营养价值,对于维持人类健康、预防脂质相关疾病和发育至关重要,因此将不饱和脂肪酸与淀粉进行复合后能否产生更多协同效应,将是值得探讨的关注点。另一方面,不饱和脂肪酸的复合物的体外发酵特性以及微生物结构的变化等方面的研究仍未够深入,特别是不同特定结构的RS5之间发酵特性的比较。
本文选用高直链玉米淀粉和饮食中各种常见的脂肪酸即硬脂酸、油酸、亚油酸和亚麻酸作为原料,采用碱液分散法得到不同饱和度的淀粉-脂肪酸复合物。采用X射线衍射(X-Ray Diffraction,XRD)、差示扫描量热仪(Differential Scanning Calorimeter,DSC)等表征手段和测定样本的复合率和含量对样品结构进行解析。利用体外大肠发酵实验和16S rRNA基因测序,揭示样品的发酵特性和菌群结构变化。本文旨在明确RS5的发酵特性与微生物反应同复合物的脂肪酸饱和度之间的关系,为针对性开发益生元产品和以淀粉为基础的功能性食品配料提供了新的可能。
1 材料与方法
1.1 材料
高直链玉米淀粉(HylonⅤ),美国Ingredion公司;低聚果糖,美国Ingredion公司;亚油酸、亚麻酸、猪胰α淀粉酶(EC号:232-468-9;活性:8×USP/mg)、淀粉转葡萄糖苷酶(EC号:3.2.1.3(BRENDA,IUBMB);活性:≥260 units/mL),美国Sigma-Aldrich公司;硬脂酸,阿拉丁化学试剂公司;油酸,阿拉丁化学试剂公司;其他试剂或药品均为分析纯。
1.2 主要仪器与设备
HYQX-Ⅱ型厌氧箱,上海跃进医疗器械公司;MR-Hei-Tec型加热型磁力搅拌器,德国Heidoiph公司;LDZH-100KBS型立式压力蒸汽灭菌锅,上海申安医疗器械公司;DL-5-B型离心机,上海安亭科学仪器公司;FE20型数显pH计,瑞士梅特勒-托利多仪器有限公司;DSC3型差示扫描量热仪,瑞士梅特勒-托利多仪器有限公司;D/Max-1200型X-射线衍射分析仪,日本Rigaku公司;DYY-6C型电泳仪,北京六仪公司;2720型PCR扩增仪,美国应用生物系统公司;E6090型TBS-380荧光计,北京原平皓生物技术有限公司;NanoDrop-ND-1000分光光度计,美国赛默飞公司;2100生物分析仪,美国安捷伦公司;Illumina PE250型NovaSeq高通量测序仪,美国Illumina公司。
1.3 实验方法
1.3.1 淀粉-不饱和脂肪酸复合物制备
本文制备淀粉-不饱和脂肪酸复合物的方法参考Karkalas等[14]方法进行修改。将6 g高直链淀粉玉米淀粉溶于400 mL 0.1 mol/L的KOH溶液,在300 r/min下恒定搅拌至充分溶解,然后将温度快速升高到90 ℃保持1 h得到糊化淀粉。同样,将0.6 g脂肪酸溶解于600 mL 0.1 mol/L的KOH溶液,在90 ℃加热并持续搅拌至完全溶解。在 90 ℃下将脂肪酸与淀粉溶液混合均匀并充分搅拌30 min,用2.0 mol/L的HCl溶液将混合溶液的pH值调至4.6~4.7,维持90 ℃继续加热1 h,冷却至室温,在3 000 r/min下离心15 min得到的沉淀即为淀粉-不饱和脂肪酸复合物。将所得的沉淀物冷冻干燥48 h得到样品,粉碎过筛,置于冰箱中密封保存。对照组除了不加脂肪酸外,其余处理步骤一致。样品分别命名为HAMS,高直链玉米淀粉;GS,糊化淀粉;GS-SA,淀粉-硬脂酸复合物;GS-OA,淀粉-油酸复合物;GS-LA,淀粉-亚油酸复合物;GS-ALA,淀粉-亚麻酸复合物;SA,硬脂酸;OA,油酸;LA,亚油酸;ALA,亚麻酸。
1.3.2 X-射线衍射测定
将待测样品平衡水分,随后平铺于样品池中过夜,然后放入XRD仪的样品台中进行测试。测试条件为波长0.154 0 nm、测试管电压40 kV、电流30 mA。扫描的区域为 4~30 °2θ、扫描速度 2 °/min。通过对比图谱,确定淀粉颗粒结晶性质。相对结晶度计算方法参照Nara等[15]提出的方法计算,通过Jade软件对结晶区域和总面积部分分别进行积分计算,所得比值即为相对结晶度(Relative Crystallinity,RC)。

式中:
Ac——结晶区域面积;
Aa——非结晶区域面积。
1.3.3 热力学性质测定
准确称取3 mg淀粉干基与去离子水均匀混合成水分含量为70%的混合物,密封高压盘,在室温下平衡过夜后,用DSC检测样品,扫描温度为30~140 ℃,扫描速率为10 ℃/min[16]。用STARe软件分别计算热力学曲线中的起始温度(To)、峰值温度(Tp)、终止温度(Tc)和焓值(ΔH)。
1.3.4 复合指数测定
采用Jia等[17]的方法测定样品的复合指数,用CI值表示淀粉-脂质复合物的形成程度。准确称取淀粉干基300 mg,悬浮于5 mL去离子水中,在沸水浴中加热搅拌30 min,冷却至室温,在2 000 r/min下离心8 min,取50 μL上清液与2 ml含有m=1.3% I2和m=2%KI的碘溶液进行混合。用紫外-可见分光光度计在690 nm处测定配合物和对照物的吸光度并用下式计算:

式中:
ABSreference——原淀粉吸光值;
ABSsample——样品吸光值。
1.3.5 抗性淀粉含量测定
抗性淀粉含量测定参照Xie等[18]的体外模拟小肠消化方法。准确称取0.6 g淀粉样品干基于50 mL离心管中,分别加入20 mL 0.1 mol/L的醋酸钠缓冲液和磁子,涡旋混匀后置于37 ℃磁力搅拌水浴锅中震荡。加入5 mL猪胰酶和淀粉葡萄糖苷酶的混合酶解液后开始计时。在反应2 h后,从每个试管中各取0.25 mL上清液与10 mLφ=66%的乙醇混合停止酶解反应。于4 300 r/min下离心5 min,取0.1 mL上清液与3 mL的GOPOD混合均匀,测定510 nm处吸光值,具体计算方法如下:

式中:
RS——抗性淀粉含量,%;
G120——酶水解2 h后产生的葡萄糖含量,%;
TG——样品总葡萄糖含量,%。
1.3.6 体外大肠发酵实验
体外大肠发酵实验参考相关文献[18-20]。制备微量元素溶液和碳酸-磷酸缓冲液,并在使用前灭菌。将0.25 g/L的半胱氨酸酸加入到碳酸-磷酸缓冲液中,通入CO2气流去除氧气。准确称取每个时间点的发酵样品50 mg于厌氧瓶中,然后将各厌氧瓶和碳酸-磷酸缓冲液转移到厌氧培养箱中过夜。实验以低聚果糖(Fructooligosaccharide,FOS)作为阳性对照,以HAMS、GS和SA、OA、LA、ALA作为阴性对照。
体外发酵实验已获得广州市第一人民医院(华南理工大学第二附属医院)伦理委员会批准(批准号为K-2021-085-01),征得3名志愿者的知情同意。于发酵试验当天收集粪便到无菌离心管中,并立即转移至厌氧培养箱中备用。志愿者必须满足以下条件:(1)年龄在20~25岁,BMI值处于正常范围(18.5~23.9 kg/m2);(2)身体健康,无胃肠道方面的疾病;(3)试验前两周内没有服用任何含益生菌的产品,试验前三个月内没有服用任何含抗生素的药物。包含新鲜粪便样本的无菌管迅速转移置厌氧培养箱中,将三名志愿者的粪便与碳酸-磷酸缓冲液按1:3的比例混合均匀,然后过滤得到菌液。在每个厌氧瓶中加入4 mL碳酸-磷酸缓冲液和1 mL菌液,然后用橡胶塞和铝盖密封。在37 ℃水浴中发酵4、8、12和24 h后,立即取出相应的厌氧瓶,用带有刻度的注射器测量产气量。收集发酵后的上清液进行短链脂肪酸分析、沉淀物进行16S rRNA基因测序,所有上清液和沉淀物均保存在-80 ℃以作进一步分析。
1.3.7 短链脂肪酸含量测定
短链脂肪酸的产量参考Wang等[21]的方法,使用气相色谱仪测定。将不同发酵时间点的样品以12 000 r/min转速离心10 min,分离得到上清液。以4-甲基戊酸配制内标混合物,将200 μL的内标混合物加入至800 μL的上清液中,混合均匀,注入气相色谱仪。样品中的短链脂肪酸通过毛细管柱(Zebron,ZB-FFAP,30 m×0.25 mm×0.25 μm)和氢离子火焰检测器,在流速为1 mL/min的氮气中分离后测定浓度。具体条件为:分流比 10:1,进样器和检测器温度为230 ℃,初始柱温为80 ℃,以8 ℃/min升温至192 ℃,保持3 min。程序结束后,记录出峰面积,通过校正内标的峰面积对样品中的目标短链脂肪酸进行定量计算。
1.3.8 DNA的提取与序列分析
使用QIAamp® DNA试剂盒,从不同时间点的酵解样品中提取DNA,并在-20 ℃下保存用于测序分析。对DNA进行定量,以及琼脂糖凝胶电泳检测DNA的提取质量。随后对纯化合格的DNA样本,添加样本特异性 Barcode序列,使用正向和反向引物对细菌16S rRNA V3-V4区进行聚合酶链式反应扩增,并对扩增产物进行荧光定量。按照每个样本的测序量需求,汇聚等量的扩增子,对各样本按相应比例进行混合,采用Illumina公司的MiSeq测序仪进行高通量双端测序,对应试剂盒为MiSeq Reagent Kit V3。
1.3.9 16 S rRNA基因序列分析
采用DADA2方法对序列进行去噪,并以100%的相似度去重、聚类得到ASVs序列。依据Greengenes数据库和Classify-sklearn算法对每个ASV进行物种注释,并借助基因云平台进行数据可视化和绘制(https://www.genescloud.cn/login)。
1.3.10 数据统计与分析
实验结果用均值±标准差表示。采用单因素方差分析和Turkey’s多重检测综合评价试验组之间的差异,采用p<0.05为有统计学意义。实验数据均采用GraphPad Prism 7.0版本进行作图和SPSS 20.0版本进行统计学分析。
2 结果与讨论
2.1 X-射线衍射分析
通过X-射线衍射手段分析HAMS和饱和度不同的淀粉-脂质复合物的结晶特性,结果如图1所示。HAMS 在 5.6°、17.1°、22.1°和 24.0 °处均有特征峰出现,表明HAMS是典型的B型结晶结构[22,23],而样品GS的B型结晶特征峰显著减弱,仅在17.1°和20.0°处出现微弱的特征峰。高链玉米淀粉-不饱和脂肪酸复合物在图中7.3°、13.1°和20.0°处均出现了特征峰,这是V型结晶结构特有的特征峰的出现位置。有文献报道认为环境中的客体分子能够通过疏水相互作用力进入到单螺旋淀粉链的疏水性空腔中形成具有稳定结构的淀粉V型结晶[24],从图中也证实了淀粉单螺旋和几种脂肪酸成功复合并形成了相应的复合物。但是除GS-OA外,随着脂肪酸不饱和度增加,V型特征峰逐渐减弱,呈现GS-SA>GS-LA>GS-ALA的趋势。此外,GS-SA在21.6°和24.1°均出现了较为尖锐的特征峰,这是未被洗脱的游离脂肪酸的特征峰,由于不饱和脂肪酸常温下是液态,容易被φ=50%的乙醇溶液冲洗干净,而中长链饱和脂肪酸在常温下是固态,分散性较差,在常温下难以被φ=50%的乙醇溶液洗脱完全,因此出现了尖锐的脂肪酸特征峰[25]。
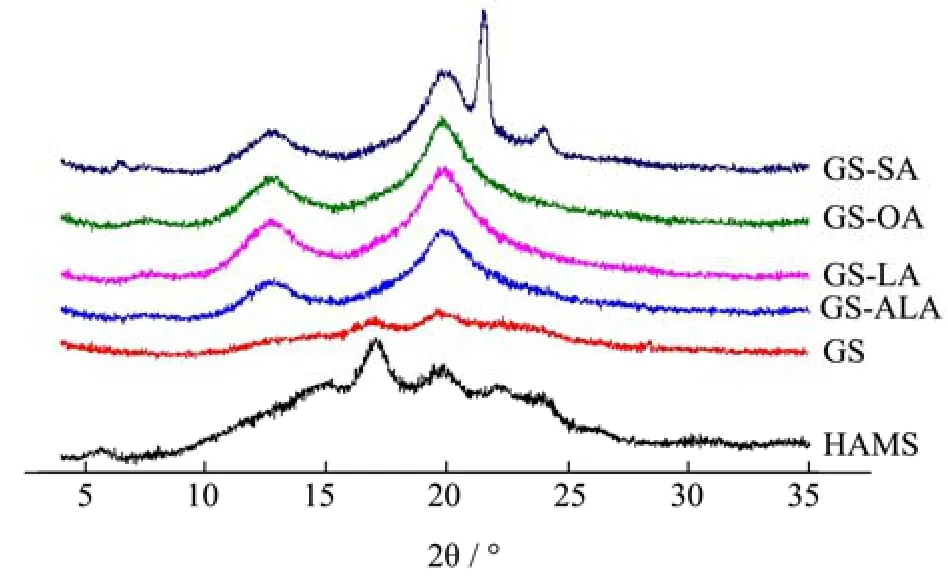
图1 淀粉-不饱和脂肪酸复合物的X-射线衍射图谱Fig.1 X- ray diffraction pattern of starch-unsaturated fatty acid complex
高链玉米淀粉-不饱和脂肪酸复合物和HAMS的V型、B型结晶的含量及总结晶度如表1所示。XRD图谱中特征峰的尖锐程度和强度可以表明样品复合程度的大小,通过Jade软件对XRD图谱中的结晶峰进行积分,发现GS-OA的V型结晶含量最高34.87%,其次是GS-SA为32.43%、GS-LA为32.93%、GS-ALA为30.42%。此结果与先前的文献报道一致,当脂肪酸碳链长度相同时,不饱和脂肪酸的分散性优于饱和脂肪酸,而含有一个不饱和双键的油酸比含有两个不饱和双键的亚油酸和亚麻酸产生的空间位阻更少[26],因此当链长相同时,淀粉与单不饱和脂肪酸最容易形成复合物,其次是饱和脂肪酸,最后才是多不饱和脂肪酸。另一方面,样品GS-SA的总结晶度为38.73%。总结晶度计算包括了B型、V型结晶和游离脂肪酸在内,由于长链脂肪酸在常温下是固态难以洗脱,因此GS-SA的总结晶度计算中有一部分是未由洗脱的脂肪酸产生的。

表1 淀粉-不饱和脂肪酸复合物中V型、B型结晶的含量及总结晶度(%)Table 1 V-type, B-type and total crystallinity for starch-unsaturated fatty acidcomplex
2.2 热力学性质分析
通过DSC进行高链玉米淀粉-不饱和脂肪酸的热力学性质分析,结果如表2所示。样品GS-SA有两个吸热峰,其中,第一个峰代表未和淀粉发生复合且没被洗脱掉的硬脂酸,第二个峰代表淀粉-硬脂酸复合物。同样地,Zhang等[27]对高直链玉米淀粉与月桂酸的复合物进行DSC分析,也发现了第一个峰出现了未洗脱的月桂酸。淀粉与油酸、亚油酸、亚麻酸形成的复合物未出现脂肪酸吸热峰,因为常温下不饱和脂肪酸为液态,容易洗脱完全。淀粉与油酸、亚油酸、亚麻酸形成的复合物未出现脂肪酸吸热峰,因为常温下不饱和脂肪酸为液态,容易洗脱完全。此外,这三个样品都只出现了一个复合物吸热峰,且温度大概在91~114 ℃范围内,这是由于为避免不饱和脂肪酸氧化分解,采用复合温度较低的碱液分散法进行淀粉和脂肪酸的复合,因此形成的复合物也主要为较低温度下形成的 I型复合物,而结构更加紧密的Ⅱ型复合物则需要在高温长时间加热的环境下才能形成[28,29]。当淀粉与不同饱和度的脂肪酸复合后,随着不饱和度的增加,To、Tp、Tc逐渐降低。据文献报道,这可能是由于不饱和脂肪酸的双键构成空间阻力,削弱了化合物的结构稳定性,且不饱和双键数量越多稳定性越差[29]。淀粉-油酸复合物的焓值略高于淀粉-硬脂酸复合物,推测是因为单不饱和脂肪酸油酸在常温下是液态且分散性好,更利于形成复合物。但随着不饱和度的增加,GS-LA和GS-ALA的ΔH逐渐降低,虽然亚油酸和亚麻酸常温下同为液态易分散于溶液中,但因为不饱和键的增多导致其空间位阻变大并阻碍复合物的形成[30],这点与上述XRD结果一致。
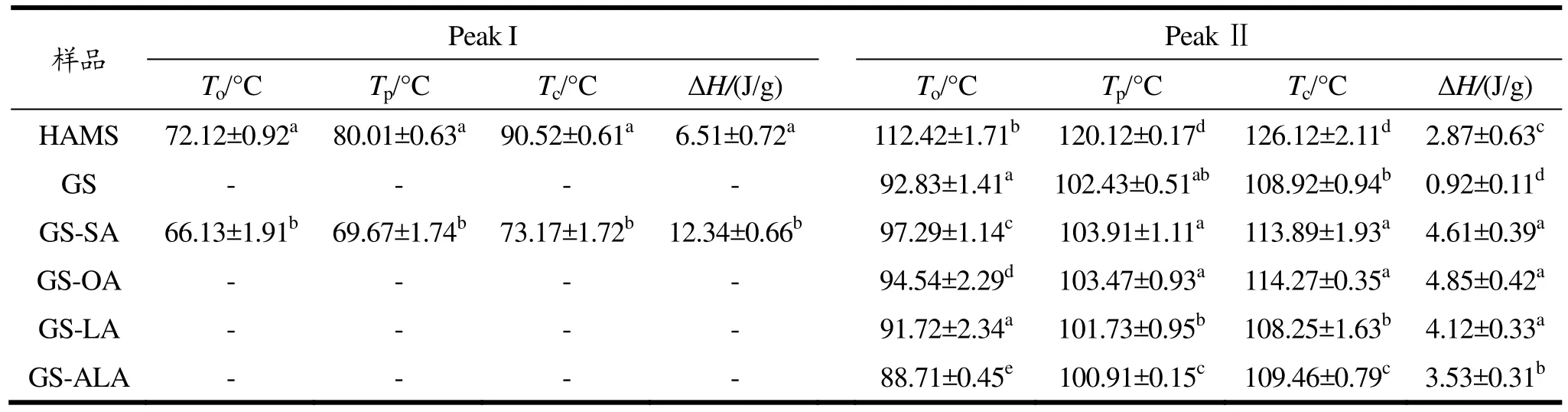
表2 淀粉-不饱和脂肪酸复合物的热力学性质Table 2 Thermodynamic properties of starch-unsaturated fatty acid complex
2.3 复合指数和抗性淀粉含量分析
表3展示了高链玉米淀粉-不饱和脂肪酸复合物的复合指数CI值。CI值表征的是淀粉对碘结合能力的降低程度,它测量游离淀粉的可用性,并间接测量已整合到复合物中的脂肪酸的数量。在相同处理条件下,复合指数呈现样品 GS-OA>GS-SA>GS-LA>GS-ALA的规律,这是因为油酸分散性更好,容易扩散到直链淀粉的疏水空腔内形成复合物,但由于其含有一个不饱和双键,而不饱和双键的存在会增加立体障碍造成空间位阻,对其进入淀粉的螺旋内部造成一定的困难,进而导致形成的复合物效果较差,因此CI值仅略高于样品GS-SA[27]。已有报道证明,随着淀粉双螺旋数量的增加,空间位阻变大,形成的复合物越少,因此CI值也逐渐降低[26]。

表3 淀粉-不饱和脂肪酸复合物的复合指数及抗性淀粉含量Table 3 CI and RS value of starch-unsaturated fatty acid complex
未经加工处理的HAMS是一种典型的RS2,具有较高的抗酶解特性,其RS含量为62.41%。然而,糊化后的样品GS抗性淀粉含量大大降低,仅约28.79%,可能是糊化后,淀粉致密的结构被大量破坏,生成了许多直链淀粉单螺旋,导致RS含量大大降低,但仍存在28.79%左右的抗性淀粉,是因为在冷却过程中,淀粉单螺旋结构重结晶形成了老化淀粉,这与图1的XRD结果一致,GS样品仅在B型结晶特征峰处出现了较微弱的特征峰。高链玉米淀粉-不饱和脂肪酸复合物中脂肪酸的加入,在一定程度上降低了淀粉单螺旋重结晶,并形成了V型晶体和增加疏水性。这些物理变化的协同作用降低了高链玉米淀粉-不饱和脂肪酸复合物的酶催化作用,因此具有较高的抗酶解特性,具体 RS含量的顺序为 GS-OA>GS-SA>GS-LA>GS-ALA,且实验结果表明RS含量与CI值密切相关[26]。
2.4 体外大肠发酵产气量
高链玉米淀粉-不饱和脂肪酸复合物体外大肠发酵产气量如图2所示。阳性对照FOS在整个发酵过程中显示出最高的发酵速率,与文献报道一致,但过快的发酵速率容易导致胀气等不适症状[31]。与FOS相比,HAMS在整个发酵过程中具有缓慢的发酵速率。而与FOS相比,高链玉米淀粉-不饱和脂肪酸复合物样品GS-SA、GS-OS、GS-LA、GS-ALA 在整个过程的发酵速率都较为缓慢,但彼此间无显著性差异(p>0.05),复合物在发酵终点时的产气量基本一致(13.8~14.2 mL),因此推断,高链玉米淀粉-不饱和脂肪酸复合物能够降低发酵速率,缓慢并稳定地释放发酵产物,但其产气特性与复合物中的脂肪酸饱和度无关。此外,膳食纤维在结肠微生物酵解的过程中,主要产生氢气、甲烷、二氧化碳等气体。其中二氧化碳能由所有细胞产生,但只有细菌可以通过代谢产生氢气和二氧化碳,因此总气体产量可以作为膳食纤维发酵速率的反映并表征微生物群的活跃性[32]。Candido等[33]的研究发现肠道微生物几乎不能在厌氧的环境中分解利用游离脂肪酸。脂肪酸样品SA、OA、LA、ALA在整个发酵过程中产气量都很低,这意味着脂肪酸难以被微生物分解利用。这些结果表明与FOS这类快速发酵的益生元相比,RS5具有缓慢发酵的特性,但这种特性与复合物中的脂肪酸饱和度联系不大。

图2 淀粉-不饱和脂肪酸复合物进行24 h体外发酵过程中产气量情况(mL/50 mg碳水化合物)Fig.2 Gas production (mL/50 mg carbohydrate) during in vitro fecal fermentation time course
2.5 短链脂肪酸产量和组成
短链脂肪酸是肠道菌群发酵的主要有益代谢产物,乙酸、丙酸和丁酸具有各自不同的作用,短链脂肪酸的产量也常被用作判断膳食纤维发挥益生作用的功能指标之一[34]。高链玉米淀粉-不饱和脂肪酸复合物的乙酸、丙酸和丁酸产量如图3a~3c所示。本文以FOS作为阳性对照,以HAMS、GS和SA、OA、LA、ALA作为阴性对照。FOS在发酵各时间点的乙酸和丙酸的浓度最高。与FOS相比,HAMS和GS在整个发酵过程中乙酸和丙酸的产量较低。发酵终点时,HAMS产生了 22.42 mmol/L的丁酸,这与之前报道的结果一致[35]。发酵终点时,高链玉米淀粉-不饱和脂肪酸复合物 GS-SA、GS-OA、GS-LA、GS-ALA 产生 60.25~63.73 mmol/L的乙酸和21.22~24.81 mmol/L的丙酸,均高于样品HAMS和GS,说明在淀粉中引入脂肪酸能够提高发酵过程中部分SCFAs的产量,尤其是乙酸和丙酸。而各种脂肪酸在发酵终点的总酸产量基本一致,这可能是由于在厌氧环境中脂肪酸难以被微生物分解,因此肠道中发酵产生的 SCFAs含量很低[33]。图3d为体外粪便发酵过程中高链玉米淀粉-不饱和脂肪酸复合物的总酸产量。FOS在发酵前12 h的产酸速率最快并且在整个发酵过程中的总酸产量最高。高链玉米淀粉-不饱和脂肪酸复合物的总酸产量均高于样品HAMS和GS,但是高链玉米淀粉-不饱和脂肪酸复合物之间产酸含量差异不显著,进一步说明复合物中的脂肪酸饱和度不是影响短链脂肪酸产量的关键因素。

图3 淀粉-不饱和脂肪酸复合物在发酵不同时间点的乙酸(a)、丙酸(b)、丁酸(c)及总酸(d)浓度Fig.3 Acetate (a), propionate (b), butyrate (c) and total SCFA (d) concentration produced during in vitro fecal fermentation
2.6 肠道菌群物种丰度变化
通过16S rRNA测序,在门水平和属水平上进一步研究了发酵终点的肠道微生物群落的相对丰度,其中门水平上结果如图4a所示。与空白相比,HAMS和 GS促进了 Bacteroidetes的相对丰度,抑制了Firmicutes的相对丰度。高链玉米淀粉-不饱和脂肪酸复合物随着复合物中脂肪酸不饱和度的增加,Bacteroidetes的相对丰度不断增加。而所有的脂肪酸样品均提高了 Proteobacteria的相对丰度。有报道称Proteobacteria相对丰度升高可能与肠道炎症性疾病有关[36],这说明所有的脂肪酸样品具有潜在的不良效果,可能会引起机体的肠道方面的疾病。在发酵结束时,高链玉米淀粉-不饱和脂肪酸复合物对Bacteroidetes和Firmicutes的丰度表现出不同的影响。具体而言,样品GS-SA在门水平上的发酵特性与GS最为接近,这表明GS与GS-SA的发酵特性最为相似,而GS-OA,GS-LA和GS-ALA的Bacteroidetes丰度均比GS-SA和GS高,可能与丙酸浓度有关[37]。
样品在属水平上的变化如图4b所示。与空白相比,FOS显著促进Prevotella和Bacteroides的相对丰度,抑制了Roseburia、Faecalibacterium、Blautia、unidentifiedRuminococcus和Dialister的生长。研究表明Bacteroides能够通过一系列糖苷水解酶和碳水化合物代谢途径产生丰富的乙酸和丙酸[37],这与前面FOS显著提高乙酸和丙酸浓度的结果一致(图3a~3b)。与空白相比,HAMS和 GS显著提高了Prevotella和Bacteroides的相对丰度;与FOS相比,HAMS和GS明显增加了Roseburia和unidentifiedLachnospiraceae,这与前面 SCFAs数据(图3c)一致。Roseburia和Lachnospiraceae具有良好的产丁酸效应,能有效增强肠道屏障功能,进一步改善结肠相关的疾病[38,39]。值得注意的是,高链玉米淀粉-不饱和脂肪酸复合物显著促进了Prevotella的增加,并且随着脂肪酸不饱和度的增加,Prevotella的相对丰度逐渐升高。据相关研究,Prevotella能够促进多糖降解从而实现高乙酸和丙酸的产量[40],这与前文高链玉米淀粉-不饱和脂肪酸复合物产乙酸(图3a)数据一致。与空白相比,样品SA、OA、LA 均显著促进了Faecalibacterium、Blautia、unidentifiedRuminococcus和Oscillospira的相对丰度,样品ALA显著促进的Bacteroides的生长,其中样品SA还促进了Prevotella相对丰度的增加。

图4 淀粉-不饱和脂肪酸复合物经体外粪便发酵24 h后肠道菌群门水平(a)和属水平(b)物种丰度变化Fig.4 Phylum level (a) andgenus level (b) of starch-unsaturated fatty acid complex after 24 h in vitro fecal fermentation
为了进一步比较样品之间的物种组成差异,可以突出样品种物种丰度分布的趋势,对样品中平均丰度大于6 000的ASVs进行丰度分析,根据类群间的相关性绘制了聚类热图(图5),二维空间的长度大于描述符的平衡圆半径的ASVs列为关键ASVs,并以绿色标注,关键ASVs将在决定细菌群落结构起到至关重要作用的ASVs。从图中可以看到,FOS明显促进了12种ASVs的相对丰度。与空白相比,GS-OA、GS-LA、GS-ALA均能够促进12种ASVs(ASV23395、ASV17067、ASV6097、ASV8028、ASV295、ASV10495、ASV13556、ASV7621、ASV5458、ASV14314、ASV16282和ASV8140Prevotellacopri)的相对丰度,这与FOS能够促进的菌一致,但GS-SA与GS能够促进的菌群结构更为相似,这意味着淀粉-硬脂酸复合物与所复合的淀粉对菌群调控具有相似作用。研究表明,Prevotellacopri是肠道的常见菌之一,能够将多糖降解为丙酸和琥珀酸,并促进肝糖原的储存[41,42]。样品SA能够促进3种ASVs(ASV14115、ASV17039和ASV14843Faecalibacterium prausnitzii)相对丰度升高。Faecalibacterium prausnitzii是健康成人结肠中最丰富的细菌种类之一,占细菌总数的 5%以上,是人类肠道健康的主要参与者和生物传感器,并且能够生产具有抗炎作用的SCFAs[43]。样品OA能够促进5种ASVs相对丰度升高,其中ASV15724 unidentifiedDialister是厚壁菌门中的一类细菌,常存在于健康人体内[42]。样品 LA 能够促进 ASV15724 unidentifiedDialister和ASV6837 UnidentifiedRoseburia相对丰度的升高,而样品 ALA似乎在促进 ASV14306 UnidentifiedBacteroides生长方面具有突出贡献,这与之前属水平(图4)的结果一致。为淀粉-油酸复合物;GS-LA 为淀粉-亚油酸复合物;GS-ALA 为淀粉-亚麻酸复合物;SA为硬脂酸;OA为油酸;LA为亚油酸;ALA为亚麻酸。热图方块的颜色由蓝变红表示ASV物种丰度由低变高;不同样品的同一ASV物种丰度与空白对照相比的显著性标注,*表示p<0.05;**表示p<0.01;***表示p<0.001。

图5 淀粉-不饱和脂肪酸复合物经体外粪便发酵24 h后肠道菌群ASV水平物种丰度变化Fig.5 Heatmap from 16S rRNA gene sequencing of the starch-unsaturated fatty acid complex after 24 h in vitro fecal fermentation
2.7 肠道菌群结构多样性分析
PCA分析能够确定各样本间微生物群落的结构差异,判断样品间菌群相似度。采用key ASV对发酵24 h后的样品微生物群落进行PCA分析,如图6所示。两个主轴表示了样本间88.7%的总方差(PC1:66.2%,PC2:22.5%),这说明样品间的微生物结构具有显著差异。发酵结束时,对照组与复合物组之间存在显著差异。从图中发现ASV10495、ASV16282、ASV17067、ASV8104Prevotellacopri与样品GS-SA、GS-OA、GS-LA、GS-ALA、HAMS、DS之间显著相关,由于Prevotellacopri能促进丙酸的产生,这种显著相关可能与前面测定高浓度的丙酸产生有关[40,41]。另外,样品 SA、OA、LA 与空白发生了聚类现象,促进 ASV14843、ASV17039Faecalibacterium prausnitzii的相对丰度的增加,与高链玉米淀粉-不饱和脂肪酸复合物相比,这几种脂肪酸对菌群构成的影响较小,对菌群的调控作用不显著。值得注意的是,样品ALA作为一种不饱和脂肪酸对菌群的影响十分特殊,与前面所述的三种脂肪酸样品不同的是,样品ALA能够促进ASV14306 UnidentifiedBacteroides和ASV19479 UnidentifiedFusobacterium的增加,这与热图(图5)的结果一致。LA为亚油酸;ALA为亚麻酸。

图6 淀粉-不饱和脂肪酸复合物经体外粪便发酵24 h后肠道菌群ASV水平的主成分分析结果Fig.6 PCA from 16S rRNA gene sequencing of the starch-unsaturated fatty acid complex after 24 h in vitro fecal fermentation
3 结论
本文利用碱液分散法,使用四种饱和度不同的脂肪酸为原料,制备了四种淀粉-不饱和脂肪酸复合物,并通过体外批式发酵模型探究了复合物的体外发酵产气量、短链脂肪酸产量及菌群丰度的变化。通过结构表征,发现除淀粉-油酸复合物以外,随着脂肪酸不饱和度增加,淀粉与各脂肪酸复合程度逐渐降低。在体外发酵过程中,高链玉米淀粉-不饱和脂肪酸复合物具有相似的发酵速率但彼此间无显著性差异(p>0.05),表明脂肪酸的饱和度并不是控制总体发酵速率的关键因素。发酵结束时高链玉米淀粉-不饱和脂肪酸产生的乙酸和丙酸浓度,均高于样品HAMS和GS,说明在淀粉中引入各种脂肪酸能够提高发酵过程中部分SCFAs的产量,尤其是乙酸和丙酸,但其产量在各复合物之间无显著性差异(p>0.05)。通过 16S rRNA测序发现高链玉米淀粉-不饱和脂肪酸复合物与HAMS和 GS的菌群结构更为相似,且明显促进了Prevotella的相对丰度,这可能与淀粉类样品能够显著促进丙酸浓度有关。本研究发现高链玉米淀粉-不饱和脂肪酸复合物作为RS5的一种,具有调节发酵代谢产物和肠道微生物构成以及改善结肠健康的潜力。本实验为定向设计促进肠道健康的食品配料提供了理论支撑。
