垂体功能减退症合并肝硬化临床特征研究
2023-02-11时学秀贠文晶王海旭赵颖颖杨亚楠孙同文
时学秀,贠文晶,王海旭,赵颖颖,杨亚楠,孙同文*
腺垂体功能减退症是指某种原因导致垂体前叶激素分泌减少而出现的一组症候群,与中枢性尿崩症同时存在时称为全垂体功能减退症,轻度的正细胞性贫血是其最常见的血液系统表现[1],白细胞和血小板同时减少的情况较为少见。非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指除外酒精和其他明确肝损伤因素所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床综合征,疾病谱包括单纯性肝脂肪变、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝硬化和肝细胞肝癌。垂体功能减退时NAFLD的发病风险增加,合并肝硬化时可能继发脾功能亢进导致三系血细胞减少。本研究对近年收治的8例垂体功能减退症合并肝硬化患者的临床资料进行回顾性分析,以提高临床医师对该类疾病的认识。
1 资料与方法
1.1 临床资料 回顾性分析2010年1月至2021年12月郑州大学第一附属医院收治的8例垂体功能减退症合并肝硬化患者的临床资料。入组标准:(1)有不同程度的垂体功能低下临床表现和/或鞍区疾病史,垂体-靶腺轴激素检测明确存在1项或多项腺垂体激素分泌功能低下;(2)临床或病理诊断为肝硬化。排除标准:肝硬化原因明确和原发血液系统疾病患者。本研究获得郑州大学第一附属医院伦理委员会批准(编号:2022-KY-0229-002),患者均知情同意。
1.2 方法 总结所有患者的临床表现、实验室及影像学检查结果、治疗方法及随访结果。
1.3 统计学方法 采用SPSS 21.0软件对数据进行统计分析,正态分布的计量资料以(±s)表示,治疗前后比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 本研究纳入的8例患者中男6例、女2例。诊断垂体功能减退症时年龄为9~20岁,平均年龄12岁;诊断肝硬化时年龄为16~24岁,平均年龄19.9岁;中间相隔时间3~14年,平均时间7.9年,见表1。1例患者为标准体质量,7例患者为腹型肥胖。
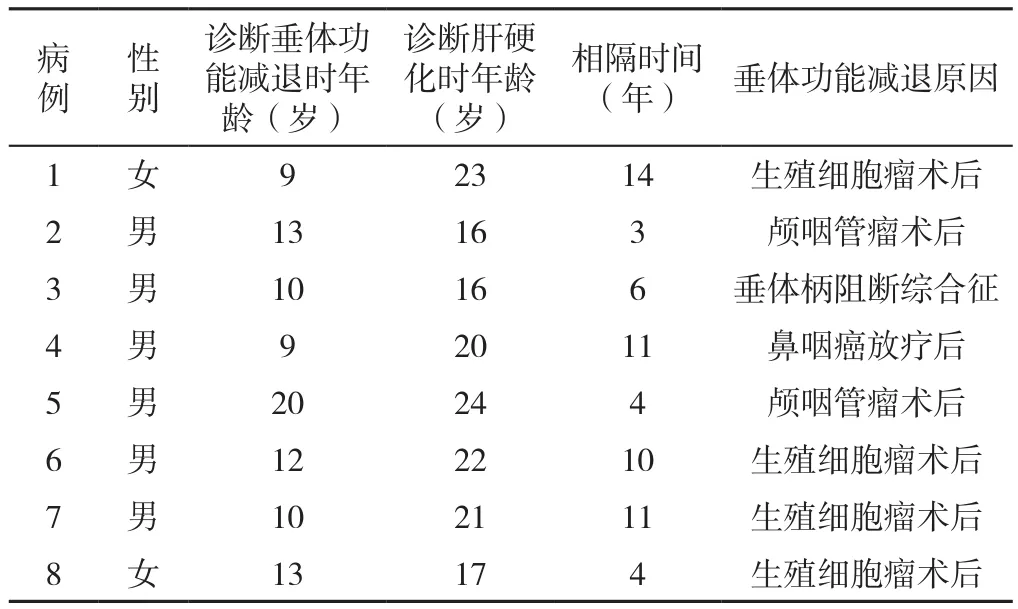
表1 8例垂体功能减退症合并肝硬化患者的临床特征Table 1 Clinical features of 8 cases of hepatic cirrhosis secondary to hypopituitarism
2.2 发病原因及诊断 发病原因:生殖细胞瘤手术史4例、颅咽管瘤手术史2例、鼻咽癌放疗后1例、垂体柄阻断综合征1例;腺垂体功能减退症1例、全垂体功能减退症7例。诊断:肝脏活检证实为肝硬化2例、影像学诊断肝硬化6例。
2.3 临床表现及合并症 乏力、食欲不振8例;外生殖器发育不良7例;身材矮小7例;消化道出血2例;鼻衄、牙龈出血、皮肤黏膜出血2例;反复上呼吸道感染6例,感染性休克2例;并发垂体危象2例,其中1例有癫痫;糖尿病2例,糖耐量异常1例;骨质疏松症2例;中度睡眠呼吸暂停低通气综合征1例。
2.4 检查结果与治疗 8例患者垂体-甲状腺轴、垂体-性腺轴、生长激素(GH)、胰岛素样生长因子1(IGF-1)、血常规、肝纤四项和影像学检查结果均异常,7例患者抗利尿激素及肝功能异常,6例患者垂体-肾上腺轴、凝血功能和血脂异常。抗利尿激素分泌异常患者均根据血压、尿量、尿比重、电解质情况应用醋酸去氨加压素片;肾上腺皮质功能减退者给予氢化可的松早晨20 mg,下午10 mg(疾病所致应激状态时适当加量);甲状腺功能减退患者根据甲状腺功能补充甲状腺激素;性腺功能减退患者男性补充十一酸睾酮,女性行雌孕激素序贯治疗;6例患者(病例2、3、4、5、7、8)行GH替代治疗。随访1年后患者的白细胞计数、血小板计数、天冬氨酸氨基转移酶、碱性磷酸酶、总胆红素、间接胆红素、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、纤维蛋白原、肝纤四项较治疗前改善,差异有统计学意义(P<0.05);随访1年后患者血红蛋白、丙氨酸氨基转移酶、谷氨酰转肽酶、直接胆红素、三酰甘油、凝血酶原时间、内源性凝血酶原时间、D-二聚体较治疗前无改善,差异无统计学意义(P>0.05),见表2~3。
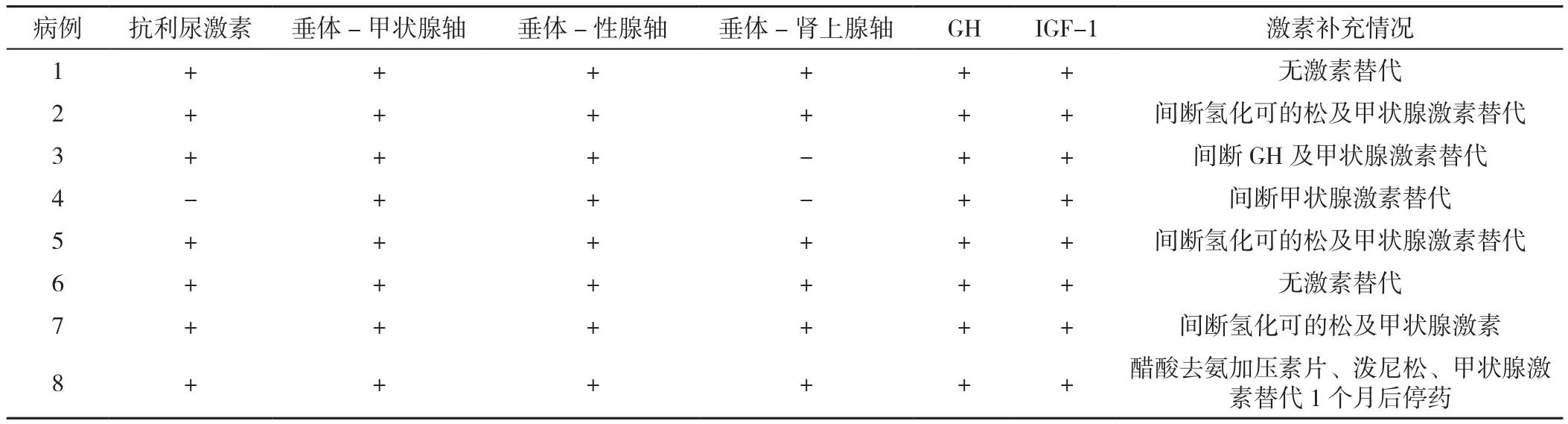
表2 8例垂体功能减退症合并肝硬化患者内分泌检查及激素补充情况Table 2 Endocrine examination and hormone supplement treatment in 8 cases of hepatic cirrhosis secondary to hypopituitarism
表3 8例垂体功能减退症合并肝硬化患者治疗前、治疗1年后实验室检查指标比较(±s)Table 3 Comparison of laboratory inspection indexes before and after oneyear treatment in 8 cases of hepatic cirrhosis secondary to hypopituitarism
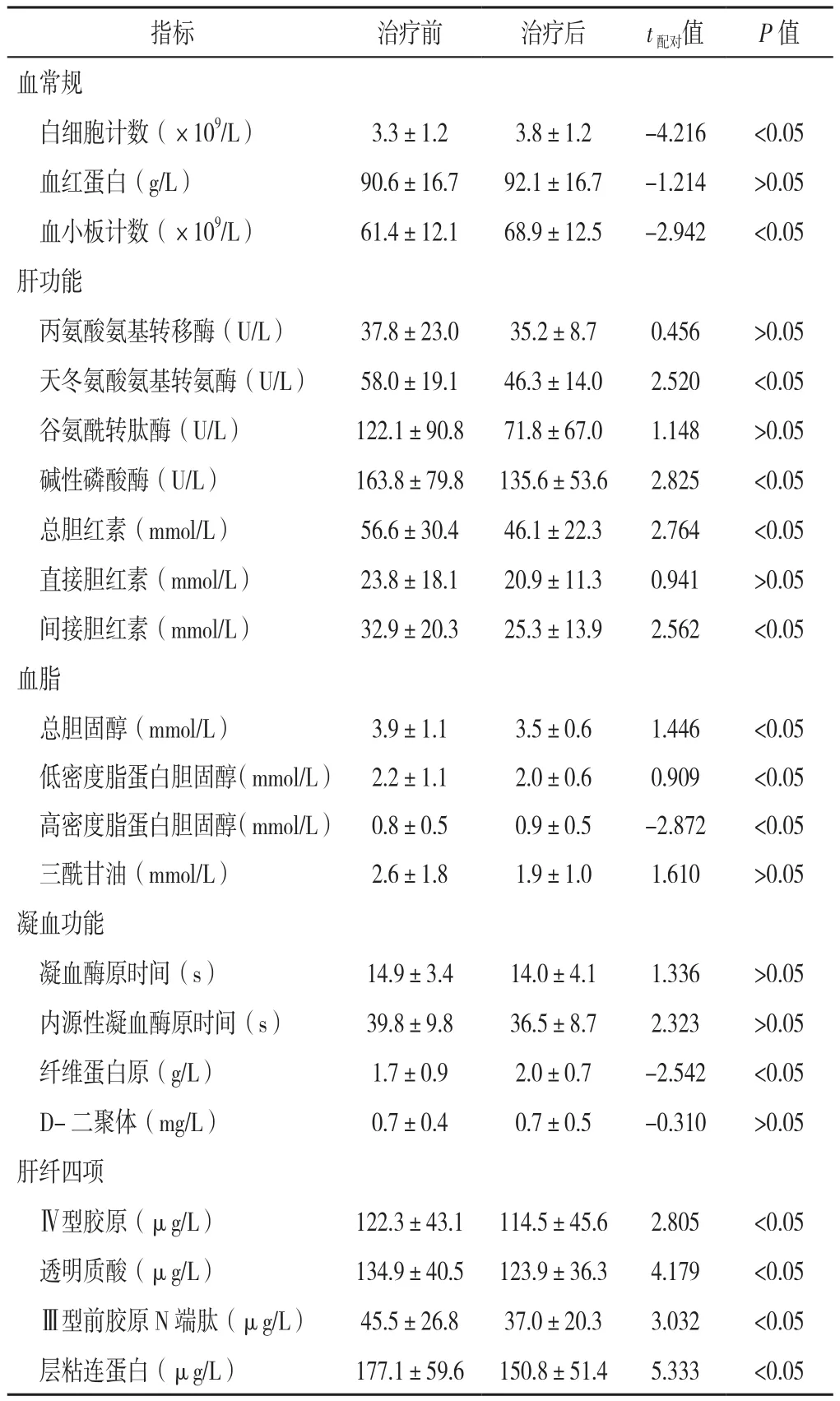
表3 8例垂体功能减退症合并肝硬化患者治疗前、治疗1年后实验室检查指标比较(±s)Table 3 Comparison of laboratory inspection indexes before and after oneyear treatment in 8 cases of hepatic cirrhosis secondary to hypopituitarism
指标 治疗前 治疗后 t配对值 P值血常规白细胞计数(×109/L) 3.3±1.2 3.8±1.2 -4.216 <0.05血红蛋白(g/L) 90.6±16.7 92.1±16.7 -1.214 >0.05血小板计数(×109/L) 61.4±12.1 68.9±12.5 -2.942 <0.05肝功能丙氨酸氨基转移酶(U/L) 37.8±23.0 35.2±8.7 0.456 >0.05天冬氨酸氨基转氨酶(U/L) 58.0±19.1 46.3±14.0 2.520 <0.05谷氨酰转肽酶(U/L) 122.1±90.8 71.8±67.0 1.148 >0.05碱性磷酸酶(U/L) 163.8±79.8 135.6±53.6 2.825 <0.05总胆红素(mmol/L) 56.6±30.4 46.1±22.3 2.764 <0.05直接胆红素(mmol/L) 23.8±18.1 20.9±11.3 0.941 >0.05间接胆红素(mmol/L) 32.9±20.3 25.3±13.9 2.562 <0.05血脂总胆固醇(mmol/L) 3.9±1.1 3.5±0.6 1.446 <0.05低密度脂蛋白胆固醇(mmol/L) 2.2±1.1 2.0±0.6 0.909 <0.05高密度脂蛋白胆固醇(mmol/L) 0.8±0.5 0.9±0.5 -2.872 <0.05三酰甘油(mmol/L) 2.6±1.8 1.9±1.0 1.610 >0.05凝血功能凝血酶原时间(s) 14.9±3.4 14.0±4.1 1.336 >0.05内源性凝血酶原时间(s) 39.8±9.8 36.5±8.7 2.323 >0.05纤维蛋白原(g/L) 1.7±0.9 2.0±0.7 -2.542 <0.05 D-二聚体(mg/L) 0.7±0.4 0.7±0.5 -0.310 >0.05肝纤四项Ⅳ型胶原(μg/L) 122.3±43.1 114.5±45.6 2.805 <0.05透明质酸(μg/L) 134.9±40.5 123.9±36.3 4.179 <0.05Ⅲ型前胶原N端肽(μg/L) 45.5±26.8 37.0±20.3 3.032 <0.05层粘连蛋白(μg/L) 177.1±59.6 150.8±51.4 5.333 <0.05
3 讨论
垂体功能减退症多表现为中枢性肥胖、胰岛素抵抗和血脂异常,其也是NAFLD发病机制的重要组成部分[2],但垂体功能减退症合并肝硬化失代偿期、脾功能亢进继发三系减少极为少见,且容易被临床医生所忽视。总结以上8例患者临床资料,特点如下:(1)垂体功能减退症原因明确,肿瘤手术或放疗多见;(2)患者均有垂体-性腺轴、垂体-甲状腺轴、GH、IGF-1、血常规、肝纤四项和影像学异常,7例患者有抗利尿激素及肝功能异常,6例患者有垂体-肾上腺轴、凝血功能和血脂异常;(3)患者多为青少年,垂体功能减退后未及时规范激素替代治疗,尤其是GH及性激素,未规律复诊;(4)7例患者腹型偏胖或肥胖,3例患者合并糖代谢异常,6例患者合并血脂代谢异常,2例患者合并骨代谢异常,1例合并睡眠呼吸暂停低通气综合征;(5)免疫力低下,易反复感染,甚至出现感染性休克、垂体危象;(6)患者出现肝硬化前均有数年的激素缺乏病程;(7)给予激素替代治疗1年后随访,白细胞计数、血小板计数、天冬氨酸氨基转移酶、碱性磷酸酶、总胆红素、间接胆红素、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、纤维蛋白原、肝纤四项较治疗前改善(P<0.05)。
垂体功能减退时常存在多种激素缺乏,GH分泌最易受影响,之后依次是垂体-性腺轴、垂体-甲状腺轴、垂体-肾上腺轴,部分可合并中枢性尿崩症,本结果与之一致。长期规范的激素替代治疗非常重要,否则会出现靶腺功能低下,本研究中8例患者均未给予长期规范的激素替代治疗直至出现肝硬化失代偿期症状。研究发现垂体功能减退症患者代谢综合征(metabolic syndrome,MS)的患病率明显高于普通人群[3],GH缺乏的患者MS患病率更高,且与GH水平呈负相关[4],NAFLD是MS累及肝脏的表现。不同于常见病因所致的肝硬化,本研究发现垂体功能减退症患者诊断肝硬化的平均年龄较小,为19.9岁,垂体功能减退后诊断肝硬化的平均时间是7.9年,与既往的研究[5]基本一致,这些数据表明垂体功能减退症患者发生肝硬化具有年轻化的特点。
GH是促进NAFLD发生、发展的关键因素,其对内脏脂肪具有强烈的脂解作用,垂体功能减退症患者NAFLD的患病率增加,严重程度与GH水平相关[6]。TAKAHASHI等[7]发现1例侏儒症合并NASH的患者接受6个月的GH替代治疗后,NASH和血脂紊乱显著改善,氧化应激显著降低。GH替代治疗不仅可改善肝酶、组织学变化,还可降低纤维化标记物[8],不仅如此,GH还可显著改善慢性肝衰竭患者的预后[9]。有研究发现特沙莫林(一种合成的GH释放激素)可阻止艾滋病患者NAFLD的肝纤维化[10],有望在未来成为一种改善NAFLD患者代谢的新治疗策略。本研究8例患者均根据需要给予甲状腺激素、性激素、肾上腺皮质激素及去氨加压素的补充治疗,但由于经济原因只有4例患者行GH治疗,GH补充患者治疗效果是否明显优于未补充患者仍需进一步随访。
IGF-1缺乏也是NAFLD形成的重要原因之一,本研究患者均存在IGF-1水平低下。肝脏为IGF-1的主要产生部位,受GH调节。肝细胞GH受体特异性缺失小鼠血清IGF-1水平降低90%,这类小鼠表现出胰岛素抵抗、葡萄糖耐受不良、游离脂肪酸增加和严重的肝脂肪变性,表明GH和IGF-1在肝脏中的生理重要性[11]。较低的IGF-1水平与NAFLD患者的炎症严重程度、肝细胞气球样变[12]和纤维化[13]有关。GH缺乏的小鼠出现线粒体功能障碍、形态严重异常,而IGF-1可非依赖于GH逆转这些异常[14]。应用IGF-1可改善肝硬化小鼠模型的肝功能和纤维化,改善老年小鼠的线粒体功能[15]。综上,这些研究表明GH和IGF-1缺乏与NAFLD发生发展相关,并可能以其独特的机制适用于其治疗。
垂体分泌的其他激素也在NAFLD的发生发展中起重要作用。甲状腺功能减退症患者机体处于低代谢状态,易发生腹型肥胖,NAFLD风险明显增加[16]。YAN等[17]发现促甲状腺激素可通过上调SREBP-1c的活性增加肝脏三酰甘油聚积,促进肝脏脂肪变,其调控三酰甘油合成代谢过程主要是通过cAMP/PKA/PPARα信号通路实现,且PKA、PPARα和SREBP-1c等分子在调控三酰甘油合成代谢过程中居于核心地位。皮质醇可通过增加脂肪酸的运输、促进脂质在肝脏的积累促进NAFLD的发病[18]。脱氢表雄酮水平降低与NAFLD患者的纤维化进展有关[19];血清雌、雄激素水平低与肝脂肪变性有关[20-21]。抗利尿激素分泌不足导致血浆渗透压升高,高渗可抑制成纤维细胞3T3-L1脂肪细胞胰岛素信号传导,导致胰岛素抵抗[22],进一步参与了NAFLD的发生。也有研究报道瘦素水平与肝纤维化呈显著相关性[23]。本研究中患者甲状腺激素、性激素水平均明显下降,多数合并中枢性尿崩症,且激素替代治疗不足均在肝硬化的形成中起重要作用。
本研究患者由于各种原因导致了垂体功能减退,但均未积极治疗,直至出现肝硬化失代偿期的表现,经过规范的激素替代治疗后复查血常规、肝功能、凝血功能、血脂、肝纤四项,多数指标较治疗前改善,提示激素治疗有效,因此临床对于此类患者应行积极的激素替代,防止肝硬化等并发症的出现及进展。
本研究的局限性在于样本量较少,且肝穿刺活检病例只有2例,常规的血液检查和影像检查不能准确评估患者肝硬化进展情况,未来需要进行更多前瞻性、多中心、大样本的临床研究以及动物实验来进一步明确垂体功能减退症和NAFLD的关系。
作者贡献:时学秀、贠文晶、王海旭、赵颖颖、杨亚楠、孙同文进行文章的构思与设计;时学秀、王海旭、杨亚楠进行数据收集及整理;时学秀、贠文晶、赵颖颖、孙同文进行结果的分析与解释;时学秀负责撰写和修订论文;孙同文负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
