淫羊藿苷通过上调Runx2促进踝关节骨折大鼠骨重建及抑制破骨细胞形成
2023-02-10郑国洪孙斌王洁琼杨正明
郑国洪, 孙斌, 王洁琼, 杨正明
(1.浙江省舟山市中医院急诊骨伤科,浙江舟山 316000;2.浙江大学医学院附属第二医院骨科,浙江杭州 310000)
踝关节骨折是临床常见的关节内创伤型骨折之一,发生率逐年升高[1]。踝关节是人体第一负重关节,最高可承受5倍个人体质量,但其关节面小,离地面近,承重力无法充分缓冲,因此极易受损[2]。目前,关于踝关节骨折的治疗方案尚不统一,临床多采用镇痛、抗炎药物配合外科手术的治疗方法以达到增强关节稳定性、抑制炎症的效果,但手术创伤易引发关节软组织粘连且术后抗炎药物不良反应较多,并不适用于全部患者尤其是老龄患者[3]。淫羊藿苷(icariin)是常用中药淫羊藿[为小檗科植物淫羊藿Epimedium brevicomuMaxim.、箭叶淫羊藿Epimedium sagittatum(Sieb.et Zucc.)Maxim.、柔 毛 淫 羊 藿Epimedium pubescensMaxim.或朝鲜淫羊藿Epimedium koreanumNakai的干燥叶]的主要有效成分之一。有研究[4-6]表明,淫羊藿苷在促进骨折愈合和治疗骨缺损方面有着显著作用,但具体作用机制尚不明确。本研究建立踝关节骨折创伤大鼠模型,进一步观察淫羊藿苷的治疗作用及机制,以期为其临床应用治疗骨折提供依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物 55只SPF级8周龄雄性SD大鼠,体质量(280±20)g,购自上海南方模式生物科技股份有限公司,动物生产许可证号:SCXK(沪)2019-0002。本研究方案已经浙江省舟山市中医院动物伦理委员会批准。
1.2 药物、试剂与仪器 淫羊藿苷(纯度:98%,上海源叶生物科技有限公司生产,批号:B21576,分子量:676.662,分子式:C33H40O15,分子结构见图1);复方骨肽注射液(南京新百药业有限公司生产,国药准字H32020004)。抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(上海哈灵生物科技有限公司);兔抗大鼠Runt相关转录因子2(Runx2)抗体(英国Santa公司)。SkyScan活体三维断层扫描仪(德国Bruker公司);SZX7显微镜(日本奥林巴斯株式会社);Doc EZ凝胶成像分析系统(美国伯乐公司)。
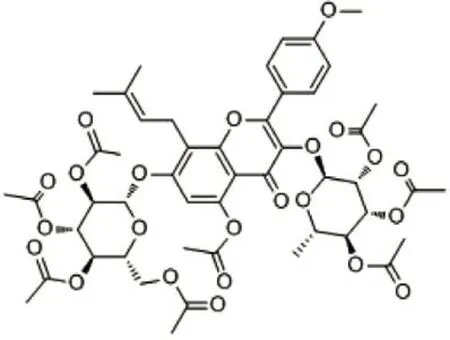
图1 淫羊藿苷分子结构Figure 1 Molecular structure of icariin
1.3 建立踝关节骨折大鼠模型[7]大鼠适应性饲养1周后,腹腔注射戊巴比妥钠深度麻醉,备皮消毒后,仰卧位固定于手术台,右下肢屈膝90°,踝关节充分外展,内踝处做1 cm长度切口,分离皮下筋膜,牵拉肌腱,暴露踝关节,骨凿37°凿入内踝,生理盐水冲洗后缝合切口。术前腹腔注射青霉素预防感染,术后给予曲马多镇痛,每日1次,持续3 d。术后即刻行X线摄片,以踝关节斜形或横形骨折,骨折端内固定效果理想,未发生明显移位为建模成功标准。结果成功建立踝关节骨折模型50只。
1.4 分组与干预 将50只踝关节骨折大鼠随机分为模型组,淫羊藿苷低、中、高剂量组及阳性药组,每组10只。建模后次日,根据黄继汉等《药理试验中动物间和动物与人体间的等效剂量换算》[8]进行给药剂量换算。淫羊藿苷低、中、高剂量组腹腔注射淫羊藿苷生理盐水2.5 mL(分别含淫羊藿苷30、60、120 mg/kg)[9],阳性药组腹腔注射复方骨肽注射液与生理盐水混合溶液2.5 mL(含复方骨肽注射液5 mL/kg)[10],模型组腹腔注射生理盐水2.5 mL。每日1次,持续4周。
1.5 观察指标与方法
1.5.1 Micro-CT活体扫描 干预2、4周后做三维断层扫描,戊巴比妥钠麻醉后俯卧位固定于手术台,屈曲双下肢。设定分辨率47μm,行Micro-CT扫描,沿骨痂上下各取50个扫描层面。在骨折处建立三维感兴趣区,CTAn软件分析结果,计算骨小梁数量(trabecular number,Tb.N)与骨体积分数(bonevolume/total volume,BV/TV)。
1.5.2 生物力学测试 末次Micro-CT活体扫描结束后,过量麻醉处死大鼠,取其右下肢踝关节,固定两端后行三点弯曲实验。以所取踝关节中点为加载点,顶端、底端跨距分别为8、20 mm,记录刚度(骨头在不被破坏的情况下能够承受的力的大小的能力)及最大载荷(骨头最大力学载荷耐受程度)。
1.5.3 TRAP染色法检测破骨细胞数量 生物力学测试完成后,每组取5只大鼠包括骨痂组织的踝关节,置于4%福尔马林溶液中固定72 h,移至10%乙二胺四乙酸二钠脱钙液,6周后常规脱水、浸蜡、包埋,以切片机切为4μm厚度,连续切片。根据TRAP染色试剂盒说明书步骤染色切片,置于显微镜下观察。黄褐色细胞为阳性破骨细胞,随机选取5个不相邻的视野,记录每个视野破骨细胞数,求其均值。
1.5.4 HE染色观察骨痂组织学变化 取各组剩余5只大鼠踝关节,切取骨折处上下6 mm×6 mm骨痂组织,分成2份。一份置于10%中性甲醛固定48 h,常规脱水、浸蜡、包埋,切片机切为4μm厚度连续切片;另一份投入液氮中保存。二甲苯脱蜡踝关节切片,水化后自来水冲洗,移至苏木素染液内染色5 min。自来水冲洗,分化液分化。自来水冲洗,移入蓝化液返蓝,伊红液染色2 min。自来水漂洗,常规脱水、透明。滴入中性树脂封固,置于显微镜下观察骨痂组织病理变化,并拍照记录。
1.5.5 Western Blot法检测骨痂组织Runx2蛋白表达水平 取液氮中保存的骨痂组织,研磨后裂解,以9 000 r/min(离心半径10 cm)离心15 min,取上清,BCA法定量蛋白浓度。取40μg样本蛋白,混合4倍体积上样缓冲液,金属浴煮沸5 min。同条件下离心取上清,恒压下行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离,湿转至膜。加入封闭液封闭2 h,TBST洗膜,加入Runx2一抗(1∶500体积比稀释),4℃摇床孵育过夜。TBST洗膜,加入辣根过氧化物酶标记的二抗(1∶2 000体积比稀释),室温孵育2 h,ECL发光,暗盒显影。经凝胶成像分析仪分析蛋白条带灰度值,Runx2蛋白相对表达量以Runx2蛋白/内参GAPDH灰度值表示。
1.6 统计方法 采用SPSS13.0统计软件进行数据分析,计量资料以均数±标准差(±s),多组样本资料比较采用单因素方差分析,进一步以LSD-t法行两两比较。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠骨重建指标比较 表1结果显示:干预2、4周后,与模型组同期比较,淫羊藿苷低、中、高剂量组和阳性药组Tb.N增加,BV/TV值升高(P<0.05),淫羊藿苷各剂量组作用效果呈剂量依赖性;但淫羊藿苷各剂量组Tb.N、BV/TV值均低于阳性药组(P<0.05)。
表1 各组大鼠骨重建指标比较Table 1 Comparison of bone reconstruction indexes among various groups of rats (±s)
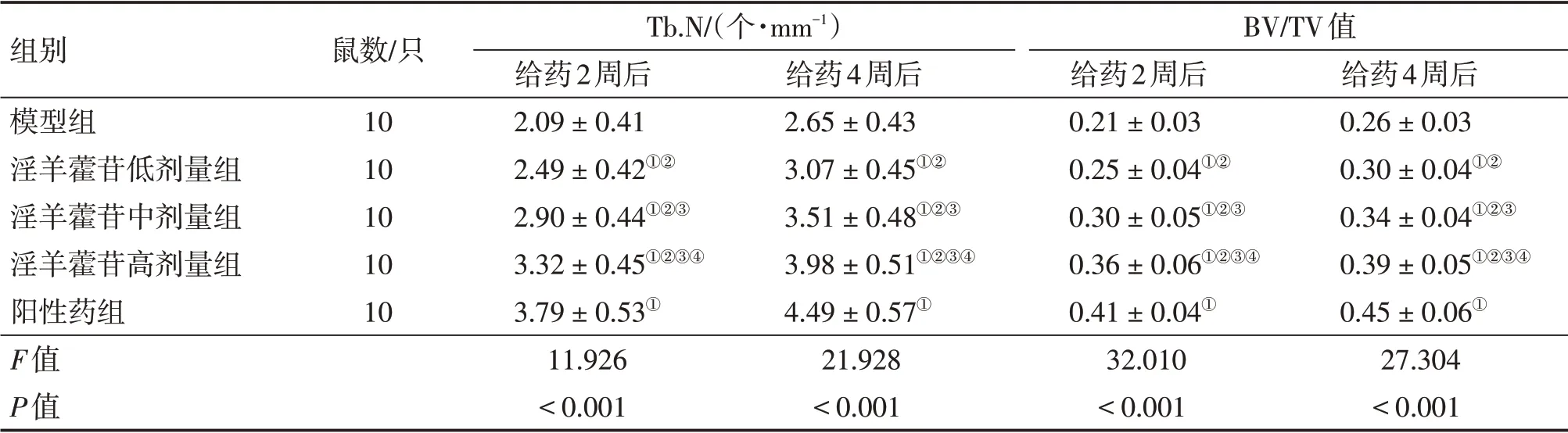
表1 各组大鼠骨重建指标比较Table 1 Comparison of bone reconstruction indexes among various groups of rats (±s)
注:①P<0.05,与模型组比较;②P<0.05,与阳性药组比较;③P<0.05,与淫羊藿苷低剂量组比较;④P<0.05,与淫羊藿苷中剂量组比较
组别模型组淫羊藿苷低剂量组淫羊藿苷中剂量组淫羊藿苷高剂量组阳性药组F值P值鼠数/只10 10 10 10 10 Tb.N/(个·mm-1)给药2周后2.09±0.41 2.49±0.42①②2.90±0.44①②③3.32±0.45①②③④3.79±0.53①11.926<0.001给药4周后2.65±0.43 3.07±0.45①②3.51±0.48①②③3.98±0.51①②③④4.49±0.57①21.928<0.001 BV/TV值给药2周后0.21±0.03 0.25±0.04①②0.30±0.05①②③0.36±0.06①②③④0.41±0.04①32.010<0.001给药4周后0.26±0.03 0.30±0.04①②0.34±0.04①②③0.39±0.05①②③④0.45±0.06①27.304<0.001
2.2 各组大鼠生物力学指标比较 表2结果显示:与模型组比较,淫羊藿苷低、中、高剂量组和阳性药组最大载荷、刚度增加(P<0.05),淫羊藿苷各剂量组作用效果呈剂量依赖性;但淫羊藿苷各剂量组最大载荷、刚度均低于阳性药组(P<0.05)。
表2 各组大鼠生物力学指标比较Table 2 Comparison of biomechanical indexes among various groups of rats (±s)
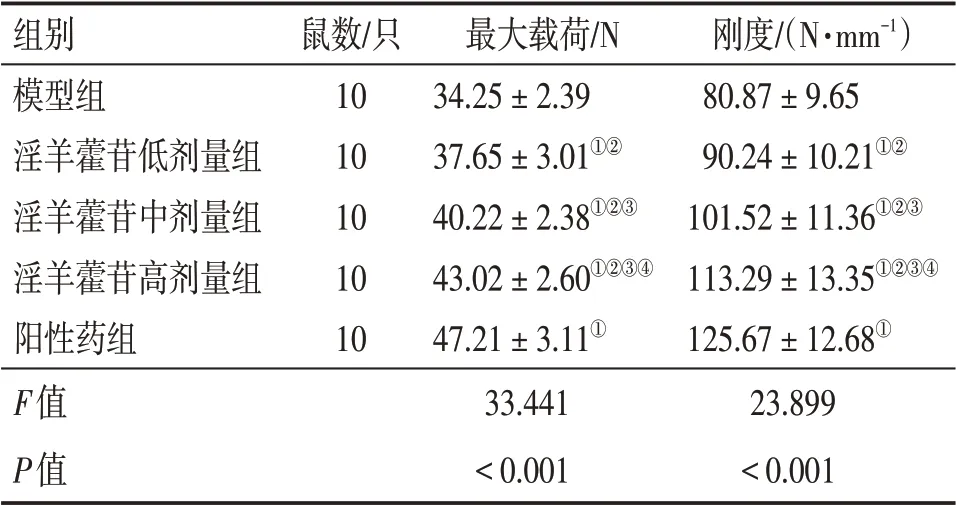
表2 各组大鼠生物力学指标比较Table 2 Comparison of biomechanical indexes among various groups of rats (±s)
注:①P<0.05,与模型组比较;②P<0.05,与阳性药组比较;③P<0.05,与淫羊藿苷低剂量组比较;④P<0.05,与淫羊藿苷中剂量组比较
组别模型组淫羊藿苷低剂量组淫羊藿苷中剂量组淫羊藿苷高剂量组阳性药组F值P值鼠数/只10 10 10 10 10最大载荷/N 34.25±2.39 37.65±3.01①②40.22±2.38①②③43.02±2.60①②③④47.21±3.11①33.441<0.001刚度/(N·mm-1)80.87±9.65 90.24±10.21①②101.52±11.36①②③113.29±13.35①②③④125.67±12.68①23.899<0.001
2.3 各组大鼠骨痂组织破骨细胞数量比较 表3、图2结果显示:与模型组比较,淫羊藿苷低、中、高剂量组和阳性药组骨痂组织破骨细胞数量减少(P<0.05),淫羊藿苷各剂量组作用效果呈剂量依赖性;但淫羊藿苷各剂量组骨痂组织破骨细胞数量均高于阳性药组(P<0.05)。
表3 各组大鼠骨痂组织破骨细胞数量比较Table 3 Comparison of number of osteoclasts in callus tissue among various groups of rats (±s)
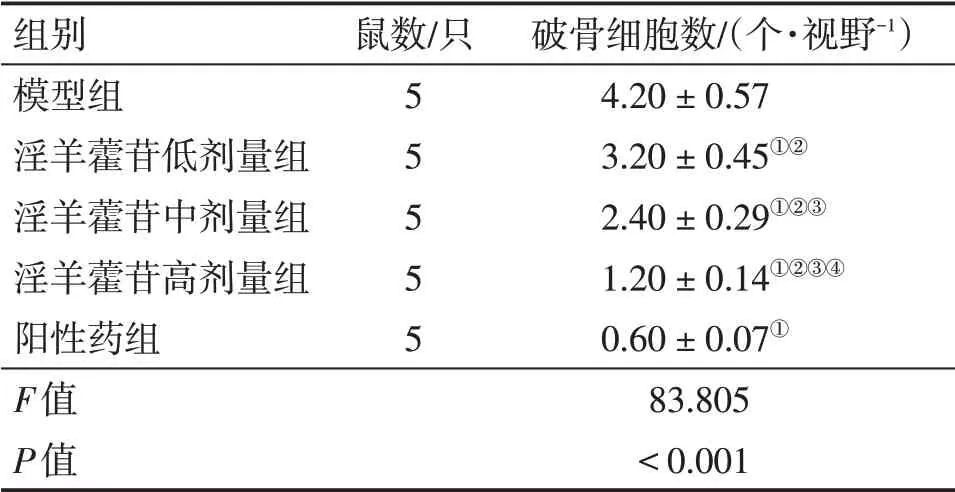
表3 各组大鼠骨痂组织破骨细胞数量比较Table 3 Comparison of number of osteoclasts in callus tissue among various groups of rats (±s)
注:①P<0.05,与模型组比较;②P<0.05,与阳性药组比较;③P<0.05,与淫羊藿苷低剂量组比较;④P<0.05,与淫羊藿苷中剂量组比较
组别模型组淫羊藿苷低剂量组淫羊藿苷中剂量组淫羊藿苷高剂量组阳性药组F值P值鼠数/只55555破骨细胞数/(个·视野-1)4.20±0.57 3.20±0.45①②2.40±0.29①②③1.20±0.14①②③④0.60±0.07①83.805<0.001
2.4 各组大鼠骨痂组织学改变比较 图3结果显示:模型组骨小梁不具有明显的方向性,成骨细胞功能不活跃,骨小梁较细;淫羊藿苷低、中剂量组可见较多骨性骨痂,骨小梁较粗,部分成熟,存在明显矿化,排列较整齐;淫羊藿苷高剂量组、阳性药物组可见软骨性及纤维性骨痂形成,软骨性骨痂边缘钙化明显,骨外膜下可见成骨细胞形成骨小梁。

图3 各组骨痂组织HE染色结果(×200)Figure 3 HE staining results of the callus tissue in various groups(×200)
2.5 各组大鼠骨痂组织Runx2蛋白表达量比较表4、图4结果显示:与模型组比较,淫羊藿苷低、中、高剂量组和阳性药组骨痂组织Runx2蛋白表达量升高(P<0.05),淫羊藿苷各剂量组作用效果呈剂量依赖性;但淫羊藿苷各剂量组骨痂组织Runx2蛋白表达量均低于阳性药组(P<0.05)。
表4 各组大鼠骨痂组织Runx2蛋白表达比较Table 4 Comparison of Runx2 protein expression in callus tissue among various groups of rats (±s)
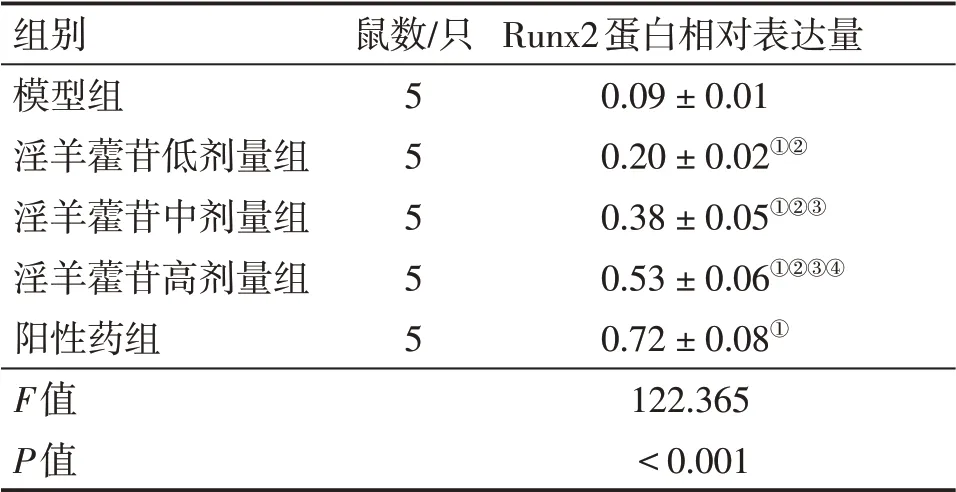
表4 各组大鼠骨痂组织Runx2蛋白表达比较Table 4 Comparison of Runx2 protein expression in callus tissue among various groups of rats (±s)
注:①P<0.05,与模型组比较;②P<0.05,与阳性药组比较;③P<0.05,与淫羊藿苷低剂量组比较;④P<0.05,与淫羊藿苷中剂量组比较
组别模型组淫羊藿苷低剂量组淫羊藿苷中剂量组淫羊藿苷高剂量组阳性药组F值P值鼠数/只55555 Runx2蛋白相对表达量0.09±0.01 0.20±0.02①②0.38±0.05①②③0.53±0.06①②③④0.72±0.08①122.365<0.001
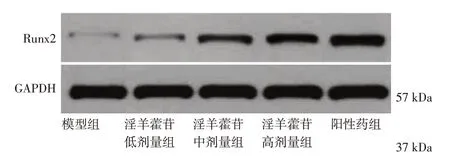
图4 各组骨痂组织Runx2蛋白Western Blot电泳图Figure 4 Western Blot electrophoretogram of Runx2 protein in callus tissue
3 讨论
踝关节骨折是由于胫腓骨下端冲击与之相连距骨,发生翻转、扭动而造成的下肢骨损伤,多发生于体育锻炼、生活劳动时,以踝部肿胀、压痛,皮下瘀斑,踝关节无法自由活动为主要临床表现[11]。骨折,愈合是骨折处组织反复进行吸收与形成的过程,其中破骨细胞主导骨吸收,成骨细胞主导骨形成,二者相互抑制形成动态平衡,但由于炎症反应的存在,成骨-破骨平衡状态被打破,破骨细胞优势明显,成骨功能降低,骨愈合放缓,导致病程延长[12]。因此,寻找抑制破骨细胞、提升成骨能力的新药物或手段是治疗踝关节骨折的关键。
中医治疗骨折历史悠久,将骨折治疗定为“瘀去”“新生”“骨合”三期,现代中医在三期辨证的基础上灵活运用,认为其病位在于肾、肝,主要病机为骨断筋伤,血瘀不散,经络阻滞,累积伤肾,肾阳亏虚,以致筋脉失养、骨髓不愈,故治疗应以舒筋活血、补肾壮阳为主[13]。淫羊藿温燥助阳之性较强,除长于补命火、壮肾阳外,其通痹、强筋骨、治风冷疼痛症较佳,常用于治疗性机能衰退、腰膝无力、风湿痹痛、四肢麻木等症。《别录》言淫羊藿能“坚筋骨”。《日华诸家本草》曰淫羊藿治“一切冷风劳气,筋骨挛急,四肢不仁,补腰膝”。《本草备要》云淫羊藿能“补命门,益精气,坚筋骨,利小便”。《本草求真》指出:“淫羊藿气味甘温,则能补火助阳,兼有辛香,则冷可除而风可散耳。”淫羊藿苷是从淫羊藿中提取的单体黄酮类化合物,本研究结果显示,经淫羊藿苷干预2、4周后,踝关节骨折大鼠Tb.N、最大载荷、刚度增加,BV/TV值升高,破骨细胞数减少,且呈剂量依赖性,提示淫羊藿苷可提升骨重建能力及生物力学性能,抑制破骨细胞形成。
Runx2属于转录因子Runx家族成员,是一种异二聚体核蛋白,作为骨细胞特异性转录蛋白,参与多种骨骼系统疾病的发生与发展[14]。Runx2是成骨分化前期重要的上游因子,可调控细胞外基质蛋白表达,诱导骨髓间充质干细胞发育为成骨或软骨细胞,并直接调控成骨细胞特异性基因如OSX表达[15]。此外,Runx2的羧基端SMID/NMTS区域是骨分化的必需片段[16]。Liu等[17]研究发现,骨折后Runx2在胫骨组织中的表达水平明显降低,上调其表达后可提升骨密度及最大载荷、弯曲强度、弹性应力、弹性应变,在骨组织修复、促进胫骨骨折愈合中发挥重要作用。本研究结果显示,与模型组比较,经淫羊藿苷干预后骨痂组织Runx2蛋白表达量升高,且呈剂量依赖性,提示淫羊藿苷可能通过上调Runx2蛋白表达抑制踝关节骨折创伤大鼠破骨细胞分化。
综上所述,淫羊藿苷可促进踝关节骨折创伤大鼠骨重建,抑制破骨细胞形成,提高生物力学性能,其作用机制可能与上调Runx2蛋白表达有关;但淫羊藿苷作用效果不及复方骨肽注射液,其医用生物有待进一步的深入研究。
