树突细胞miR-17调节初始CD4+T淋巴细胞分化Treg/Th17失衡机制的研究
2023-02-10盛云峰邱美华陈园园孙丽芳甄利波
盛云峰 邱美华 陈园园 孙丽芳 甄利波
结核分枝杆菌感染后会启动依赖于细胞介导的适应性免疫应答,通过抗原提呈细胞如树突细胞(dendritic cells,DC)将细菌抗原提呈给初始T细胞,进而分化为效应性T细胞。当再次接触结核分枝杆菌抗原后,通过分泌多种炎症介质,增强巨噬细胞功能从而杀灭结核分枝杆菌。但有研究发现结核分枝杆菌感染后机体的这种适应性免疫应答可发生失调,导致结核分枝杆菌不能被完全清除[1]。微小RNA(miRNA)是一类内源性非编码RNA分子,为表观遗传调控机制之一。研究表明,miRNA参与调节人体各种免疫过程,在人类的肿瘤及自身免疫性疾病中已经发现多种miRNA的表达改变[2-3]。基于Solexa测序和qPCR方法的研究发现,肺结核患者的血清miRNA-17(简称“miR-17”)的表达显著增加[4]。笔者通过研究肺结核患者的DC内miR-17的表达及肺结核患者的DC对初始CD4+T淋巴细胞分化的作用,探讨miR-17参与调控结核分枝杆菌感染宿主的免疫失衡的相关机制。
对象和方法
一、 研究对象
选择2022年2月1日至4月30日在浙江大学医学院附属杭州市胸科医院收治的肺结核患者20例(肺结核组),同时收集同期门诊的健康体检者20名(健康对照组)。研究经浙江大学医学院附属杭州市胸科医院伦理委员会批准,批准文号:[2022]研审第(62)号。肺结核组:男性12例、女性8例,年龄为22~42岁;健康对照组:男性11例、女性9例,年龄为24~38岁。肺结核患者的诊断均符合《WS 288—2017肺结核诊断》[5]的标准,并排除结核性胸膜炎和肺外结核。健康对照组入组标准:无肺结核临床表现,无胸部影像学检查异常。两组研究对象均为浙江省的汉族人群,无合并其他传染病、慢性病、肿瘤和自身免疫性疾病。
二、研究方法
1.主要试剂和仪器:人淋巴细胞分离液 Ficoll-Paque(美国 GE公司);初始 CD4+T淋巴细胞分离试剂盒;人T细胞活化剂CD3/CD28购自美国Thermo Fisher公司;胎牛血清购自美国Gibco公司;GM-CSF 购自美国R&D System公司;抗人Foxp3抗体购自英国AbCAM公司;Trizol液购自美国Invitrogen公司;miRNA提取试剂盒、cDNA逆转录试剂盒及mRNA 实时荧光定量PCR试剂盒均购自江苏康为世纪生物科技有限公司;miR 阴性对照物(miR NC)、miR-17模拟物(miR-17 mimic)和miR-17抑制剂(miR-17 inhibitor)均购自上海吉玛制药技术有限公司。CO2细胞培养箱为Thermo Scientific(3111);倒置显微镜为Olympus(CX23);超净工作台为苏信(YJ-840/YJ-1340);低速离心机为Eppendorff(5810R);分光光度计为Beckman(DU730);流式细胞仪为BD(Accuri C6);实时荧光定量PCR仪为Agilent(Stratagene MX3005p)。
2.健康对照组外周血初始CD4+T淋巴细胞的分离: 人浓缩白细胞加入磷酸盐缓冲液(PBS),稀释 2~4倍; 稀释过的浓缩白细胞加入到15 ml的Ficoll 上, 400×g离心35 min,取出外周血单个核细胞层(PBMC); 加入PBS 300×g离心10 min洗涤1~2次。取 1×108的细胞加入0.4 ml PBS+BSA重悬细胞,再加入100 μl初始CD4+T淋巴细胞生物素-抗体Ⅱ混匀,4 ℃放置10 min。加入10~20 ml缓冲液,300×g离心10 min后去上清。加入0.8 ml纯化缓冲液和 200 μl抗生物素微珠混匀,4 ℃放置15 min;加入10~20 ml缓冲液,300×g离心10 min,去上清。加入0.5 ml缓冲液重悬细胞,以LS柱分选获得初始CD4+T淋巴细胞。
3.肺结核组外周血DC的分离与分化:取肺结核患者外周抗凝血10 ml转入离心管中,吸取10 ml PBS稀释并混匀,置于离心管中,1500×g离心10 min,去上清,加入1 ml红细胞裂解液,静置3 min,再加9 ml PBS溶液,1500×g离心10 min,弃上清,重悬细胞,加入1640培养基;第3天,1500×g离心5 min,弃上清,加入新鲜1640培养基(含10 ng/ml GM-CSF);第6天,1000×g离心5 min,弃上清,将细胞重新种植于150 mm直径的培养皿中,加入新鲜1640培养基;第9天,1000×g离心5 min,弃上清,培养皿底部的松散贴壁细胞即为未成熟树突细胞(imDC)。取部分上述细胞,加入PBS洗1次,1000×g离心3 min;调整细胞浓度为1×105细胞悬液1 ml,加入10 μl 抗人Foxp3抗体,室温下避光孵育45 min,1 h内流式细胞仪检测。将上述imDC按照5×106/ml密度,接种于100 mm 直径的培养皿中,加入10 ml新鲜1640完全培养基,即可得到成熟DC。
4.成熟DC与初始CD4+T淋巴细胞共同培养:实验分3组,miR阴性对照组、miR-17模拟物组和miR-17抑制剂组。将上述来源于肺结核组的成熟DC与来源于健康对照组的初始CD4+T淋巴细胞共培养于96孔板中,加入1640完全培养基(含人T淋巴细胞活化剂CD3/CD28);同时分别加入miR 阴性对照物、miR-17 模拟物、miR-17 抑制剂,将5 μl miRNA稀释到500 μl的血清培养基中。将10 μl脂质体2000稀释到500 μl的血清培养基中,轻轻混匀,静置5 min。将miRNA溶液加入到脂质体2000溶液中,轻轻混匀,静置20 min;将细胞培养板中的培养液吸出,重新加入5 ml新鲜的培养基(含10%胎牛血清的1640)。将两种混合溶液加入到细胞培养皿中,37 ℃,5% CO2培养箱中培养48 h后收集细胞。将上述细胞调整到密度为1×105/ml,各取1 ml。固定和破膜后再分别进行抗Foxp3-488和抗IL-17A-PE标记。流式细胞仪检测含有此两种特异性标记的Treg细胞和Th17细胞的比例。
5.蛋白免疫印迹法检测CD4+T淋巴细胞内蛋白Eos:收集上述细胞,于冰上裂解30 min。裂解完后,于4 ℃下12 000×g离心5 min。上清液转移至新的洁净EP管内进行定量。制胶完成后取适量样品上清加入样品孔中,旁孔加入预染的蛋白标记物。经过电泳-转膜封闭后,进行一抗、二抗孵育。以三磷酸甘油醛脱氢酶(GAPDH)为内部对照。配制ECL发光液,加入化学反应底物,利用成像系统进行成像分析。
6. 检测DC中miR-17及CD4+T淋巴细胞中Eos mRNA的基因表达水平:以江苏康为世纪生物科技有限公司试剂盒对目标基因的mRNA表达量进行实时荧光定量PCR检测,操作按照说明书。对miR-17的表达量进行检测,以U6作为内部对照;对Eos mRNA表达量进行RT-PCR检测,以GAPDH作为内部对照。相应引物序列见表1。反应条件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,40个循环。绘制熔解曲线。采用2-△△Ct方法进行数据计算。
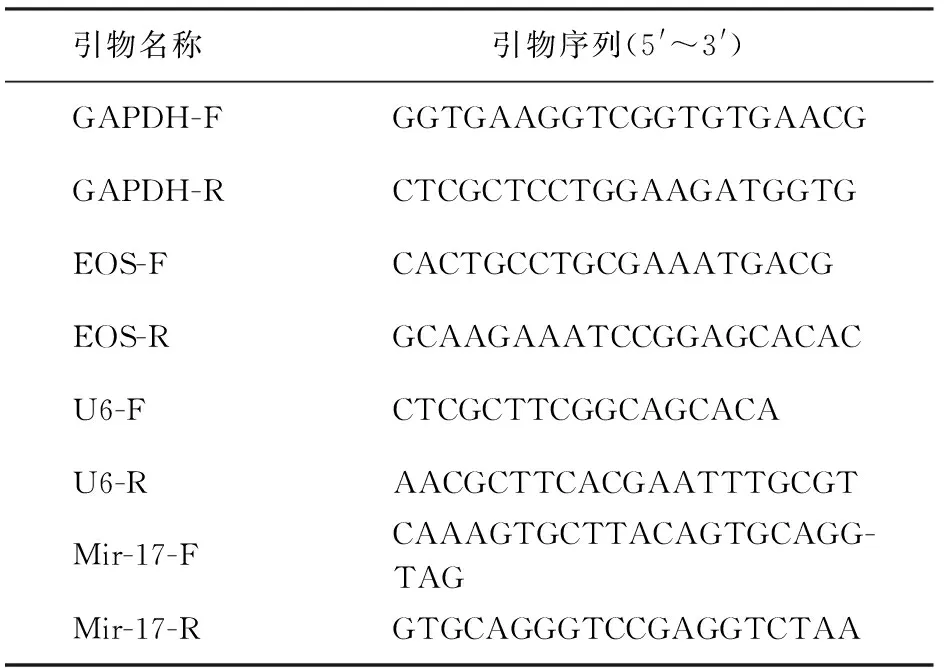
表1 实时荧光定量PCR引物
三、统计学处理
结 果
一、肺结核患者的DC中miR-17基因表达水平
利用miR-17及U6的特异性引物进行qPCR检测miR-17的表达水平。结果发现,肺结核组DC的miR-17基因表达水平(12.546±1.572)明显高于健康对照组DC的表达水平(2.409±1.097),差异有统计学意义(t=28.356,P<0.05)。
二、 转染miR-17模拟物及抑制剂的DC对初始CD4+T淋巴细胞分化的影响
流式细胞仪检测标记抗Foxp3-488和抗IL-17A-PE的初始CD4+T淋巴细胞。计算Treg细胞和Th17细胞的比例。miR-17模拟物组的Treg细胞比例[(4.740±0.901) %]明显低于miR阴性对照组[(59.235±4.652) %],差异有统计学意义(t=50.755,P<0.01);miR-17模拟物组的Th17细胞比例[(67.610±3.495) %]明显高于miR阴性对照组[(27.645±2.075) %],差异有统计学意义(t=38.521,P<0.01)。miR-17抑制剂组的Treg细胞比例[(83.080±5.770) %]明显高于miR阴性对照组[(59.235±4.652) %],差异有统计学意义(t=14.988,P<0.01);miR-17抑制剂组的Th17细胞比例[(11.405±1.777) %]明显低于miR阴性对照组[(27.645±2.075) %],差异有统计学意义(t=27.044,P<0.01)。
三、转染miR-17模拟物及抑制剂的肺结核患者的DC对初始CD4+T淋巴细胞的Eos mRNA基因转录水平的影响
miR-17模拟物组的初始CD4+T淋巴细胞内EosmRNA基因转录水平(0.181±0.123)下调至38.4%,明显低于miR阴性对照组(0.471±0.217),差异有统计学意义(t=10.449,P<0.05);miR-17抑制剂组的初始CD4+T淋巴细胞内EosmRNA基因转录水平(0.889±0.295)上调至1.887倍,明显高于miR阴性对照组(0.471±0.217),差异有统计学意义(t=16.635,P<0.05)。
四、蛋白免疫印迹实验检测初始CD4+T淋巴细胞内蛋白Eos的表达
miR-17模拟物组的初始CD4+T淋巴细胞内Eos相对表达量(3.626±1.319)减少至77.7%,明显低于miR阴性对照组(4.664±1.456),差异有统计学意义(t=8.528,P<0.05);miR-17抑制剂组的初始CD4+T淋巴细胞内Eos相对表达量(6.148±1.701)增加至1.318倍,明显高于miR阴性对照组(4.664±1.456),差异有统计学意义(t=8.035,P<0.05)(图1)。
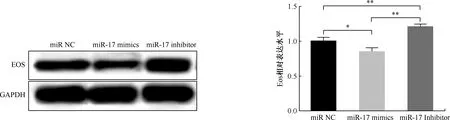
注 *P<0.05; **P<0.01;GAPDH:三磷酸甘油醛脱氢酶;miR NC:miR阴性对照组;miR-17 mimics:miR-17模拟物组;miR-17 inhibitor:miR-17 抑制剂组图1 miR-17模拟物和miR-17抑制剂转染树突细胞对初始CD4+T淋巴细胞蛋白Eos表达水平的影响
讨 论
Th17细胞通过分泌白细胞介素-17A(IL-17A)、IL-17F、IL-21等多种炎症因子介导免疫反应,可诱导中性粒细胞募集活化,参与机体对胞内菌感染的保护性免疫反应。Treg细胞是高表达CD25、低表达CD127的一组CD4+T淋巴抑制细胞,具有阻断T淋巴效应细胞(Teff)的功能。Treg细胞能特异性表达具有稳定细胞功能的蛋白Foxp3。此外,还有其他特征性编码基因(如Il2ra、Ctla4、Tnfrsf18、Ikzf2、Ikzf4等)在发挥Treg细胞的功能上也起着重要的作用[6-9]。在机体健康状态下,Th17细胞与Treg细胞保持动态平衡。初始CD4+T淋巴细胞在转化生长因子-β(TGF-β)、IL-6等多种炎症因子的作用下可以分化为Treg细胞和Th17细胞。DC作为重要的抗原递呈细胞,在机体适应性免疫应答中发挥着重要的作用[10]。有研究显示,活动性肺结核患者体内Treg细胞数量明显增多[11],与本研究的结果相一致。本研究还发现与肺结核患者的DC共培养的初始CD4+T淋巴细胞在DC受到miR-17基因抑制时其分化发生了偏移。提示miR-17在Treg/Th17分化失衡中发挥了一定作用,也可能参与了结核分枝杆菌感染的过程。
miRNA为长度约20~24个核甘酸的非编码小分子,可与mRNA分子中的互补序列结合而切断mRNA链,影响基因表达。miRNA还能通过缩短 poly(A)尾增加mRNA的不稳定性,也可降低核糖体翻译mRNA的效率,从而导致基因沉默[12]。miRNA广泛参与细胞基因表达、信号转导、炎症反应、肿瘤发生等多种细胞反应。由于miRNA稳定性高,且能被快速定量检测,因此,可作为一种非侵袭性的生物标志物监测疾病的发生和发展[13]。当机体与结核分枝杆菌相互作用后,细胞会出现凋亡、自噬、极化和主要组织相容性复合物Ⅱ(MHCⅡ)类表达等反应。而这些细胞反应主要是由miRNA通过固有免疫和适应性免疫反应进行调节[14]。体内外研究发现,miRNA除了通过多种信号通路参与调节结核分枝杆菌感染后的机体免疫过程,还可能通过调节DC的免疫反应参与固有免疫和适应性免疫的转换[15]。Tu等[16]研究发现,肺结核患者血清中miR-17的表达明显增加。本研究也发现,肺结核患者的DC内miR-17的表达水平明显升高,可作为结核分枝杆菌感染的生物标志物。有研究显示,miR-17通过直接靶向酪氨酸蛋白激酶(janus kinase 1,JAK1) 和信号转导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)抑制IL-6家族自分泌而发挥抗炎作用[17];miR-17可以负性调节Toll样受体4(TLR4),从而抑制巨噬细胞中炎症因子IL-1β和肿瘤坏死因子-α(TNF-α)的浓度,减轻脓毒症的炎症反应[18]; miR-17 可以提高IL-18表达水平,导致中性粒细胞浸润[19]; miR-17通过降低ATP结合盒转运蛋白 A1(ABCA1)水平促进炎症细胞聚集等[20],提示miR-17可能参与结核分枝杆菌感染机体后的一系列适应性免疫应答。
Eos是由位于第12号染色体(12q13.2)上的Ikzf4基因编码的长约585aa的一种蛋白质,属于Ikaros家族锌指蛋白2中的一种。同时也是一种主要在Treg细胞中表达的转录因子,在维持Treg细胞稳定性和抑制性上起着关键性作用。有研究证实了卡介苗处理后在Treg细胞Eos基因中发现8个CpG高度去甲基化,从而更有利于促进Treg细胞的发育成熟[21]。另有研究发现,Eos与Treg细胞Foxp3形成复合物有助于维持Treg细胞的表型,且Eos下调能够诱导Treg细胞向Th辅助细胞的转化[22]。本研究发现,CD4+T淋巴细胞与转染了miR-17模拟物的DC共培养后,其Eos基因表达减少,而抑制DC的miR-17表达后,共培养的CD4+T淋巴细胞的Eos基因转录及表达均明显增加,Treg细胞分化比例明显升高,表明miR-17可能通过调节Eos的表达影响CD4+T淋巴细胞的分化,进而调节Treg/Th17的平衡。这一结果提示Eos可能是miR-17控制Th17分化的靶点,通过抑制Eos增强Th17的分化。结核分枝杆菌感染后宿主复杂的适应性免疫应答过程中,miR-17究竟通过哪些信号通路进行调节尚需进一步研究。
综上所述,结核分枝杆菌感染后导致miR-17表达增加,Eos基因参与Th17/Treg的分化,进而影响结核分枝杆菌引起的机体免疫反应。而这一免疫反应过程复杂多样,其详细的分子机制还需进一步研究。
利益冲突所有作者均声明不存在利益冲突
作者贡献盛云峰:设计实验、分析数据和论文撰写;邱美华:指导、设计和修改;陈园园和孙丽芳:数据采集和统计分析;甄利波:审阅修改
