网状蛋白1C水平与三阴性乳腺癌新辅助化疗疗效的相关性研究
2023-02-09张曼丽刘唯唯王丽娟李卫东
张曼丽,刘唯唯,王丽娟,李卫东
三阴性乳腺癌(TNBC)占乳腺癌的19%~38%,其复发率和病死率均较高[1-2]。TNBC对靶向治疗和激素治疗均不敏感,其主要治疗方法为化疗和手术[3]。新辅助化疗是TNBC的主要治疗方法之一,若新辅助化疗后病理学完全缓解,则预示TNBC 患者预后良好[4]。肿瘤形态分类及传统影像学技术对新辅助化疗疗效评估具有滞后性[5]。因此,临床需要准确度高的指标预判新辅助化疗疗效。网状蛋白1C(RTN-1C)是网状蛋白家族的一员,其主要存在于内质网膜,可调节内质网结构和功能[6]。有研究报道RTN-1C 与细胞自噬关系密切,干扰RTN-1C表达可抑制细胞自噬[7]。自噬在肿瘤发生发展过程中扮演着双重角色,适度自噬可帮助肿瘤细胞在放化疗后在不利的条件下存活,而过度自噬可促进肿瘤细胞凋亡,因此,肿瘤细胞的自噬程度与新辅助化疗疗效有关[8-10]。然而,RTN-1C 表达和TNBC 新辅助化疗疗效是否有关目前研究较少。因此,本研究分析RTN-1C和TNBC新辅助化疗疗效的关系,以期为评价新辅助化疗疗效提供参考。
1 对象与方法
1.1 研究对象 选取2017年7月—2020年12月在沧州市人民医院接受治疗的TNBC 女性患者为研究对象。TNBC 诊断参照《中国抗癌协会乳腺癌诊治指南与规范》[11]。纳入标准:(1)经病理活检及免疫组化检查确诊为TNBC。(2)TNM 分期Ⅱ~Ⅲ期。(3)接受新辅助化疗联合手术治疗方案。排除标准:(1)于新辅助化疗前接受免疫治疗。(2)临床资料不完整。(3)既往有恶性肿瘤史。(4)存在远处转移。本研究最终纳入154例TNBC患者,年龄29~66岁,平均(45.21±6.59)岁。本研究符合《世界医学协会赫尔辛基宣言》,所有受试者知情同意并签署知情同意书,经沧州市人民医院医学伦理委员会批准。
1.2 临床信息收集 收集所有受试者年龄、月经状态、病理类型、TNM分期、组织学分级和Ki-67表达>30%情况、肿瘤直径。
1.3 新辅助化疗方案 所有受试者均给予新辅助化疗,方案如下:多西他赛(75 mg/m2,浙江海正药业股份有限公司,国药准字H20093092)、表柔比星(60 mg/m2,浙江海正药业股份有限公司,国药准字H20041211)联合环磷酰胺(500 mg/m2,山西普德药业股份有限公司,国药准字H14023686),21 d 为1个疗程,所有受试者术前均接受≥4个疗程的新辅助化疗。本研究将新辅助化疗疗程结束后乳腺原发病灶中未发现恶性肿瘤的组织学证据或仅存在原位癌成分定义为病理学完全缓解[11]。
1.4 蛋白质免疫印迹法检测RTN-1C 表达水平 抽取所有受试者化疗前(T0)、化疗7 d(T1)、化疗14 d(T2)和化疗21 d(T3)空腹肘正中静脉血10 mL,采用Ficoll密度梯度离心法分离外周血单个核细胞。蛋白质免疫印迹法检测单个核细胞中RTN-1C 表达水平:(1)用RIPA 裂解液裂解单个核细胞,获取总蛋白。(2)BCA 法蛋白定量。(3)10%的SDS-PAGE 分离胶电泳,电压120 V 至溴酚蓝跑出胶面,恒流300 mA 转膜120 min,5%脱脂牛奶室温封闭1 h。(4)兔抗人RTN-1C单克隆抗体(武汉维克赛斯科技有限公司),稀释比为1∶1 000,4 ℃孵育过夜。(5)山羊抗兔二抗(北京百奥莱博科技有限公司),稀释比为1∶5 000,室温下孵育2 h。(6)ELC发光液显影,内参为β-actin,用Image J软件读取灰度值。
1.5 统计学方法 采用R(3.6.3 版)软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,2 组间比较采用独立样本t检验;重复测量数据采用单因素重复测量方差分析。计数资料以例或例(%)表示,组间比较用χ2检验。采用受试者工作特征(ROC)曲线评价RTN-1C 判断新辅助化疗疗效的效能。Logistic 回归分析新辅助化疗疗效的风险因素。构建列线图回归模型预测新辅助化疗后病理学完全缓解,一致性指数(C-index)、校准曲线(Cilibration)和决策曲线(DCA)评估模型效能。P<0.05为差异有统计学意义。
2 结果
2.1 2 组RTN-1C 表达水平比较 154 例患者中绝经者55 例;浸润性导管癌134 例,浸润性小叶癌13例,髓样癌7例;T1期11例,T2期106例,T3期37例;N0期42例,N1期70例,N2期42例;TNM分期:Ⅱ期100 例,Ⅲ期54 例;按照组织学分级,Ⅰ级27 例,Ⅱ级105 例,Ⅲ级22 例;Ki-67 表达>30%122 例。根据新辅助化疗疗效将患者分为完全缓解组(47 例)和未完全缓解组(107 例)。T1和T3时点完全缓解组的RTN-1C均低于未完全缓解组(P<0.05);2组T0、T1、T2时点的RTN-1C相对表达水平随时间进展均降低(P<0.01)。见表1、图1。
Tab.1 Comparison of RTN-1C expression levels between the two groups表1 2组RTN-1C表达水平比较(±s)
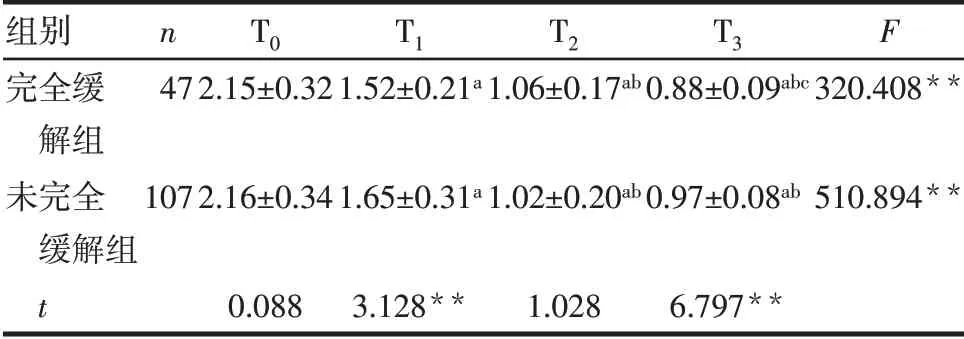
Tab.1 Comparison of RTN-1C expression levels between the two groups表1 2组RTN-1C表达水平比较(±s)
**P<0.01;a与T0比较,b与T1比较,c与T2比较,P<0.05。
组别完全缓解组未完全缓解组t n T0 T1 T2 T3 F 47 2.15±0.32 1.52±0.21a 1.06±0.17ab 0.88±0.09abc 320.408**107 2.16±0.34 1.65±0.31a 1.02±0.20ab 0.97±0.08ab 510.894**0.088 3.128**1.028 6.797**
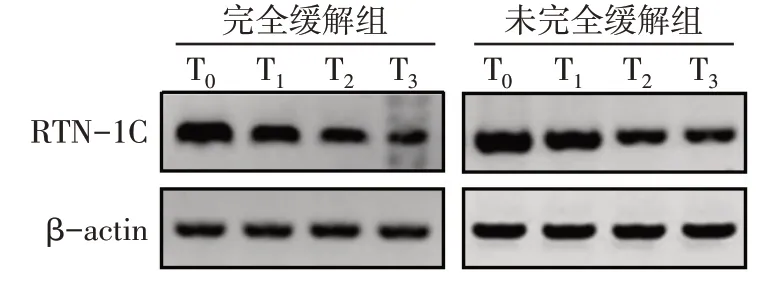
Fig.1 Western blot assay of RTN-1C expression in the two groups图1 2组RTN-1C表达的蛋白质免疫印迹图
2.2 RTN-1C 评价新辅助化疗疗效的价值 T3-RTN-1C判断新辅助化疗后病理学完全缓解的ROC曲线下面积(AUC)高于T0-RTN-1C、T1-RTN-1C 和T2-RTN-1C(Z分别为4.652、3.098 和4.509,P<0.01),最佳截断点为0.91,见表2、图2。
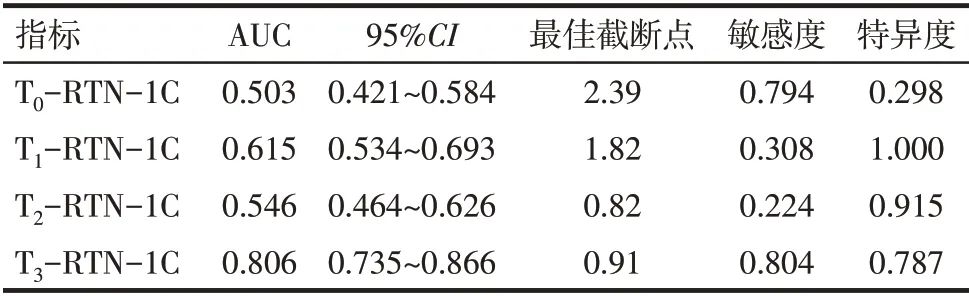
Tab.2 RTN-1C in judging the efficacy of neoadjuvant chemotherapy表2 RTN-1C判断新辅助化疗疗效
2.3 完全缓解组和未完全缓解组的基线资料比较 完全缓解组和未完全缓解组的年龄、月经状态、病理类型和肿瘤直径差异均无统计学意义(P>0.05)。完全缓解组Ki-67>30%、T3-RTN-1C≤0.91、N0 期和组织学分级Ⅰ级占比均高于未完全缓解组(P<0.05),见表3。
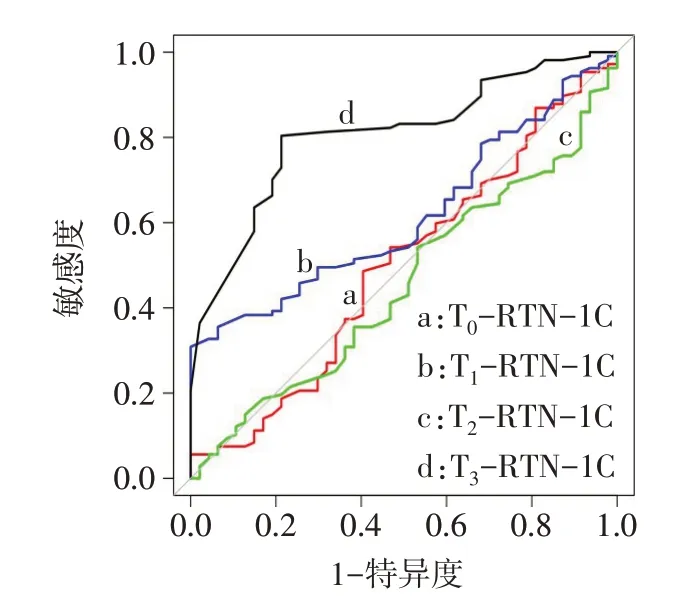
Fig.2 ROC curve of RTN-1C in judging pathological complete remission after neoadjuvant chemotherapy图2 RTN-1C判断新辅助化疗后病理学完全缓解的ROC曲线
2.4 新辅助化疗疗效的风险因素分析 以病理学是否完全缓解为因变量(完全缓解=0,未完全缓解=1),Ki-67(≤30%=0,>30%=1)、T3-RTN-1C(≤0.91=0,>0.91=1)、N 分期(N0=0,N1+N2=1)和组织学分级(Ⅰ+Ⅱ=0,Ⅲ=1)为自变量,纳入多因素Logistic回归分析,结果显示T3-RTN-1C>0.91、N1 期或N2期、组织学分级Ⅲ级是新辅助化疗后病理学未完全缓解的独立危险因素(P<0.05),见表4。
2.5 新辅助化疗后病理学完全缓解的列线图模型构建及评价 用Logistic 回归分析筛选的危险因素构建列线图模型,由N分期、组织学分级和T3-RTN-1C 构建的列线图模型A,见图3A;由N 分期和组织学分级构建的列线图模型B,见图3B。经1 000次自助重抽样,与实际情况比较,结果显示模型A的拟合曲线和理想曲线重合度较高,均方误差(MSE)为0.002,见图3C;模型B 的拟合曲线和理想曲线重合度较差,MSE 为0.003,见图3D。模型A、B 的Cindex 分别为0.866和0.772。DCA 显示,当阈值概率大于0.40 时,模型A 判断新辅助化疗后病理学完全缓解的净收益高于模型B,见图3E。
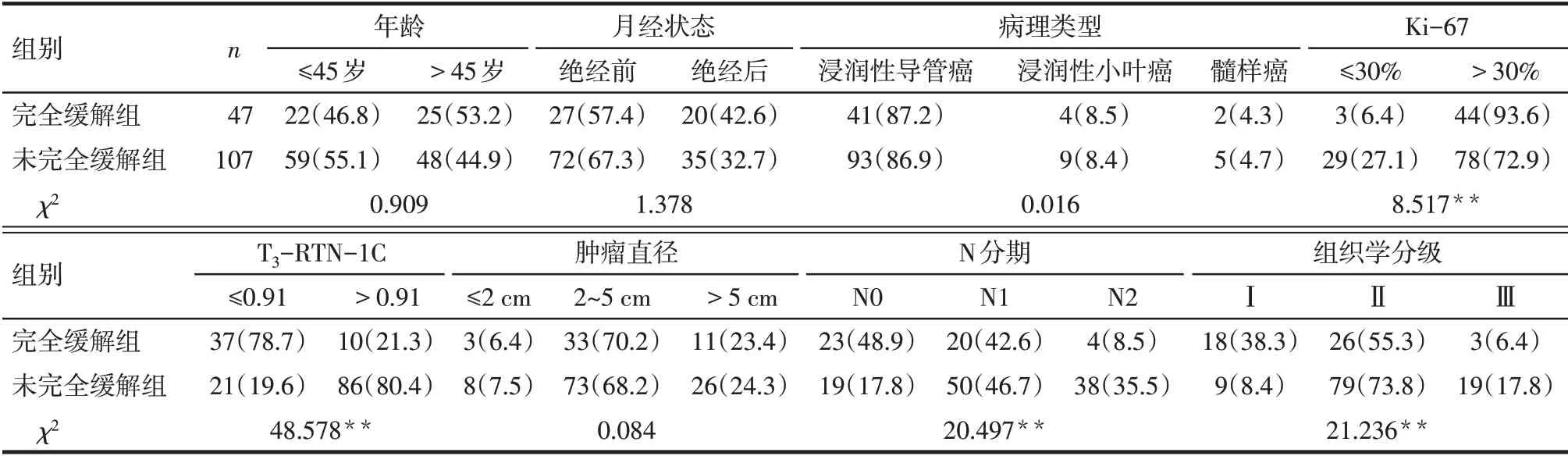
Tab.3 Comparison of baseline data between the two groups表3 2组的基线资料比较[例(%)]
3 讨论
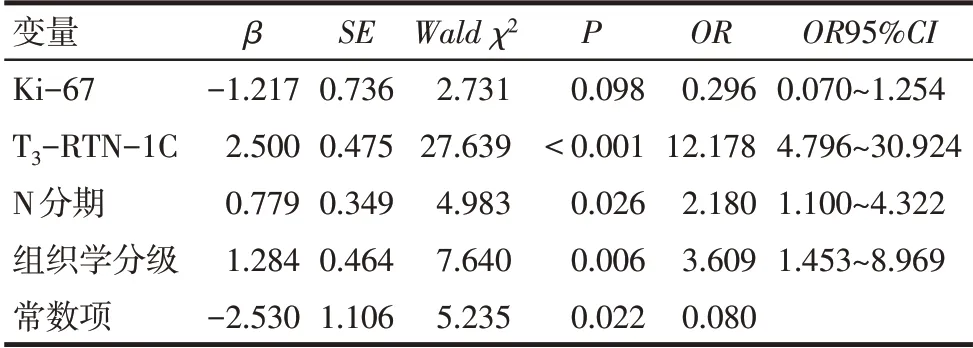
Tab.4 Logistic regression analysis of risk factors of neoadjuvant chemotherapy表4 新辅助化疗疗效风险因素的Logistic回归分析
TNBC对化疗具有一定敏感性,但经过常规化疗后预后仍较差。有研究显示,新辅助化疗可提高肿瘤手术完全切除率,延长生存时间,但新辅助化疗后未得到病理性完全缓解的TNBC 患者的预后较差[12]。准确预测新辅助化疗后病理性完全缓解不仅可用于手术切除程度评价,还可作为TNBC 患者预后标志物[13]。
化疗、放疗等抗癌疗法可诱导癌细胞自噬,从而增加抗药性[14]。目前已有研究表明癌细胞自噬与抗癌治疗疗效有关,准确了解癌细胞自噬程度或可预判抗癌治疗疗效[15-17]。细胞自噬是依靠溶酶体将细胞内受损的细胞器和大分子物质降解的过程,包括以下4个过程:双层膜的杯状分隔膜形成、自噬体形成、自噬体运输其包裹物与溶酶体融合、自噬体被溶酶体降解[18]。RTN-1C在细胞自噬过程中发挥着重要作用,其可上调LC3和自噬体积累,从而促进自噬小体形成[19]。此外,RTN-1C 还可靶向内质网应激通路调节线粒体结构和功能,促进线粒体相关内质网膜形成,从而调节自噬[7]。肿瘤及肿瘤相关免疫等疾病状态与外周血单个核细胞中部分基因或蛋白表达差异有关[20],外周血单个核细胞中某基因或蛋白表达差异可能对肿瘤诊断及预后评估有潜在价值。
本研究结果显示完全缓解组T1和T3时点RTN-1C 均低于未完全缓解组,2 组RTN-1C 相对表达水平随时间进展均降低,提示外周血单个核细胞中RTN-1C 表达水平与新辅助化疗疗效有关,其表达水平或可评价新辅助化疗疗效。本研究构建RTN-1C 判断新辅助化疗疗效的ROC 曲线结果显示T3-RTN-1C判断新辅助化疗后病理学完全缓解的AUC高于T0-RTN-1C、T1-RTN-1C 和T2-RTN-1C,表明T3-RTN-1C判断新辅助化疗后病理学完全缓解的效能较高,可辅助评价新辅助化疗疗效。
本研究中Logistic 回归分析结果显示T3-RTN-1C>0.91是新辅助化疗后病理学未完全缓解的独立危险因素,推测其原因是RTN-1C调节细胞自噬,新辅助化疗21 d后RTN-1C表达水平降低时癌细胞自噬程度降低,癌细胞此时较难通过自噬途径抑制化疗药物诱发的损伤。因此,新辅助化疗后RTN-1C表达水平降低预示病理学完全缓解。刘杰娜等[5]研究结果显示,乳腺癌患者Ki-67 高表达是新辅助化疗后病理学完全缓解的预测因子。刘德樟等[13]研究结果表明,Ki-67表达水平与新辅助化疗疗效无关。本研究结果显示Ki-67 表达与新辅助化疗疗效无关,推测该差异与乳腺癌类型、样本量及地域等因素有关,关于Ki-67 表达水平与新辅助化疗疗效的关系还需大样本、多中心研究进行证实。
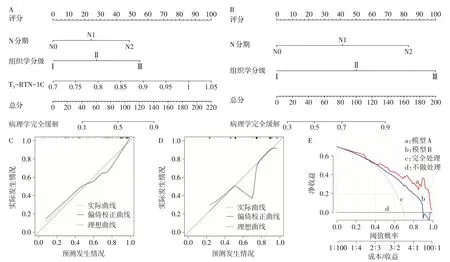
Fig.3 Construction and evaluation of nomogram model图3 列线图模型构建及评价
为弥补单指标T3-RTN-1C 评价新辅助化疗疗效的不足,本研究构建了基于T3-RTN-1C、N分期和组织学分级的列线图回归模型。模型A判断新辅助化疗后病理学完全缓解的C-index 高于模型B,MSE低于模型B,表明模型A有更高的区分度和精准度。此外,当阈值概率大于0.40时,模型A判断新辅助化疗后病理学完全缓解的净收益高于模型B。因此,本研究认为模型A对于新辅助化疗后病理学完全缓解有较高的临床应用价值,当然,还需要大样本研究验证模型A的价值。
综上所述,TNBC患者新辅助化疗后21 d外周血单个核细胞中RTN-1C表达水平高提示病理学未完全缓解风险增加。模型A判断新辅助化疗后病理学完全缓解有较高的区分度、精准度和临床应用价值。本研究尚存在一定不足:一是本研究为单中研究,纳入样本量有限,且样本选择可能存在一定选择偏倚,后续还需开展大样本、多中心研究;二是本研究未评价RTN-1C 与TNBC 远期预后的关系,后续将随访TNBC,以了解RTN-1C与TNBC远期预后的关系;三是未开展基础研究分析RTN-1C 参与TNBC 化疗的病理生理机制;四是仅分析了T0、T1、T2和T3时点的RTN-1C 与新辅助化疗后病理学完全缓解的关系,对于其他时点的RTN-1C与新辅助化疗后病理学完全缓解的关系还未可知。
