常山酮对高原肺动脉高压模型大鼠心肺功能的影响及其机制研究
2023-02-09王江涛马博华沈会华何佳尹东锋王瑞李悟
王江涛,马博华,沈会华,何佳,尹东锋,王瑞,李悟△
高原肺动脉高压(high-altitude pulmonary hypertension,HAPH)是机体暴露于海拔2 500 m 以上的高原环境后,因缺氧引起肺通气功能代偿性增加、肺血管收缩,进而导致肺动脉压力持续性增高、肺血管重构及相关心肌疾病的发生,该病的发病率及病死率均较高[1-2]。高原缺氧环境可导致肺组织低氧诱导因子-1α(HIF-1α)含量显著上调,进而促进下游血管内皮生长因子(VEGF)、内皮素-1(ET-1)等基因的表达,它们共同参与HAPH 的发生发展过程[3]。虽然近年来对低氧性肺动脉高压的研究不断增多,但其治疗措施仍不理想。常山酮(halofuginone,HF)是从植物常山中提取的喹唑酮类物质,具有抗血管肥厚、抑制细胞增殖和组织纤维化等作用,近来也被应用于肺动脉高压的研究[4],但对高原环境诱导的肺动脉高压疗效仍不明确。本研究拟通过低压低氧舱模拟海拔6 000 m高原环境,建立HAPH 大鼠模型,分析HF 对HAPH 的改善作用,并通过检测HIF-1α、VEGF及ET-1表达水平探讨其可能的机制,以期为HAPH的临床治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级8 周龄雄性SD 大鼠50 只,体质量(200±20)g,购于新疆医科大学动物中心,动物生产许可证号:SYXK(新)2016-0003。动物实验方案通过新疆军区总医院动物伦理委员会审查。
1.1.2 试剂与仪器 HF(上海易恩化学技术有限公司,纯度>97%),乌拉坦(上海泰坦科技股份有限公司,纯度>99%),肝素钠注射液(上海第一生化药业有限公司);大鼠HIF-1α、VEGF、ET-1 酶联免疫吸附试验(ELISA)试剂盒均购自上海优选生物科技有限公司。西北特殊环境人工实验舱(中国人民解放军新疆军区总医院),HX-200 小动物呼吸机、RM62160C 型多道生理信号采集处理系统及压力传感器(成都仪器厂),LEICA RM2135回旋式切片机(上海兴曼生物科技有限公司),N-117M 显微镜(济南利科医疗器械有限公司),TDZ5台式离心机(湖南赫西仪器装备有限公司),DNM-9602酶标分析仪(北京普朗新技术有限公司)。
1.2 方法
1.2.1 分组与干预 根据随机数字表法从50只雄性SD大鼠中抽取40只,于模拟6 000 m高原环境的西北特殊环境人工实验舱中(压力47.3 kPa,相对氧浓度10%)建立HAPH 大鼠模型,并分为模型组、低剂量组(HF 0.5 mg/kg)、中剂量组(HF 1 mg/kg)、高剂量组(HF 2 mg/kg);另10只作为对照组于舱外喂养,所有大鼠均可随意获取水和食物。各实验组大鼠每天药物灌胃1次,模型组和对照组给予等量蒸馏水灌胃,连续4周后进行检测。
1.2.2 平均肺动脉压(mPAP)测定 各组大鼠腹腔注射20%乌拉坦(5 mL/kg)麻醉,平卧位固定于手术台上,行气管插管术后连接小动物呼吸机(呼吸频率60次/min,潮气量6 mL,呼吸比3∶2)。待生命体征稳定后打开胸腔,充分暴露肺脏和心脏,用充满肝素化生理盐水(0.9%氯化钠溶液+25 U/mL 肝素)的硬质聚乙烯导管迅速插入右心室,导管另一端与压力传感器及生理信号记录仪相连监测压力变化,测定各组大鼠右心室收缩压(RVSP),mPAP=0.61×RVSP+2[4]。
1.2.3 右心室肥厚指数(RVHI)测定 测压后处死大鼠,取出心脏,用生理盐水冲洗,沿房室沟剪去左、右心房及大血管根部组织,沿室间隔边缘分离出右心室(RV)、左心室+室间隔(LV+S),用滤纸吸干水分后称质量,计算RVHI=RV/(LV+S)×100%。
1.2.4 肺血管重塑程度评定 切取大鼠左肺组织,置于4%多聚甲醛中固定后沿肺门横断取材,常规石蜡包埋,切片厚度约4 μm,行HE染色后在光学显微镜下观察肺小动脉变化情况。
1.2.5 ELISA 测定大鼠血清和肺组织HIF-1α、VEGF、ET-1含量 经大鼠下腔静脉取血5 mL,3 000 r/min离心10 min,留上清液备用;取大鼠右肺前叶0.1 g 匀浆后,3 000 r/min 离心10 min,留上清液备用。应用ELISA 试剂盒测定大鼠血清和肺组织中HIF-1α、VEGF、ET-1含量,操作严格按照试剂盒说明书进行。
1.3 统计学方法 采用SPSS 25.0 软件进行数据分析,所有数据以均数±标准差(±s)表示,多组间比较用单因素方差分析,组间多重比较方差齐用LSD-t检验,方差不齐用Dunnett's T3检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠mPAP 和RVHI 测定结果 与对照组比较,模型组mPAP 和RVHI 均明显升高(P<0.05);与模型组比较,低、中、高剂量组大鼠mPAP和RVHI均明显降低(P<0.05);与低剂量组比较,中、高剂量组大鼠mPAP 均明显降低(P<0.05);中剂量和高剂量组大鼠mPAP 和RVHI 差异无统计学意义。见表1。
2.2 各组大鼠肺血管形态学改变 对照组大鼠肺小动脉管壁薄、管腔大;模型组大鼠肺小动脉管壁明显增厚、管腔明显狭窄,以动脉中膜平滑肌层增厚为主,表现出肺小动脉重塑的特征;低、中、高剂量组大鼠肺小动脉重塑呈现出不同程度的减轻,以中、高剂量组改善效果显著。见图1。
Tab.1 The results of mPAP and RVHI of rats in each group表1 各组大鼠mPAP和RVHI测定结果(n=10,±s)

Tab.1 The results of mPAP and RVHI of rats in each group表1 各组大鼠mPAP和RVHI测定结果(n=10,±s)
**P<0.01;a与对照组比较,b与模型组比较,c与低剂量组比较,P<0.05;表2同;1 mmHg=0.133 kPa。
组别对照组模型组低剂量组中剂量组高剂量组F mPAP(mmHg)15.16±0.48 37.48±0.71a 32.00±0.76b 23.57±3.17bc 22.79±1.79bc 259.020**RVHI(%)22.93±1.79 54.29±4.90a 45.08±5.28b 41.52±5.59b 39.47±2.34b 71.012**
2.3 大鼠血清和肺组织HIF-1α、VEGF、ET-1 含量测定结果 与对照组比较,模型组血清和肺组织HIF-1α、VEGF、ET-1含量均明显升高(P<0.05);与模型组比较,中、高剂量组血清和肺组织HIF-1α、VEGF、ET-1 含量均降低(P<0.05),而低剂量组仅肺组织VEGF、ET-1 含量降低(P<0.05);与低剂量组比较,中、高剂量组肺组织VEGF 及ET-1 含量降低(P<0.05);中剂量组和高剂量组各指标比较差异均无统计学意义。见表2。
3 讨论
HAPH是因高原缺氧不适应或不良适应而引起的以肺动脉压持续升高、肺血管重构及肺血管平滑肌细胞过度增殖等为特征的进展性疾病,是高原肺水肿、高原心脏病等高原性疾病的初始环节[5-6]。目前临床上针对HAPH的治疗手段主要包括脱离高原环境、长期氧疗、钙离子通道阻滞剂、前列环素类药物、内皮素受体拮抗剂、磷酸二酯酶抑制剂等,但这些治疗措施仅能缓解症状,尚不能逆转疾病进展,严重影响了HAPH 患者的生活质量,因此寻找新型治疗药物迫在眉睫[7]。
HF作为中药常山的主要活性成分,已知在骨关节炎[8]、肺癌[9]、纤维化疾病[10]、自身免疫病[11]等方面疗效确切。HF能通过调节Th17和Treg细胞的平衡来改善小鼠自身免疫性关节炎[12]。HF 可以通过抑制炎性因子白细胞介素(IL)-1β、IL-6和IL-18的释放进而抑制肺纤维化及细胞凋亡,改善脂多糖诱导的大鼠急性肺损伤[13]。此外,有研究发现,HF 也可作为一种有效的肺血管扩张剂,使肺血管舒张从而减轻慢性缺氧引起的肺动脉高压,并有望成为一种治疗肺动脉高压的药物[4]。本研究基于HAPH大鼠模型的结果也显示,中、高剂量HF 对HAPH 有较明显的改善作用,能有效降低HAPH 大鼠的平均肺动脉压,减轻右心室肥厚,改善肺血管重塑。
高原环境下长期慢性缺氧会导致HIF-1α 在体内迅速累积,从而进一步激活下游基因VEGF、ET-1等异常表达[14-15]。研究表明[16],HIF 信号参与低氧性肺动脉高压的病理生理过程,是形成慢性高山病的重要因素。HIF-1α作为一种转录因子,其表达受氧气浓度影响,并与血管生成、能量代谢、红细胞生成密切相关;VEGF 和ET-1 作为HIF-1α 重要的靶基因,前者是促进新生血管形成的关键因子,后者可引起肺血管强烈收缩及血管平滑肌细胞增殖,两者共同加速肺动脉高压的形成[3]。因此,抑制HIF-1α、VEGF 及ET-1 表达可能是防治HAPH 的重要靶标。HF 已被证实对HIF-1α、VEGF 及ET-1 具有抑制作用。Kunimi 等[17]发现HF 能抑制视网膜缺血再灌注小鼠模型中HIF-1α的表达,从而起到神经保护作用。Assis等[18]进行体内和体外实验发现HF能降低骨髓中VEGF含量,抑制细胞VEGF分泌和阻断转化生长因子-β信号转导,从而减轻白血病小鼠模型的血管生成。Qin 等[19]在人诱导多能干细胞衍生的心肌细胞中发现HF能阻断与ET-1介导的病理性肥大激活相关的基因表达。但目前关于HF 在HAPH中对HIF-1α、VEGF及ET-1的研究较为缺乏。
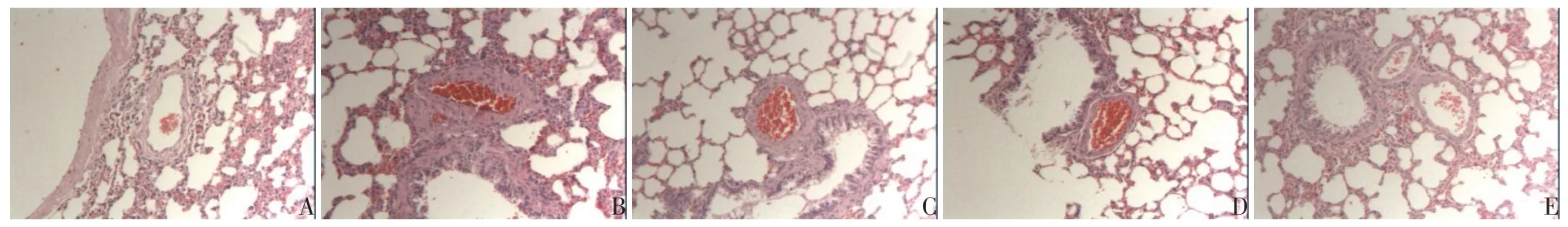
Fig.1 Morphological changes of pulmonary vessels in each group(HE staining×200)图1 各组大鼠肺血管形态学改变(HE染色,×200)
Tab.2 Comparison of HIF-1α,VEGF and ET-1 contents in serum and lung tissue between five groups of rats表2 各组大鼠血清和肺组织HIF-1α、VEGF和ET-1含量比较(n=10,ng/L,±s)

Tab.2 Comparison of HIF-1α,VEGF and ET-1 contents in serum and lung tissue between five groups of rats表2 各组大鼠血清和肺组织HIF-1α、VEGF和ET-1含量比较(n=10,ng/L,±s)
**P<0.01。
组别对照组模型组低剂量组中剂量组高剂量组F HIF-1α血清97.44±4.24 137.82±10.26a 128.59±12.65 116.79±9.07b 111.41±12.27b 23.533**肺组织101.54±12.62 153.85±10.76a 146.54±9.39 129.36±7.29b 115.90±17.67b 31.739**VEGF血清1 746.67±127.37 2 426.67±242.80a 2 315.00±165.93 1 935.00±121.02b 1 886.67±127.22b 32.135**肺组织1 236.67±139.87 1 733.33±89.39a 1 488.33±103.13b 1 336.67±116.32bc 1 281.67±88.30bc 34.113**ET-1血清357.27±7.11 500.00±61.54a 463.64±29.38 394.09±38.70b 374.09±19.62b 28.469**肺组织315.45±33.27 460.91±38.63a 400.91±19.40b 359.55±30.23bc 331.36±36.82bc 32.724**
本研究结果显示,HAPH 大鼠血清和肺组织HIF-1α、VEGF 及ET-1 水平明显升高,提示其与肺动脉压升高等症状有一定的相关性。HF干预后,在HAPH 大鼠症状有效减缓的同时,血清和肺组织HIF-1α、VEGF 及ET-1 水平也明显降低,进一步提示HF改善HAPH大鼠平均肺动脉压、右心室肥厚和肺血管重塑的作用可能与抑制HIF-1α、VEGF 及ET-1 水平相关,但关于HF 对VEGF 及ET-1 的抑制是直接作用还是由于抑制了上游HIF-1α 而起的间接作用,还有待进一步验证。
综上,HF 对大鼠HAPH 具有一定的防治作用,其机制可能与抑制HIF-1α、VEGF 及ET-1 表达有关,但具体机制尚待进一步的研究确定。
