菌草灵芝多糖肽对Caco-2细胞MDR1、MRP2基因表达水平的影响
2023-02-08周童晖孙连月林占熺
谢 晶, 周童晖, 孙连月, 李 晶, 林占熺
(1.福建农林大学国家菌草工程技术研究中心,福建 福州 350002;2.湖南人文科技学院农业与生物技术学院,湖南 娄底 417000)
Caco-2 cells
灵芝是我国传统的药食两用真菌,分布广泛.现代医学研究表明,灵芝含有多糖、多糖肽、三萜、生物碱等活性成分,具有抗氧化、抗病毒、免疫调节、保肝、降血压、改善睡眠以及抗肿瘤等作用[1-3].随着大健康时代的来临,灵芝产业发展迅速,利用菌草栽培鹿角灵芝(Ganodermaamboinense)所得的菌草灵芝,林兴生等[4]将其命名为“南GL11”,其活性成分的含量高于椴木栽培灵芝,其中,灵芝多糖肽为椴木栽培灵芝的2.8倍[5-8].
菌草灵芝多糖肽(JUNCAOGanodermalucidumpolysaccharide peptides, JCGLPP)是由菌草灵芝子实体通过切片、水提、醇沉、透析等工艺加工后得到的一种糖蛋白,由16种氨基酸和单糖结合而成,多糖含量达 87.17%,单糖由葡萄糖和甘露糖组成,氨基酸总量为 5.04%[9].JCGLPP是灵芝重要的生物活性物质之一,也是灵芝产品质量控制的指标之一.本课题组前期研究表明,JCGLPP具有增加免疫力、抗氧化、增强记忆力、抗肿瘤、减少氧化应激、减轻脂肪肝、保肝护肾等作用[10-15].
化疗是临床上用于抑制肿瘤细胞的常用方法,但由于肿瘤细胞的多药耐药性(multi-drug resistance, MDR)常导致化疗失败,其中,MDR主要机制之一是外排P-糖蛋白(P-glycoprotein, P-gp)和多药耐药相关蛋白-2(multidrug resistance associated protein-2, MRP2)的过度表达,导致肿瘤细胞主动外排药物的能力增强[16-19].在体内,参与编码P-gp和MRP2的基因分别为MDR1和MRP2[20].近年来许多研究显示,中药某些活性成分具有抑制外排蛋白表达、逆转MDR的作用,如川芎嗪、浙贝母碱、汉防己甲素、苦参碱、姜黄素、蛇床子素、芹菜素等,表明中药在逆转MDR上具有潜在的应用前景[21-24].
本试验通过建立人结肠腺癌上皮细胞(Caco-2)模型,研究JCGLPP对Caco-2细胞中P-gp编码基因MDR1和MRP2编码基因MRP2表达水平的影响,并与P-gp蛋白的抑制剂盐酸维拉帕米(verapamil hydrochloride, VER)[25]、MRP2蛋白的抑制剂丙磺舒(probenecid, PROB)[26]作比较,探讨JCGLPP是否具有抑制MDR1和MRP2基因表达的作用,旨在为其能否逆转MDR现象,发挥临床应用作用提供依据.
1 材料与方法
1.1 材料
1.1.1 细胞来源 Caco-2细胞(美国菌种保藏中心)传代至30~50代.
1.1.2 药物与试剂 JCGLPP由国家菌草工程技术研究中心提供;DMEM培养基、胎牛血清(FBS)、磷酸缓冲盐溶液(PBS)、非必需氨基酸、青霉素/链霉素、Trypsin(0.25%)购于美国Gibco公司;PROB、CCK-8试剂盒、Trizol Invitrogen购于北京索莱宝科技有限公司;VER购于上海阿拉丁生化科技股份有限公司;二甲基亚砜(DMSO)购于美国Sigma公司;反转录试剂盒(HiScript Ⅲ 1st Strand cDNA Synthesis Kit)、qPCR试剂盒购于南京诺维赞生物科技股份有限公司;其他试剂均为国产分析纯.
1.1.3 仪器与设备 BPN-150CH CO2培养箱购于上海一恒科学仪器有限公司;1-16K台式离心机购于美国Sigma公司;TS100倒置显微镜购于日本Nikon公司;5100-0001程序降温盒、Nano Drop 2000超微量分光光度计购于美国Thermo Scientific公司;Power Pac Basic电泳仪、CFX96荧光定量PCR仪购于美国Bio-Rad公司.
1.2 Caco-2细胞的培养
将Caco-2细胞接种在DMEM完全培养基[含10%胎牛血清、1%(青霉素+链霉素)、1%非必需氨基酸]上置于37 ℃、5% CO2培养箱中,培养至细胞融合度达80%~90%时即可使用,其间每天换液.
1.3 JCGLPP对Caco-2细胞存活率影响的试验
采用CCK-8比色法检测不同含量JCGLPP对Caco-2细胞存活率的影响,以VER和PROB为阳性对照药物.调整细胞浓度为1×105个·mL-1,以每孔100 μL的量接种至96孔板上,静置20 min后于37 ℃、5% CO2培养箱中预培养24 h.24 h后,吸去培养液用PBS冲洗,再分别加入JCGLPP(0.1、1、10、20、50、100、200、500 μg·mL-1)、VER(25、50、100、200 μmol·L-1)、PROB(100、500、1 000、2 000 μmol·L-1)培养24 h,测定前吸去药液,每孔加入10 μL CCK-8试剂,于培养箱中孵育1 h后,用酶标仪测定450 nm波长处的光密度(D),计算细胞存活率.
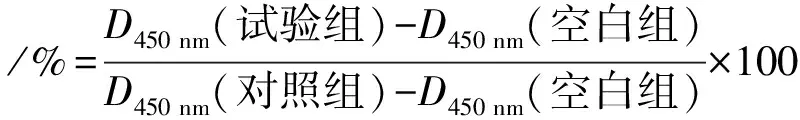
式中,孔中未加入药物的组别为对照组,孔中未接种细胞的组别为空白组.
1.4 Caco-2细胞中MDR1、MRP2基因表达水平的测定
1.4.1 试验设计及分组 试验设JCGLPP给药组(10 μg·mL-1)、VER阳性药物组(50 μmol·L-1)、PROB阳性药物组(500 μmol·L-1)、空白组、对照组.对照组加入DMEM培养基,空白组不接种细胞.每组设置6个复孔.
1.4.2 细胞总RNA的提取及反转录 取对数生长期的Caco-2细胞,调整细胞浓度为3×105个·mL-1,接种于6孔板上置于37 ℃、5% CO2培养箱中培养24 h后分别加入2 mL受试药品(JCGLPP、VER、PROB),放入培养箱中孵育1、12、24、48 h后收集细胞,提取总RNA.取4 μL 200 ng·μL-1RNA,严格按照试剂盒说明书的步骤反转录成cDNA.
1.4.3 目的基因表达水平的荧光定量PCR检测 目的基因的引物序列如表1所示.PCR反应体系:上下游引物各0.2 μL、5 μL qPCR Mix、0.5 μL cDNA、4.1 μL无核酸酶纯水.PCR反应程序:94 ℃预变性300 s,94 ℃变性45 s,55 ℃退火15 s,72 ℃延伸12 s,43个循环.

表1 荧光定量PCR引物序列Table 1 Primer sequences for real-time fluorescence quantitative PCR
根据扩增曲线读取Ct值,以GAPDH为内参基因,与各样品的目的基因MDR1和MRP2进行相对定量,利用相对定量中的 2-ΔΔCt算法分析基因的表达量.
1.5 数据处理
数据以平均值±标准差表示,应用SPSS 19.0软件进行统计分析.组间比较用单因素方差分析或t检验,P<0.05表示差异显著,具有统计学意义.
2 结果与分析
2.1 Caco-2细胞培养状态
将Caco-2细胞接种于细胞培养瓶中于37℃、5% CO2的条件下培养,24 h内细胞基本可完成贴壁生长,继续培养2~3 d,细胞生长量可达到细胞培养瓶底面积的80%~90%.在倒置显微镜下可观察到Caco-2细胞彼此间紧密相连,呈不规则状多边形,细胞间隙清晰.细胞形态如图1所示.
2.2 JCGLPP对Caco-2细胞存活率的影响
采用CCK-8比色法检测Caco-2细胞在不同水平JCGLPP、VER、PROB作用下的存活率,细胞存活率越高,表示药物对细胞毒性越低,试验结果如图2、图3所示.
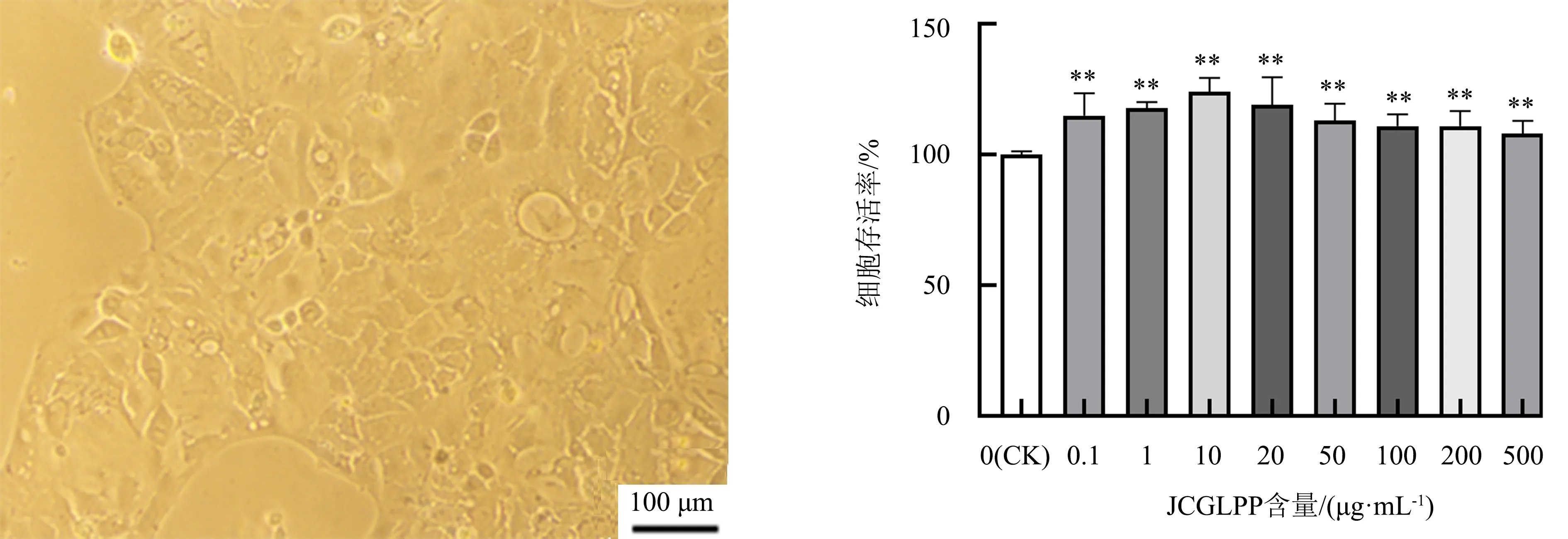
图1 Caco-2细胞形态(×200)Fig.1 Morphology of Caco-2 cells(×200)
由图2可见:与不含药物的对照组相比,各含量JCGLPP对Caco-2细胞无毒害作用,且部分含量的JCGLPP对细胞有一定的增殖活性(P<0.01);当JCGLPP含量为10 μg·mL-1时,细胞存活率为124%.因此选择10 μg·mL-1JCGLPP研究其对Caco-2细胞中MDR1和MRP2基因表达水平的影响.
由图3可见,与不含药物的对照组相比,阳性对照药物VER和PROB均对Caco-2细胞无明显的毒性作用,考虑到细胞存活率越高,越方便开展下一步试验,因此选择50 μmol·L-1VER、500 μmol·L-1PROB分别研究对Caco-2细胞中MDR1和MRP2基因表达水平的影响.

*表示与CK相比差异显著(P<0.05),**表示与CK相比差异极显著(P<0.01).图3 阳性药物对Caco-2细胞存活率的影响Fig.3 Effect of positive medicines on the survival rate of Caco-2 cells
2.3 目的基因熔解曲线和扩增曲线的构建
通过观察引物的熔解曲线和扩增曲线可以判断所选引物是否具有特异性.从图4、图5可以看出:在目的基因MDR1、MRP2和内参基因GAPDH的熔解曲线中,两尖峰无其他杂峰,上下游引物的熔解温度(Tm)为80~90 ℃,说明引物特异性较好;扩增曲线均呈“S”型走势,表明扩增状态良好.
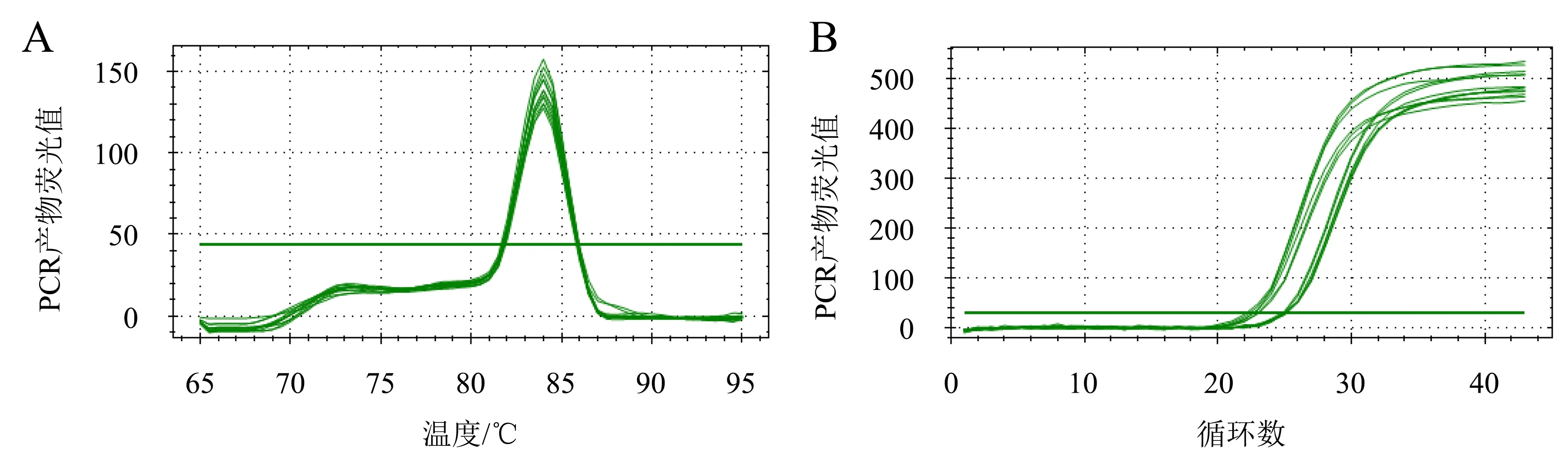
A:熔解曲线;B:扩增曲线.图4 内参基因的熔解曲线和扩增曲线Fig.4 Melting curve and amplification curve of internal reference gene
2.4 JCGLPP对Caco-2细胞MDR1基因表达水平的影响
分别用10 μg·mL-1JCGLPP和50 μmol·L-1VER给药1、12、24、48 h后测定 Caco-2细胞中MDR1基因的表达水平.结果(表2)显示:VER和JCGLPP均可显著下调MDR1基因的表达水平,且随着作用时间的延长,VER对MDR1基因的抑制效果逐渐减弱,而JCGLPP对MDR1基因的抑制效果逐渐增强;当JCGLPP作用48 h后,MDR1基因的表达水平最低,抑制作用最大.
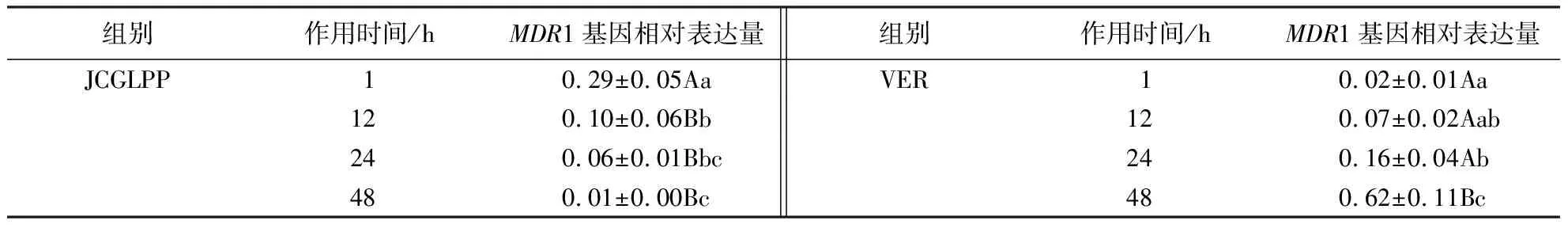
表2 JCGLPP对Caco-2细胞MDR1基因表达水平的影响1)Table 2 Effect of JCGLPP on MDR1 gene expression in Caco-2 cells at different treatment time
2.5 JCGLPP对Caco-2细胞MRP2基因表达水平的影响
分别用10 μg·mL-1JCGLPP和500 μmol·L-1PROB给药1、12、24、48 h后测定Caco-2细胞中MRP2基因的表达水平.结果(表3)显示:JCGLPP作用1 h后,MRP2基因表达变弱,但随着作用时间的延长,MRP2基因表达增强;作用1 h与作用12、24 h间、作用48 h与作用12、24 h间的表达量差异达极显著水平,表明JCGLPP对MRP2基因表达水平的影响与作用时间相关.PROB对Caco-2细胞作用1、24 h后可抑制MRP2基因的表达;作用12、48 h后可增强MRP2基因的表达.
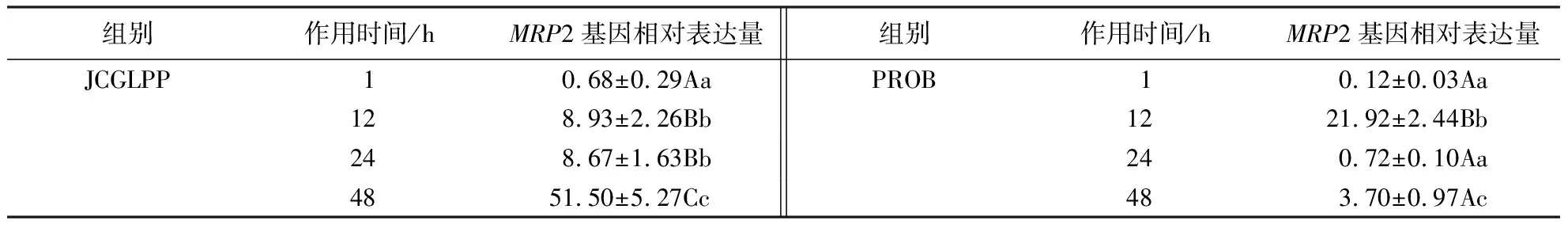
表3 JCGLPP对Caco-2细胞MRP2基因表达水平的影响1)Table3 Effect of JCGLPP on MRP2 gene expression in Caco-2 cells at different treatment time
3 结论
本研究结果表明:JCGLPP对Caco-2细胞无毒性,且呈一定的细胞增殖活性;在抑制外排蛋白P-gp的编码基因MDR1方面,JCGLPP在作用1~48 h后,显著下调了MDR1基因的表达水平,抑制作用的强弱与时间呈正相关,抑制能力优于阳性对照药物VER;在抑制外排蛋白MRP2的编码基因MRP2方面,JCGLPP在作用1 h后,下调了MRP2基因的表达水平,但在作用12、24 h后,上调了MRP2基因的表达水平.JCGLPP能在短时间内抑制MRP2基因的表达,而长时间则能促进其表达,而阳性对照药物PROB对MRP2基因的表达呈无规律状态,相关原因有待进一步研究.综上,JCGLPP可替代VER作为P-gp蛋白的抑制剂,推测JCGLPP与化疗药物共同使用时可以逆转肿瘤细胞多药耐药现象,为JCGLPP的临床应用提供参考.
