一株菌草内生细菌的分离鉴定及促生特性
2023-02-08邵登科吕正阳李望豪周瑞鹏赖泽成张春源樊改丽王荣波林占熺鲁国东叶文雨
邵登科, 吕正阳, 李望豪, 周瑞鹏, 赖泽成, 张春源, 樊改丽, 王荣波, 林占熺, 鲁国东,5, 叶文雨
(1.福建农林大学国家菌草工程技术研究中心,福建 福州 350002;2.福建农林大学生命科学学院,植物与微生物相互作用福建省高校重点实验室,福建 福州 350002;3.厦门市绿化管理中心,福建 厦门 361004;4.福建省作物有害生物监测与治理重点实验室,福建 福州 350013;5.福建农林大学植物保护学院,福建 福州 350002)
巨菌草(CenchrusfungigraminusZ. X. Lin & D. M. Lin & S. R. Lan sp. nov.)是由福建农林大学林占熺研究员从非洲引进的一类禾本科(Gramineae)的草本植物[1].巨菌草含有丰富的纤维素和粗蛋白,可以“以草代木”,为食用菌、药用菌等提供大量养分,而且巨菌草具有生物量大、资源丰富、适应性强、营养成分高和不易受到生物入侵等优点,目前在中国青海、新疆和内蒙古的沙地和盐碱地等都有巨菌草的栽培[2].
植物内生菌是一类能够与宿主植物共生的细菌,在植物中的作用非常广泛.内生菌具有一定的抗病作用,如王兰英等[3]在砂仁中分离和鉴定出一种能有效控制水稻纹枯病的内生菌.内生菌还能分泌一定量的植物生长素吲哚乙酸(indoleacetic acid, IAA)、ACC脱氨酶(1-aminocyclopropane-1-carboxylicacid deaminase)等多种生理活性物质,能够帮助植物快速生长.
类芽孢杆菌(Paenibacillus)是适用于生物防治、植物促生的重要菌种.有研究表明[4],类芽孢杆菌可产生IAA、细胞分裂素(cytokinin,CTK)、赤霉素(GA3) 和脱落酸(abscisic acid,ABA)等促生相关生长因子,能够提高植物的产量、品质以及抗逆境生长的能力.邓云[5]在小麦赤霉病抗性鉴定圃土壤中筛选出1株多粘类芽孢杆菌菌株DY04,其对小麦赤霉病的抑菌率高达58.43%,并且其促生作用可在一定程度上提高小麦的产量.牛永艳等[6]对污泥中分离出的1株多粘类芽孢杆菌SWS-15进行了一系列研究,发现其发酵液中存在IAA、CTK、GA3和ABA等生长因子,能够显著提高玉米的生物量.
本试验通过稀释涂布平板的方法,在巨菌草的健康叶片中分离并筛选出1株具有溶磷和分泌IAA能力的内生细菌,对其16S rDNA序列进行分子生物学鉴定,测定其产铁载体、蛋白水解、淀粉水解等生理生化特性并对盆栽玉米的促生效果进行研究.
1 材料与方法
1.1 材料
1.1.1 菌草 样品于2022年1月8日在福建农林大学后山菌草种植基地采集.
1.1.2 培养基 细菌生长LB 液体培养基[7],配制固体时应加2%琼脂;King液体培养基[8],用于测定菌株IAA分泌能力;有机磷细菌培养基[8]、无机磷细菌培养基[9],用于测定菌株的溶磷能力;淀粉水解培养基[7]、明胶液化培养基[7]、营养琼脂(NA)培养基[7]、脱脂乳粉培养基[10]、 CAS检测培养基(铁载体)[10]、硅酸盐细菌培养基[11],用于菌株生理生化特性测定.
1.1.3 玉米种子 郑单958品种由合肥市合丰种业有限公司提供.
1.2 方法
1.2.1 内生细菌的分离与纯化 表面消毒处理:将新鲜、健康的巨菌草叶片组织用自来水洗去表面的泥土和灰尘,洗净后切成长3 cm的片段,用75%酒精浸泡3 min,再用2%次氯酸钠浸泡2 min,用无菌水冲洗叶片3次以上,取最后1次冲洗叶片的无菌水100 μL涂布于LB平板,28 ℃培养2 d,若LB平板上无菌落生长则认为表面消毒彻底,反之则不彻底.
取表面彻底消毒的巨菌草叶片组织5 g(去掉中脉),用消毒剪刀剪碎,加入到无菌的研钵中,加无菌水研磨,将上清液稀释至1、10、102、103、104,各取100 μL稀释液涂布于LB平板上,28 ℃培养2 d后进行编号、计数.挑取不同形态的菌落于LB平板划线纯化3次以上,挑取最后1次纯化的单菌落用60%的灭菌甘油于-20 ℃保存[12-14].
1.2.2 内生细菌形态学鉴定 (1)菌落形态:将巨菌草健康叶片中分离的内生细菌用LB液体培养基活化,将菌悬液划线于LB平板并置于28 ℃培养箱,培养12 h后观察平板中菌落的形状大小、颜色变化、边缘完整和凸起情况等指标,拍照并记录特征[15].
(2)革兰氏染色:吸取处于对数生长期的10 μL菌悬液于载玻片中固定,用结晶紫对其进行初染,1 min后用无菌水进行冲洗,吸干水分后用碘液对其进行媒染,1 min后再次进行冲洗,吸干水分并用95%乙醇脱色,轻轻晃动载玻片30 s后冲洗,最后番红染色1 min,水洗后吸干水分在显微镜下观察.
1.2.3 内生细菌的筛选 将分离、纯化的内生细菌接种于LB液体培养基中活化12~18 h,使其处于对数生长期,通过溶磷能力的测定以及IAA分泌试验筛选出1株促生效果好的内生细菌[16].
(1)溶磷能力的测定:吸取处于对数生长期的菌悬液5 μL,分别接种到无机磷和有机磷细菌培养基中心,28 ℃培养5 d后,观察菌落周围透明溶解圈直径,判定菌株的溶磷能力[17].对产生的透明溶磷圈和菌落直径进行测量并计算出菌株的溶解指数(solubilization index,SI)和溶解效率(solubilization efficiency,SE).
(2)IAA分泌:试验中采用改良Salkowski比色法,参照林国钦等[18]方法进行菌株培养、比色等,用King液体培养基代替菌悬液作空白对照,向King液体培养基中加入等体积的0、10、30、50、80 μg·mL-1的3-吲哚乙酸溶液作阳性对照.每个处理3次重复,用酶标仪测量530 nm波长下的光密度,根据标准曲线计算出各菌株的IAA含量(mg·L-1).
1.2.4 分子鉴定 将筛选出的菌株FJU3进行活化,以菌悬液作为模板进行PCR扩增.所用的引物27F和1492R由天根生化科技有限公司合成[19].PCR反应体系参照刘彦超等[19]方法进行,检测基因片段约1 542 bp,电泳条带正确并送往福州擎科生物科技有限公司进行测序.
将扩增获得的基因序列提交至NCBI的GenBank基因库(https://www.ncbi.nlm.nih.gov/)进行BLAST 对比,利用MEGA-X软件,最大似然方法(maximum likelihood)构建系统发育树.
1.2.5 内生细菌生理生化特性测定 将菌株FJU3接种于LB液体培养基活化12~18 h,使其处于对数生长期,测定其生理生化特性,包括蛋白酶能力试验、淀粉水解酶试验、产铁载体能力测定、解硅酸盐能力测定、明胶液化试验、接触酶试验.以上试验按照文献[20]的方法.
1.2.6 内生细菌对玉米的促生能力测定 先将玉米种子浸泡于75%酒精3 min,置于2%次氯酸钠中再浸泡5 min,用无菌水冲洗至表面无包衣,置于含有等量营养土的盆栽,每个处理5次重复.待玉米长至三叶一心时,每盆分别灌根20 mL(D600 nm=1)的菌液,用等量的LB液体培养基灌根作为空白对照,之后每隔7 d灌根1次,待处理组与对照组植株长势出现显著差异时(20 d)分别测量鲜质量、干质量、根长、株高和茎粗等生理指标,并进行拍照记录[21-22].
2 结果与分析
2.1 内生细菌的分离
从巨菌草健康叶片中分离出5株内生细菌,分别编号为FLV1、FLV2、FJU3、FJU4和FJU5.
2.2 内生细菌形态学鉴定
形态学分析表明(图1A),在LB平板中5株内生细菌的菌落边缘整齐,呈黄色,为黏稠状,不透明,形状规则;革兰氏染色(图1B)中菌株FLV2、FJU3和FJU4为G+菌(蓝紫色),菌株FLV1和FJU5为G-菌(红色).
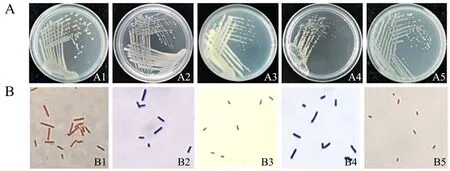
A.内生细菌的菌落形态(A1-A5:菌株FLV1、FLV2、FJU3、FJU4、FJU5);B.内生细菌的革兰氏染色(B1-B5:菌株FLV1、FLV2、FJU3、FJU4、FJU5),×100(显微镜倍数).图1 内生细菌的菌落形态及革兰氏染色Fig.1 Colony morphology and Gram-staining of endophytic bacteria
2.3 内生细菌的筛选
2.3.1 溶磷能力 除菌株FJU5外,其余4株内生细菌均能在无机磷细菌培养基中出现透明溶磷圈(图2A);有机磷细菌培养基中菌株FJU3和FJU5出现了透明溶磷圈(图2B);菌株FJU3均能在无机磷和有机磷细菌培养基中出现透明溶磷圈,则证明菌株FJU3具有一定的溶磷能力,即能将难溶性磷转变为可溶性磷(图2A-A3和图2B-B3);菌株FJU3在无机磷细菌培养基中SI和SE最高,分别为2.34和1.38,且显著高于其他菌株(图2C和2D);菌株FJU3在有机磷细菌培养基中SI和SE最高,分别为2.76和1.79,且略高于菌株FJU5(图2E和F).

A-B.内生细菌在无机磷和有机磷细菌培养基中的透明溶磷圈(A1,B1:菌株FLV1;A2,B2:菌株FLV2;A3,B3:菌株FJU3;A4,B4:菌株FJU4;A5,B5:菌株FJU5);C-D.内生细菌在无机磷中的溶解指数(SI)和溶解效率(SE),不同小写字母表示不同处理间差异显著(P<0.05);E-F.内生细菌在有机磷中的溶解指数(SI)和溶解效率(SE).图2 内生细菌的溶磷分析Fig.2 Analysis of phosphorus solubilization by endophytic bacteria
2.3.2 IAA分泌 通过改良Salkowski比色法研究表明,5株内生细菌均出现不同程度的红色(图3A).对5株内生细菌分泌IAA的能力进行定量分析,与对照组相比,菌株FJU3分泌IAA的浓度达到了14.2 mg·L-1,且显著高于其他菌株(图3B).因此,结合菌株的溶磷和IAA分泌能力,挑选菌株FJU3进行后续试验.

A.内生细菌分泌 IAA能力的定性分析(0~80:IAA标准液的浓度梯度,颜色越深其浓度越高,单位为mg·L-1;CK:King液体培养基;处理组:菌株FLV1、FLV2、FJU3、FJU4、FJU5);B.内生细菌分泌IAA能力的定量分析(CK:King液体培养基;处理组:菌株FLV1、FLV2、FJU3、FJU4、FJU5),不同小写字母表示不同处理间差异显著(P<0.05).图3 内生细菌的IAA分析Fig.3 Analysis of IAA secreted by endophytic strain
2.4 分子鉴定
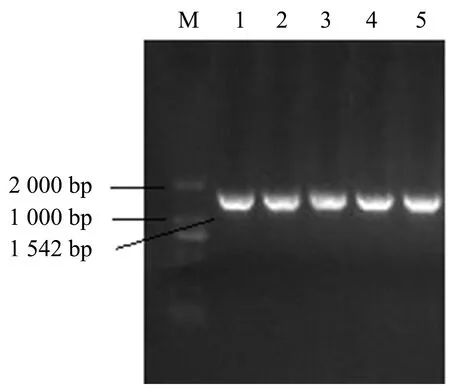
M:Marker D2000;1~5:菌株FJU3的电泳条带.图4 菌株FJU3 16S rDNA电泳结果Fig.4 Electropherogram of 16S rDNA from strain FJU3
采用细菌通用引物扩增菌株FJU3的保守序列,扩增后得到片段约1 542 bp,获得16S rDNA序列(图4).根据NCBI中BLAST搜索结果,与数据库内的已知序列进行比对分析.系统发育树表明(图5),菌株FJU3与解淀粉类芽孢杆菌(Paenibacillusamylolyticus)16S rDNA基因序列在同一分支内,亲缘关系最近,同源性为98%,因此可初步判断菌株FJU3为解淀粉类芽孢杆菌.
2.5 内生细菌生理生化特性
2.5.1 产蛋白酶能力 在蛋白酶能力试验中,菌株FJU3经过28 ℃培养5 d后,观察发现脱脂乳粉培养基中菌落周围出现了透明圈(图6A).因此,菌株FJU3能够产生一定的蛋白水解酶.
2.5.2 产淀粉水解酶能力 在淀粉水解培养基的菌落周围滴加适量碘液,观察发现菌落周围逐渐出现黄色透明圈,证明菌株FJU3能够产生淀粉水解酶(图6B).
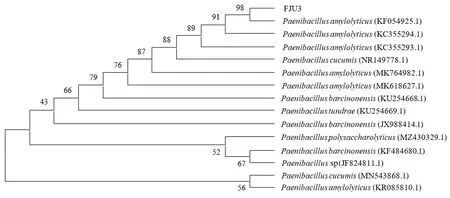
图5 菌株FJU3的系统发育树Fig.5 Phylogenetic tree of strain FJU3
2.5.3 产铁载体能力 在产铁载体能力试验中,菌株FJU3经过28 ℃培养3 d后,观察发现CAS检测培养基中出现较小的橘黄色透明圈,说明菌株FJU3能够产生一定的铁载体,但较弱(图6C).
2.5.4 解硅酸盐能力 将菌株FJU3菌悬液于硅酸盐培养基进行划线,28 ℃培养5 d后,观察发现培养基中有大量的菌落生长(图6D).因此,菌株FJU3具有降解硅酸盐能力,能够为植物提供一些微量元素.
2.5.5 明胶液化 菌株FJU3菌悬液处理后的明胶液化培养基中未出现液化现象,说明菌株FJU3不能产生明胶酶,不能使其明胶分解为氨基酸后使其失去凝聚力,此试验为阴性反应(图6E).
2.5.6 接触酶反应 取菌株FJU3菌落于载玻片,将3%的H2O2滴在载玻片上并静置3 min后进行观察,与无菌落的对照组相比,菌株FJU3具有过氧化氢酶,能形成大量氧分子,从而有气泡产生(图6F).因此,该试验为阳性反应.
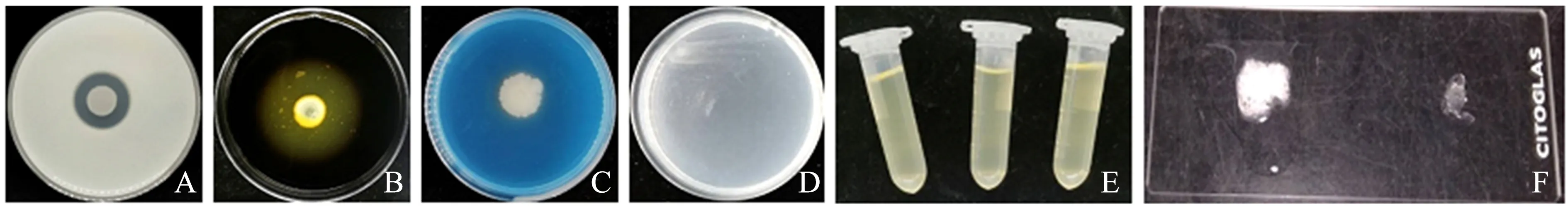
A.产蛋白酶能力;B.淀粉水解酶试验;C.产铁载体能力;D.解硅酸盐能力;E.明胶液化试验;F.接触酶试验[处理组(左),对照组(右)].图6 菌株FJU3的生理生化特性Fig.6 Physiological and biochemical characteristics of strain FJU3
2.6 玉米的盆栽试验
在玉米长到三叶一心后用菌悬液灌根处理,每7 d灌根1次,玉米生长出现明显差异时(20 d)进行指标测量.通过观察玉米幼苗的生长情况可知,经菌株FJU3菌悬液灌根处理的玉米苗干质量、鲜质量、根长、株高、茎粗等生理指标均优于对照组的玉米苗(图7A、7B).与对照组相比,菌株FJU3处理的玉米苗的地上部各项指标均有所提升,地上部鲜质量(图9A)和株高(图8C)的提升效果较显著,分别提升了76%和41%,干质量(图9B)和茎粗(图8D)分别提高38%和27%(图7C、7D和图8).菌株FJU3处理的地下部鲜质量(图9A)最高且显著高于对照组,增加了24%;干质量(图9B)与对照组相比提高了15%;根长(图10C)略有增加,仅增加了3%(图7E、7F和图9).

A.盆栽对照组(等量的LB液体培养基);B.盆栽处理组(菌株FJU3菌悬液);C.对照组株高;D.处理组株高;E.对照组根部;F.处理组根部.图7 菌株FJU3对玉米的促生作用Fig.7 Growth-promoting effect of strain FJU3 on maize
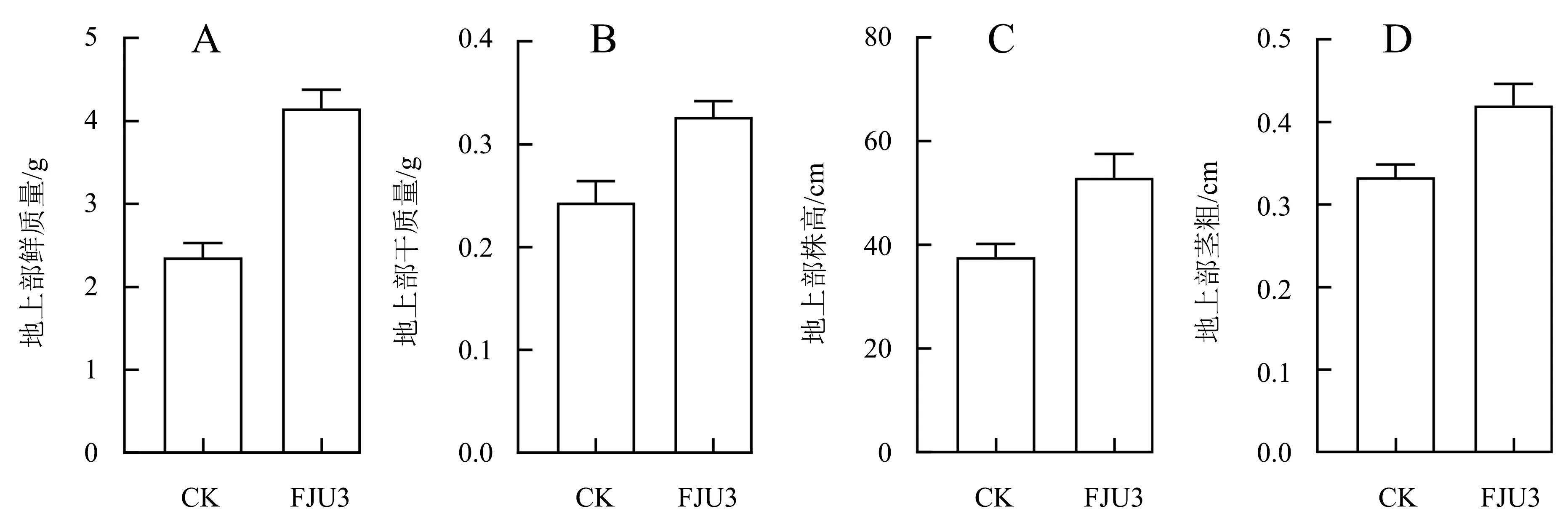
图8 菌株FJU3对玉米地上部生理指标的影响Fig.8 Effect of strain FJU3 on physiological indexes of maize aboveground part
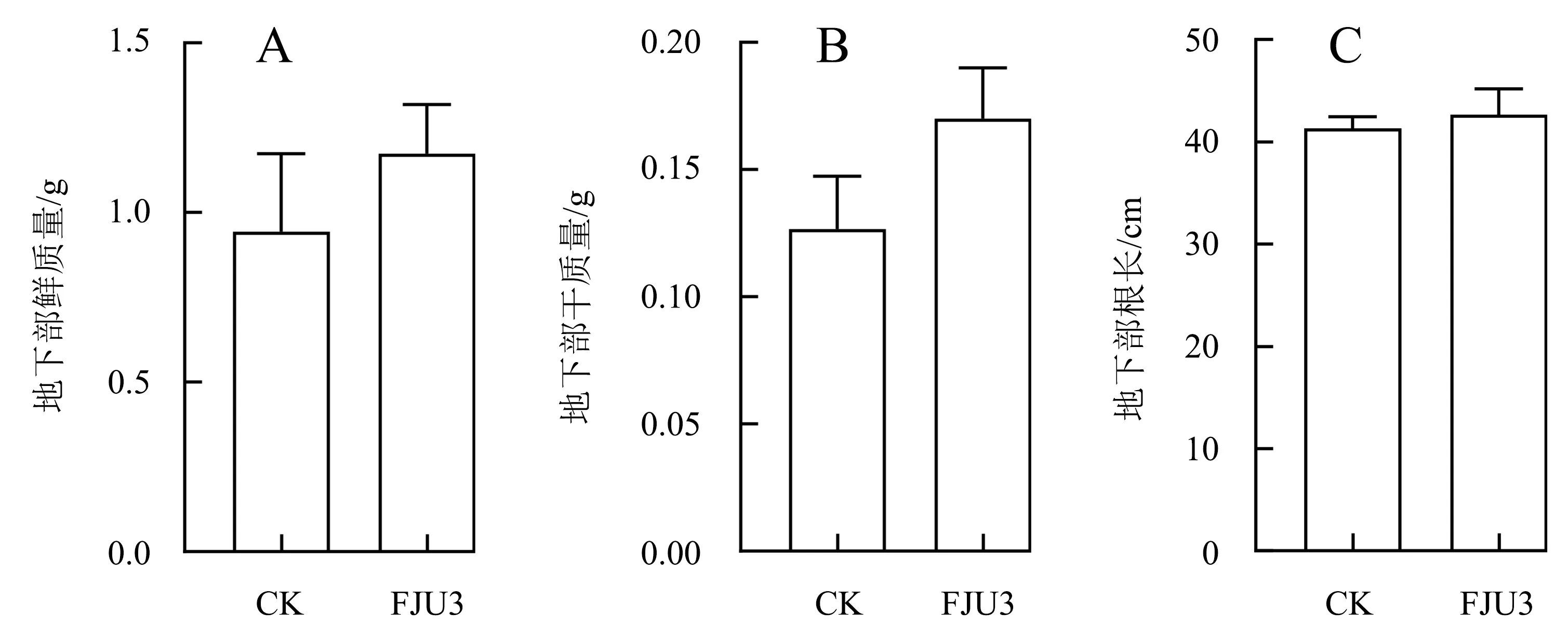
图9 菌株FJU3对玉米地下部生理指标的影响Fig.9 Effect of strain FJU3 on physiological indexes of maize underground part
3 讨论
巨菌草作为一种“致富脱贫”草,经20余年的发展和选育,为几内亚等众多贫困国家和地区的农业发展提供了帮助[23-24].邓振山等[25]在巨菌草根部共分离出103株内生细菌,在小麦盆栽试验中与对照组相比,有4株菌株能够促进小麦生长,同时也证明了用混合菌液处理小麦幼苗,其生长状况要优于单菌处理的观点.
类芽孢杆菌(Paenibacillus)作为生防菌和根际促生菌中重要的一类,能够在一定程度上提高植物干质量和鲜质量等生长指标[26].董爱菊等[27]将类芽孢杆菌菌株QHZ11-gfp定殖在马铃薯体内,使马铃薯的块茎产量得到了一定的增加.王希等[28]通过用海洋多粘类芽孢杆菌L1-9的发酵液处理黄瓜种子,发现其对黄瓜幼苗具有一定的促生效果.乔俊卿等[29]证实了芽孢杆菌菌株B1619能够促进番茄叶片的光合、蒸腾作用.崔文艳等[30]研究表明,能够促进玉米生长的解淀粉芽孢杆菌B1619-Y2同时具有分泌IAA、溶磷、解钾和固氮的性能.何碧珀等[31]研究表明,经解淀粉芽孢杆菌B10-26稀释一定倍数的发酵液对芝麻进行处理,其种子的发芽率以及幼苗鲜质量、干质量等均得到提高.
本试验从巨菌草的健康叶片中分离并筛选出1株具有溶磷和IAA分泌能力的内生细菌,经形态学和16S rDNA分子生物学鉴定为解淀粉类芽孢杆菌(Paenibacillusamylolyticus),并命名为FJU3.此外,菌株FJU3在产铁载体、接触酶、淀粉水解酶和解硅酸盐的生理生化特性试验中均为阳性反应.玉米盆栽促生试验结果表明,用菌株FJU3菌悬液处理玉米幼苗,与对照相比,促生效果比较显著的是地上部鲜质量和株高,分别提高了76%和41%,干质量和茎粗分别增加了38%和27%,在地下部中鲜质量提高了24%,干质量增加了15%,根长略有增加,仅增加了3%.因此,解淀粉类芽孢杆菌FJU3可促进玉米生物量积累,使玉米产量得到一定的提高,并可制作成微生物菌肥,减少农药以及化肥的使用,从而对改善环境起到重要作用.
